Лечение после ишемического инсульта: Лечение и реабилитация после инсульта в Москве: цена, записаться к врачу
Реабилитация после инсульта при коронавирусе в Москве — Лечение осложнений ковида при инсульте
Новый коронавирус COVID-19 оказался опаснее своих предшественников с точки зрения развития возможных осложнений. Около 6% от всех тяжёлых случаев в первой группе заболевших перенесли ишемический инсульт. Дальнейшие исследования показали, что существует особый патогенетический подтип ишемического инсульта, который напрямую связан с развитием коронавируса. В то же время существует высокий риск для постинсультного пациента инфицироваться «Ковидом-19». Таким образом, реабилитация после инсульта, в частности, уход за лежачими пациентами, должны осуществляться с учётом высокой вероятности инфицирования неврологических реабилитантов, а также проявления других осложнений, связанных с перенесённым ранее «Ковидом».
Видео о центре «Преодоление» → Наша команда → Фотопрогулка по центру →
Инсульт как последствие коронавируса
Сильный удар инфекция наносит по нервной системе. Порядка 36% случаев при тяжёлом течении заболевания сопровождаются неврологическими симптомами и синдромами. Острое нарушение мозгового кровообращения — один из них. При этом инсульт после коронавируса может случиться спустя две недели от момента предполагаемого выздоровления. Наибольшему риску такого события подвержены люди с сердечно-сосудистыми заболеваниями, склонные к образованию тромбов, нарушению мозгового кровообращения, а также пациенты с сахарным диабетом преимущественно второго типа.
Порядка 36% случаев при тяжёлом течении заболевания сопровождаются неврологическими симптомами и синдромами. Острое нарушение мозгового кровообращения — один из них. При этом инсульт после коронавируса может случиться спустя две недели от момента предполагаемого выздоровления. Наибольшему риску такого события подвержены люди с сердечно-сосудистыми заболеваниями, склонные к образованию тромбов, нарушению мозгового кровообращения, а также пациенты с сахарным диабетом преимущественно второго типа.
Одним из методов профилактики инсульта на фоне ковида и его последствий для организма является реабилитация после коронавирусной инфекции. В центре «ПРЕОДОЛЕНИЕ» пройти программу восстановительного лечения может любой человек, перенесший «Ковид-19». Особенно рекомендуется данная программа реабилитации пожилым пациентам, а также тем, кто ранее перенес инфаркт или инсульт.
Определить уровень риска развития инсульта для пациентов после «Ковида» помогает также ряд лабораторных исследований. Необходимые анализы для выявления важных в данном случае показателей сдаются при поступлении пациента на реабилитацию в наш центр. Правильно подобранная программа восстановления и профилактики позволяет существенно снизить риски острых нарушений мозгового кровообращения как у молодых, так и у пожилых пациентов. В то же время оперативный старт реабилитации после инсульта как осложнения при коронавирусе помогает пациентам избежать наиболее тяжёлых последствий приступа.
Необходимые анализы для выявления важных в данном случае показателей сдаются при поступлении пациента на реабилитацию в наш центр. Правильно подобранная программа восстановления и профилактики позволяет существенно снизить риски острых нарушений мозгового кровообращения как у молодых, так и у пожилых пациентов. В то же время оперативный старт реабилитации после инсульта как осложнения при коронавирусе помогает пациентам избежать наиболее тяжёлых последствий приступа.
К сожалению, ишемический инсульт, в том числе, случившийся на фоне COVID-19 нередко приводит к неподвижности пациента. В этих случаях за человеком устанавливается постоянное наблюдение. В реабилитационном центре он круглосуточно находится под чутким вниманием медицинского персонала и реабилитологов. Пока пациент сам не в состоянии контролировать своё тело, ему помогают отрабатывать простые движения и реакции, следят за его положением и удобством.
«Ковид-19» после инсульта
Необходимо отметить, что сам инсульт не является причиной инфицирования коронавирусом, однако то состояние, в котором пребывает пациент после приступа, формирует условия, способствующие этому. Прежде всего, происходит резкое ослабление иммунитета — организм борется с последствиями инсульта. Существенно повысить риски развития «Ковида» при инсульте могут дыхательная недостаточность, сахарный диабет, а также другие хронические заболевания. Благоприятным для заболевания условием является и постоянное пребывание пациента в лежачем положении. Это одна из причин, почему при реабилитации лежачих пациентов важно регулярно менять положение их тела: переворачивать с бока на бок, приподнимать. По мере восстановления пациента и повышения уровня его самостоятельности применяются различные методы физической реабилитации, которые помогают закреплять навыки удержания равновесия, самообслуживания и основ коммуникации с другими людьми, например, варианты обращения за помощью.
Прежде всего, происходит резкое ослабление иммунитета — организм борется с последствиями инсульта. Существенно повысить риски развития «Ковида» при инсульте могут дыхательная недостаточность, сахарный диабет, а также другие хронические заболевания. Благоприятным для заболевания условием является и постоянное пребывание пациента в лежачем положении. Это одна из причин, почему при реабилитации лежачих пациентов важно регулярно менять положение их тела: переворачивать с бока на бок, приподнимать. По мере восстановления пациента и повышения уровня его самостоятельности применяются различные методы физической реабилитации, которые помогают закреплять навыки удержания равновесия, самообслуживания и основ коммуникации с другими людьми, например, варианты обращения за помощью.
Особенно подвержены развитию коронавируса COVID-19 и пневмонии после инсульта пожилые люди, так как иммунитет таких пациентов изначально ослаблен в связи с возрастными особенностями и наличием ряда хронических заболеваний.

В индивидуально разрабатываемых реабилитационных программах центра «ПРЕОДОЛЕНИЕ» учитываются все аспекты влияния новой коронавирусной инфекции на постинсультные состояния пациентов. С целью эффективного восстановления реабилитантов применяются современные методы физической, психологической, медицинской реабилитации. Подробнее о госпитализации в наш центр вы можете узнать по телефону +7 (495) 128-77-43
Как помочь после ишемического инсульта: уход и реабилитация
Инсульт — это острое нарушение мозгового кровообращения, приводящее к разрушению ткани головного мозга. Ежегодно в России происходит 450 000 случаев инсульта — один в каждые 1,5 минуты.
Причинами возникновения ишемического инсульта могут быть атеросклероз сосудов головного мозга, ишемическая болезнь сердца с нарушениями сердечного ритма, пороки сердца, остеохондроз шейного отдела позвоночника, артериальная гипертензия. При перечисленных заболеваниях развивается непроходимость или закупорка сосудов мозга, кровоснабжение головного мозга нарушается, что ведет к обескровливанию головного мозга — ишемии. Если кровообращение в ишемизированном участке быстро не восстанавливается, мозговая ткань в нем умирает. Отмершая ткань затем постепенно рассасывается с образованием кист (дырок) в мозговом веществе.
Если кровообращение в ишемизированном участке быстро не восстанавливается, мозговая ткань в нем умирает. Отмершая ткань затем постепенно рассасывается с образованием кист (дырок) в мозговом веществе.
Последствия ишемического инсульта определяются на 90% его тяжестью и только на 10 % зависят от лечения. Поэтому профилактика инсульта во много раз эффективнее лечения, еще Гиппократ говорил: «Болезнь легче предупредить, чем лечить»
Профилактика инсульта: простые правила для предотвращения инсульта
Уход после ишемического инсульта
Больной должен находиться в светлой, защищенной от постороннего шума, хорошо проветриваемой комнате, в которой нужно регулярно, не менее 1-2 раз в сутки, проводить влажную уборку.
Помещение следует проветривать несколько раз в день таким образом, чтобы больной не находился на сквозняке, а средняя температура воздуха в комнате поддерживалась на уровне + 18-22 градуса.
Нельзя использовать кровати с прогибающейся металлической сеткой. Она должна быть жестко натянута и покрыта плотным матрацем, например поролоновым — наиболее гигиеничным и удобным.
Она должна быть жестко натянута и покрыта плотным матрацем, например поролоновым — наиболее гигиеничным и удобным.
Ухаживающему рекомендуется завести дневник, в который записывать показатели, характеризующие пациента: артериальное давление, пульс, температуру тела (ее необходимо измерять не менее 3 раз в сутки), количество употребленной жидкости (питье, жидкие блюда, жидкость введенной при помощи инфузии), количество выделенной мочи, частоту опорожнения кишечника.
Необходимо следить за регулярностью выполнения назначений врача.
Для профилактики застойных явлений в легких с лежачими больными следует несколько раз в день заниматься дыхательной гимнастикой. Самая простая разновидность дыхательных упражнений — надувание воздушного шарика.
С целью профилактики пролежней каждые 2-3 часа надо переворачивать больного в постели, выполняя при этом легкий массаж кожи на спине и боковых поверхностях грудной клетки, ягодицах (поглаживание, растирание). Под участки тела, на которых наиболее высок риск образования пролежней (пятки, локти, лопатки, ягодицы, затылок), кладут специальные надувные круги.
Необходимо следить за чистотой кожи больного: регулярно проводить туалет тела пациента смоченными в слабом мыльном растворе полотенцами, затем кожу следует вытереть насухо. В некоторых случаях для туалета кожи больного используется камфорный спирт.
После каждого приема пищи нужно очищать полость рта от остатков еды.
Обязательно следить за состоянием кожи в естественных складках (область промежности, паховые и подмышечные впадины, у женщин — под молочными железами), а также в жировых складках. Участки покраснения кожи (мацерации) следует обработать марлевым тампоном, смоченным розовым раствором перманганата калия или камфорным спиртом.
При появлении пролежней необходимо проконсультироваться с врачом по правилам их лечения.
Реабилитация после ишемического инсульта
Основные принципы
1. Раннее начало процесса реабилитации — с первых часов развития инсульта. На самом начальном этапе это прежде всего:
Правильная укладка пораженных конечностей
Для профилактики пролежней и дыхательной системы следует лежать как на здоровой, так и парализованной стороне. Здоровая нога должна быть выпрямлена, а парализованную следует немного вынести вперед, слегка согнуть и уложить на подушечку. Под парализованную руку положить подушку.
Здоровая нога должна быть выпрямлена, а парализованную следует немного вынести вперед, слегка согнуть и уложить на подушечку. Под парализованную руку положить подушку.
Чтобы лежать на больной стороне, следует под спину больного положить подушку для расслабления мышц и устойчивости, чтобы он не скатился с кровати. Парализованная рука должна быть выдвинута вперед. Руку выпрямить и уложить ладонью вверх.
Внимание: Нельзя долго лежать на парализованной стороне.
Больной может лежать с приподнятым изголовьем по 15-30 минут 3 раза в день, начиная с первых суток заболевания.
Регулярная смена положения постинсультного больного в постели
Положение тела в постели необходимо менять как можно чаще. Длительное сдавливание одних и тех же участков тела может привести к образованию пролежней.
Также менять положение больного в постели следует для улучшения работы бронхов. Если больной постоянно находится в одном и том же положении, то мокрота из некоторых бронхов под действием силы тяжести стекает в трахею и откашливается, а из других бронхов, наоборот, не оттекает. А застой в любом полом органе приводит к его воспалению. Даже при отсутствии опасных микроорганизмов в очаге застоя начинают размножаться микробы, что приводит к пневмонии, которую у ослабленного человека сложно вылечить. Частые повороты в постели позволяют избежать такого осложнения.
А застой в любом полом органе приводит к его воспалению. Даже при отсутствии опасных микроорганизмов в очаге застоя начинают размножаться микробы, что приводит к пневмонии, которую у ослабленного человека сложно вылечить. Частые повороты в постели позволяют избежать такого осложнения.
Массаж
Процедура массажа способствует общему оздоровлению организма, нормализации кровообращения в различных частях тела больного, восстановлению утраченных функций или их компенсации, нормализации мышечного тонуса, увеличению подвижности суставов, устранению трофических нарушений в парализованных конечностях. Патология связи мышц парализованной конечности с нервной системой приводит не только к обездвиживанию конечности, но и к нарушению питания тканей.
Массаж после инсульта
Лечебная физкультура (ЛФК)
Лечебная физкультура — это метод профилактики с использованием физических упражнений, часто сочетающийся с физиотерапией и массажем.
Занятия для восстановления после инсульта
Чем раньше начаты реабилитационные мероприятия, тем больше утраченных функций будут восстановлены или компенсированы.
2. Систематическое длительное лечение в течении многих месяцев, а
иногда и лет. Терапия (медикаментозная и немедикаментозная) должна продолжаться в соответствии с рекомендациями лечащего врача.
3. Реабилитация должна быть комплексной. Необходимо сочетать
медикаментозные методы лечения с физическими, психологическими и логопедическими.
4. Последовательность и этапность. На каждом этапе следует ставить
конкретные задачи по восстановлению утраченных функций. После прохождения этапа задачи меняются по мере улучшения состояния здоровья.
5. Активное участие больного и его семьи в процессе реабилитации.
Гипербарическая оксигенация
При заболеваниях, когда нарушается доставка кислорода к органам и тканям, в том числе и при ишемическом инсульте, развивается гипоксия — кислородное голодание. Мозг особенно чувствителен к недостатку кислорода и не может нормально функционировать при его дефиците. В таких ситуациях для улучшения снабжения кислородом используется современный метод лечения, разновидность кислородотерапии — гипербарическая оксигенация (ГБО).
Кислородотерапия: лечение и профилактика заболеваний
Гипербарическая оксигенация — метод лечения с использованием барокамер, в которых больной дышит воздушной смесью с концентрацией кислорода в 5 раз превышающую обычный воздух. Благодаря повышенному давлению и концентрации кислород легко и быстро растворяется в крови и с ее током разносится по всему организму. Происходит насыщение кислородом всех тканей организма, даже тех, в которых нарушено кровообращение.
В результате улучшаются обменный процессы, кровообращение, ускоряется обезвреживание и выведение из организма отработанных и вредных веществ, нормализуется работа всех внутренних органов, уменьшается потребность организма в лекарственных веществах и усиливается их лечебный эффект.
Кроме того, ГБО оказывает противоотечное действие, способствует разрастанию сосудов и восстановлению кровоснабжения пораженных областей мозга.
Лечение можно проводить только после консультации с врачом.
Физиотерапия
После инсульта назначаются электромиостимуляция, дарсонвализация (электротерапия), фарадизация (лечение с применением низкочастотного переменного тока в импульсном режиме), бальнеотерапия (водолечение), иглорефлексотерапия, светолечение и лечение ионизированным воздухом.
В Кардиологическом санаторном центре «Переделкино» проводятся сеансы физиотерапии. А также предоставляются следующие медицинские услуги: водолечение, ингаляции, лечебный массаж, фитотерапия, ЛФК и медикаментозная терапия.
Ароматерапия
Рекомендуется использование следующих эфирных масел: масла стиракса бензойного, черного перца, эвкалипта, чеснока, герани, имбиря, можжевельника, лимона, мандарина, розмарина, шалфея мускатного, тимьяна.
Масла используются для массажа, в качестве добавок для ванн, а также для ароматизации воздуха.
Восстановление речи после ишемического инсульта
Восстановление речи и памяти после инсульта — это длительный процесс, требующий больших усилий со стороны врачей, близких и, самое главное, со стороны больного. Помочь правильно восстановить речь может только логопед. Непрофессиональные попытки научить больного говорить приносят больше вреда, чем пользы.
Помочь правильно восстановить речь может только логопед. Непрофессиональные попытки научить больного говорить приносят больше вреда, чем пользы.
Инсульт: восстановление речи
В восстановлении больного, перенесшего инсульт, важнейшую роль играют врачи — неврологи и терапевты. Психологи исследуют состояние речи, чтения, письма, ориентировки в пространстве, памяти, внимания и пр.
Врачи-психотерапевты помогают облегчить страдания больного и членов его семьи по поводу его несостоятельности в различных жизненных ситуациях.
Социальные психологи работают над тем, чтобы максимально приблизить больного к прежнему положению в семье, а если это возможно, и на работе. Они помогают ему также найти свое место в обществе.
В Кардиологическом санаторном центре «Переделкино» действует медицинская программа «Восстановление», в рамках которой проводится реабилитация людей, перенесших ишемический инсульт.
В статье были использованы материалы из «Полного справочника по уходу за больными»/ сост Е. Ю. Храмова. М.: «РИПОЛ классик»
Ю. Храмова. М.: «РИПОЛ классик»
Уважаемые читатели, статьи носят ознакомительный характер. Перед применением рекомендаций необходимо проконсультироваться с врачом.
Лечение ишемического инсульта свыше 3 часов: действительно ли время мозга?
Лечение ишемического инсульта продолжительностью более 3 часов: действительно ли время мозга?
Скачать PDF
Скачать PDF
- Редакция
- Опубликовано:
- Рюдигер фон Куммер 1
Нейрорадиология том 61 , страницы 115–117 (2019)Процитировать эту статью
5243 Доступы
5 цитирований
2 Альтметрика
Сведения о показателях
С самого начала, учитывая, что благоприятный эффект был показан только у пациентов, получавших лечение в течение этого короткого периода времени, лечение ишемического инсульта внутривенным введением рекомбинантного тканевого активатора плазминогена (rt-PA) было ограничено пациентами, поступившими в течение первых 3 часов с момента появления симптомов и, таким образом, недоступен примерно для 90% пострадавших от инсульта.
Рост зоны инфаркта и исчезновение полутени при устойчивом темпе потери нервных цепей при ишемическом инсульте у человека стали популярной теорией, объясняющей прогрессирующее снижение положительного ответа на реперфузионную терапию.
Восстановление нейронов коры зависит от степени и продолжительности ишемии. [9] Нейроны могут переносить мозговой кровоток (CBF) ниже 10 мл/100 г × мин в течение максимум 30 минут и могут выдерживать ишемические значения CBF выше 18 мл/100 г × мин в течение неопределенного периода времени. Ишемическая ткань головного мозга с электрическим сбоем, но без повреждения нейронов, впервые наблюдалась в течение нескольких часов после экспериментальной окклюзии СМА у нечеловеческих приматов и впоследствии была названа «пенумбра». [10] На самом деле, исследователи обнаруживали «полутень» даже спустя годы после окклюзии СМА. [11] Современная томография головного мозга с диффузионно-взвешенной и перфузионной магнитно-резонансной томографией подтвердила эти результаты у пациентов с ишемическим инсультом, у которых не было роста инфаркта и сохранялась полутень в течение 24 часов. [12,13,14] Кроме того, аутопсии, проведенные через недели и месяцы после инсульта средней мозговой артерии (СМА), показали, что объемы инфаркта варьируют от малых до больших. [15] В соответствии с этими данными вскрытия, измерения мозгового кровотока после проксимальной окклюзии СМА у 36 пациентов с ишемическим инсультом показали изменение объема ишемического ядра от 7 до 70% объема территории СМА. Однако объем ишемического ядра не был связан со временем от начала до визуализации.
Ишемическая ткань головного мозга с электрическим сбоем, но без повреждения нейронов, впервые наблюдалась в течение нескольких часов после экспериментальной окклюзии СМА у нечеловеческих приматов и впоследствии была названа «пенумбра». [10] На самом деле, исследователи обнаруживали «полутень» даже спустя годы после окклюзии СМА. [11] Современная томография головного мозга с диффузионно-взвешенной и перфузионной магнитно-резонансной томографией подтвердила эти результаты у пациентов с ишемическим инсультом, у которых не было роста инфаркта и сохранялась полутень в течение 24 часов. [12,13,14] Кроме того, аутопсии, проведенные через недели и месяцы после инсульта средней мозговой артерии (СМА), показали, что объемы инфаркта варьируют от малых до больших. [15] В соответствии с этими данными вскрытия, измерения мозгового кровотока после проксимальной окклюзии СМА у 36 пациентов с ишемическим инсультом показали изменение объема ишемического ядра от 7 до 70% объема территории СМА. Однако объем ишемического ядра не был связан со временем от начала до визуализации.
Самый последний метаанализ данных отдельных пациентов из рандомизированных исследований внутривенной лучевой терапии показал отличные функциональные результаты (модифицированная шкала Рэнкина — mRS 0–1) после ишемического инсульта у 259/787 пациентов (32,9%), получавших внутривенную лучевую терапию. -PA в течение 3 часов и у 401/1229 пациентов (32,6%), получавших лечение более 4,5 часов. Отличные функциональные результаты наблюдались после плацебо у 176/762 пациентов (23,1%) при лечении в течение 3 часов и у 357/1166 пациентов (30,6%) при лечении более 4,5 часов. [19] Это наблюдение предполагает, что избыток пациентов со спонтанно отличными результатами в популяции с поздним лечением повлиял на снижение ответа на лечение и не указывает на неэффективность rt-PA. Небольшие очаги ишемии или спонтанная реканализация артерий могут объяснить функциональное восстановление у пациентов, получавших плацебо. Доля пациентов, получавших плацебо, с отличными функциональными результатами через 3 месяца после ишемического инсульта составила 45,2% у пациентов, включенных в сроки от 3 до 4,5 часов, и 41,8 % у пациентов с неизвестным временем начала инсульта, еще одно наблюдение предполагает, что не все инфаркты головного мозга растут. [17, 18].
[19] Это наблюдение предполагает, что избыток пациентов со спонтанно отличными результатами в популяции с поздним лечением повлиял на снижение ответа на лечение и не указывает на неэффективность rt-PA. Небольшие очаги ишемии или спонтанная реканализация артерий могут объяснить функциональное восстановление у пациентов, получавших плацебо. Доля пациентов, получавших плацебо, с отличными функциональными результатами через 3 месяца после ишемического инсульта составила 45,2% у пациентов, включенных в сроки от 3 до 4,5 часов, и 41,8 % у пациентов с неизвестным временем начала инсульта, еще одно наблюдение предполагает, что не все инфаркты головного мозга растут. [17, 18].
В исследованиях DIAS-3 и -4 и DIAS-Japan изучали эффективность и безопасность десмотеплазы через 3–9 часов после инсульта с окклюзией крупной артерии с использованием функциональной независимости (mRS 0–2) через 3 месяца в качестве первичной конечной точки. [21] В объединенном анализе ( N = 795) медиана ОТТ составила 7,1 часа, а исходная медиана оценки инсульта по шкале Национального института здравоохранения — 11 (плацебо) или 12 (десмотеплаза). Первичная конечная точка была достигнута у 182/398 пациентов, получавших десмотеплазу (45,7%), и у 167/397 пациентов, получавших плацебо (42,1%) (9).0049 p = 0,0786). Артериальная реканализация в этом позднем временном окне была достигнута у 109/220 пациентов, получавших десмотеплазу (49,5%), и у 86/224 пациентов, получавших плацебо (38,4%) ( p = 0,0168), а также была тесно связана с благоприятным функциональным результат в обеих группах лечения, предполагающий, что поздняя реканализация артерий полезна в неидентифицированной группе пациентов.
Первичная конечная точка была достигнута у 182/398 пациентов, получавших десмотеплазу (45,7%), и у 167/397 пациентов, получавших плацебо (42,1%) (9).0049 p = 0,0786). Артериальная реканализация в этом позднем временном окне была достигнута у 109/220 пациентов, получавших десмотеплазу (49,5%), и у 86/224 пациентов, получавших плацебо (38,4%) ( p = 0,0168), а также была тесно связана с благоприятным функциональным результат в обеих группах лечения, предполагающий, что поздняя реканализация артерий полезна в неидентифицированной группе пациентов.
Польза от поздней реканализации в настоящее время подтверждена двумя исследованиями тромбэктомии с поздним временным окном. После тромбэктомии через 6–24 часа после инсульта с успешной реканализацией у 84% пролеченных пациентов, 52/107 пациентов (49%) достигли функциональной независимости (mRS 0–2) через 3 месяца по сравнению с 13/99 пациентами (13%) в контрольной группе. [7] После тромбэктомии, от 6 до 16 часов инсульта с успешной реканализацией у 76% пролеченных пациентов, 41/92 пациента (45%) достигли функциональной независимости (mRS 0–2) через 3 месяца по сравнению с 15/90 пациентами (17). %) в контрольной группе. [6] Эти результаты согласуются с метаанализом первых пяти контролируемых рандомизированных исследований по тромбэктомии, в которых пациенты с успешной реканализацией через 7 часов после начала инсульта достигли функциональной независимости в 49 часов.0,8%; аналогичным образом, 46,1% пациентов достигли функциональной независимости, когда тромбэктомия была успешной через 8 часов, тогда как доля функционально независимых пациентов составила 64,1 % при реканализации через 3 часа. [20]
%) в контрольной группе. [6] Эти результаты согласуются с метаанализом первых пяти контролируемых рандомизированных исследований по тромбэктомии, в которых пациенты с успешной реканализацией через 7 часов после начала инсульта достигли функциональной независимости в 49 часов.0,8%; аналогичным образом, 46,1% пациентов достигли функциональной независимости, когда тромбэктомия была успешной через 8 часов, тогда как доля функционально независимых пациентов составила 64,1 % при реканализации через 3 часа. [20]
Таким образом, снижение ответа на внутривенное введение тромболитиков с увеличением ОТТ трудно объяснить, поскольку отсутствуют важные данные, такие как место артериальной окклюзии, длина и строение тромба, скорость реканализации, время реканализации и развитие объема инфаркта. , но поздний отбор пациентов с лучшим спонтанным прогнозом может частично объяснить этот эффект. Наоборот, эндоваскулярное лечение было изучено при более тяжелых инсультах и показало более выраженный положительный эффект по сравнению с внутривенным тромболизисом, который снижается менее резко с увеличением ОТТ. Теперь мы должны различать неудачу тромбэктомии и неудачу реперфузии ткани головного мозга. [22, 23] Однако «успешная тромбэктомия» требует четкого определения. Тромбэктомия может оказаться неудачной из-за затрудненного доступа к месту окклюзии с помощью катетера и устройства для тромбэктомии, строения тромба и/или выбранного метода тромбэктомии. Реперфузия ткани головного мозга после «успешной тромбэктомии» может не привести к функциональному восстановлению из-за неполной реперфузии, несмотря на реканализацию артерий, обширный ишемический инфаркт и/или кровоизлияние в мозг. Согласно недавним исследованиям позднего окна, пациенты с небольшим ишемическим ядром и расширенной полутенью могут иметь наилучшие шансы на выздоровление после тромбэктомии. Тем не менее, такие пациенты несут риск недостаточности коллатерального кровоснабжения и повторного инфаркта до тех пор, пока сохраняется артериальная окклюзия. Вероятно, это одна из переменных, объясняющая нарастающую неудачу поздней реперфузии и оправдывающая неотложность раннего лечения.
Теперь мы должны различать неудачу тромбэктомии и неудачу реперфузии ткани головного мозга. [22, 23] Однако «успешная тромбэктомия» требует четкого определения. Тромбэктомия может оказаться неудачной из-за затрудненного доступа к месту окклюзии с помощью катетера и устройства для тромбэктомии, строения тромба и/или выбранного метода тромбэктомии. Реперфузия ткани головного мозга после «успешной тромбэктомии» может не привести к функциональному восстановлению из-за неполной реперфузии, несмотря на реканализацию артерий, обширный ишемический инфаркт и/или кровоизлияние в мозг. Согласно недавним исследованиям позднего окна, пациенты с небольшим ишемическим ядром и расширенной полутенью могут иметь наилучшие шансы на выздоровление после тромбэктомии. Тем не менее, такие пациенты несут риск недостаточности коллатерального кровоснабжения и повторного инфаркта до тех пор, пока сохраняется артериальная окклюзия. Вероятно, это одна из переменных, объясняющая нарастающую неудачу поздней реперфузии и оправдывающая неотложность раннего лечения. К счастью, ранняя или поздняя тромбэктомия после ишемического инсульта не несет риска кровоизлияния в мозг и реперфузионной травмы. Таким образом, время не является основанием для исключения тромбэктомии у пациентов с окклюзией крупной артерии.
К счастью, ранняя или поздняя тромбэктомия после ишемического инсульта не несет риска кровоизлияния в мозг и реперфузионной травмы. Таким образом, время не является основанием для исключения тромбэктомии у пациентов с окклюзией крупной артерии.
Ссылки
Национальный институт неврологических расстройств и инсульта rt-PA Stroke Study Group (1995) Активатор тканевого плазминогена при остром ишемическом инсульте. New Engl J Med 333:1581–1587
Статья Google Scholar
Marler J, Tilley B, Lu M, Brott T, Lyden P, Grotta J et al (2000) Раннее лечение инсульта связано с лучшим исходом. Исследование инсульта NINDS rt-PA. Неврология 55:1649–1655
Артикул КАС пабмед Google Scholar
Saver JL (2006) Время измеряется мозгом. Stroke 37(1):263–266
Статья пабмед Google Scholar
«>Гоял М., Менон Б.К., Альмехлафи М.А., Демчук А., Хилл М.Д. (2017)Необходимость в более качественных данных о пациентах с острым инсультом, которые не лечатся из-за неблагоприятной визуализации. AJNR Am J Neuroradiol 38(3):424–425
Статья КАС пабмед Google Scholar
Альберс Г.В., Маркс М.П., Кемп С., Кристенсен С., Цай Дж.П., Ортега-Гутьеррес С., МакТаггарт Р., Торби М.Т., Ким-Тенсер М., Лесли-Мазви Т., Саррадж А., Каснер С.Е., Ансари С.А., Йейттс SD, Hamilton S, Mlynash M, Heit JJ, Zaharchuk G, Kim S, Carrozzella J, Palesch YY, Demchuk AM, Bammer R, Lavori PW, Broderick JP, Lansberg MG, DEFUSE 3 Investigators (2018) Тромбэктомия при инсульте от 6 до 16 часов с отбором по перфузионной визуализации.
 N Engl J Med 378 (8): 708–718
N Engl J Med 378 (8): 708–718Артикул пабмед ПабМед Центральный Google Scholar
Ногейра Р.Г., Джадхав А.П., Хауссен Д.С., Бонафе А., Будзик Р.Ф., Бхува П., Явагал Д.Р., Рибо М., Коньяр С., Ханель Р.А., Сила К.А., Хассан А.Е., Миллан М., Леви Э.И., Митчелл П., Чен M, English JD, Shah QA, Silver FL, Pereira VM, Mehta BP, Baxter BW, Abraham MG, Cardona P, Veznedaroglu E, Hellinger FR, Feng L, Kirmani JF, Lopes DK, Jankowitz BT, Frankel MR, Costalat V, Вора Н.А., Ю А.Дж., Малик А.М., Фурлан А.Дж., Рубьера М., Агаебрахим А., Оливот Дж.М., Текле В.Г., Шилдс Р., Грейвс Т., Льюис Р.Дж., Смит В.С., Либескинд Д.С., Сэвер Дж.Л., Джовин Т.Г., Исследователи DAWN Trial (2018 ) Тромбэктомия через 6-24 часа после инсульта с несоответствием между дефицитом и инфарктом. N Engl J Med 378(1):11–21
Артикул пабмед Google Scholar
«>Heiss W, Rosner G (1983)Функциональное восстановление корковых нейронов в зависимости от степени и продолжительности ишемии. Энн Нейрол 14:294–301
Артикул КАС пабмед Google Scholar
Astrup J, Siesjö B, Symon L (1981) Пороги при церебральной ишемии — ишемическая полутень. Ход 12:723–725
Статья КАС пабмед Google Scholar
Саймон Л., Брэнстон Н., Стронг А., Хоуп Т. (1977) Концепция порогов ишемии в отношении структуры и функции мозга. Джей Клин Патол 30:149–154
Артикул Google Scholar
«>Дарби Д., Барбер П., Геррати Р., Десмонд П., Ян К., Парсонс М. и др. (1999) Патофизиологическая топография острой ишемии по данным комбинированной диффузионно-взвешенной и перфузионной МРТ. Ход 30:2043–2052
Статья КАС пабмед Google Scholar
Fiehler J, Kucinski T, Knudsen K, Rosenkranz M, Thomalla G, Weiller C et al (2004) Существуют ли зависящие от времени различия в диффузии и перфузии в течение первых 6 часов после начала инсульта? Stroke 35(9):2099–2104
Статья пабмед Google Scholar
«>Jovin T, Yonas H, Gebel J, Kanal E, Chang Y, Grahovac S et al (2003) Корковое ишемическое ядро, а не постоянно присутствующая полутень, является определяющим фактором клинического исхода при острой окклюзии средней мозговой артерии. Инсульт 34: 2426–2435
Артикул пабмед Google Scholar
Hacke W, Kaste M, Bluhmki E, Brozman M, Davalos A, Guidetti D et al (2008) Тромболизис альтеплазой через 3–4,5 часа после острого ишемического инсульта. N Engl J Med 359:1317–1329
Статья КАС пабмед Google Scholar
«>Эмберсон Дж., Лис К.Р., Лайден П., Блэквелл Л., Альберс Г., Блюмки Э., Бротт Т., Коэн Г., Дэвис С., Доннан Г., Гротта Дж., Ховард Г., Касте М., Кога М., фон Куммер Р., Лансберг М., Линдли Р.И., Мюррей Г., Оливот Дж.М., Парсонс М.
 , Тилли Б., Тони Д., Тойода К., Уолгрен Н., Уордлоу Дж., Уайтли В., дель Зоппо Г., Бейджент С., Сандеркок П., Хак В., Исследователи тромболизиса инсульта Collaborative Group (2014)Влияние отсрочки лечения, возраста и тяжести инсульта на эффекты внутривенного тромболизиса альтеплазой при остром ишемическом инсульте: метаанализ данных отдельных пациентов из рандомизированных исследований. Ланцет 384(9958):1929–1935
, Тилли Б., Тони Д., Тойода К., Уолгрен Н., Уордлоу Дж., Уайтли В., дель Зоппо Г., Бейджент С., Сандеркок П., Хак В., Исследователи тромболизиса инсульта Collaborative Group (2014)Влияние отсрочки лечения, возраста и тяжести инсульта на эффекты внутривенного тромболизиса альтеплазой при остром ишемическом инсульте: метаанализ данных отдельных пациентов из рандомизированных исследований. Ланцет 384(9958):1929–1935Статья КАС пабмед ПабМед Центральный Google Scholar
Saver JL, Goyal M, van der Lugt A, Menon BK, Majoie CB, Dippel DW et al (2016) Время до лечения эндоваскулярной тромбэктомией и исходы ишемического инсульта: метаанализ. JAMA 316(12):1279–1288
Статья пабмед Google Scholar
фон Куммер Р., Мори Э., Труелсен Т., Дженсен Дж.С., Гроннинг Б.А., Фибах Дж.Б. и др. (2016) Десмотеплаза от 3 до 9часов после инсульта с окклюзией крупной артерии: исследование DIAS-4 (исследование эффективности и безопасности десмотеплазы для лечения острого ишемического инсульта).
 Stroke 47(12):2880–2887
Stroke 47(12):2880–2887Статья КАС Google Scholar
Kaesmacher J, Dobrocky T, Heldner MR, Bellwald S, Mosimann PJ, Mordasini P, Bigi S, Arnold M, Gralla J, Fischer U (2018) Систематический обзор и метаанализ различий исходов у пациентов с TICI2b по сравнению с Реперфузии TICI3: новый взгляд на успех. Дж. Нейрол Нейрохирург Психиатрия 89(9):910–917
Артикул пабмед ПабМед Центральный Google Scholar
Kaesmacher J, Gralla J, Mosimann PJ, Zibold F, Heldner MR, Piechowiak E, Dobrocky T, Arnold M, Fischer U, Mordasini P (2018) Причины реперфузионных неудач при тромбэктомии на основе стент-ретривера: анализ реестра и предложение системы классификации. AJNR Am J Neuroradiol 39(10):1848–1853
Статья КАС пабмед Google Scholar
Baron J (1999) Картирование ишемической полутени с помощью ПЭТ: значение для лечения острого инсульта. Cerebrovasc Dis 9:193–201
Статья КАС пабмед Google Scholar
Гоял М., Альмехлафи М.А., Коньяр С., МакТаггарт Р., Блэкхэм К., Бионди А. и др. (2019) Какие пациенты с острым инсультом из-за проксимальной окклюзии не должны лечиться эндоваскулярной тромбэктомией?. Нейрорадиология 61, онлайн 25 октября 2018 г.
Copen WA, Rezai Gharai L, Barak ER, Schwamm LH, Wu O, Kamalian S, Gonzalez RG, Schaefer PW (2009) Существование диффузионно-перфузионного несоответствия в течение 24 часов после начала острого инсульта: зависимость от проксимального артериальная окклюзия. Радиология 250(3):878–886
Статья пабмед Google Scholar
Zülch KJ (1981) Цереброваскулярная патология и патогенез как основа нейрорадиологического диагноза. В: Дитхельм Л., Хойк Ф., Олссон О., Стрнад Ф., Витен Х., Цуппингер А. (ред.) Энциклопедия медицинской радиологии. XIV/1А. Берлин Гейдельберг. Спрингер, Нью-Йорк, стр. 1–192
Google Scholar
Томалла Г., Симонсен К.З., Бутити Ф., Андерсен Г., Бертезен И., Ченг Б., Черипелли Б., Чо Т.Х., Фазекас Ф., Филер Дж., Форд И., Галинович И., Геллиссен С., Голсари А., Грегори Дж., Гюнтер М., Гибернау Дж., Хойслер К.Г., Хеннеричи М., Кеммлинг А., Марстранд Дж., Модрау Б., Ниб Л., Перес де ла Осса Н., Пуч Дж., Ринглеб П., Рой П., Шил Э., Шоневилле В., Серена Дж., Сунарт С., Виллрингер К., Воутерс А., Тийс В., Эбингер М., Эндрес М., Фибах Дж. Б., Лемменс Р., Мьюир К. В., Нигогоссян Н., Педраза С., Герлофф С., WAKE-UP Investigators (2018) Тромболизис под контролем МРТ при инсульте с неизвестным временем начало. N Engl J Med 379(7):611–622
Артикул пабмед Google Scholar
Скачать ссылки
Благодарность
Я благодарю доктора Лизу Бабинец за редактирование этой редакционной статьи.
Author information
Authors and Affiliations
Universitätsklinikum Dresden, Institute and Policlinic of Diagnostic and Interventional Neuroradiology, Dresden, Germany
Rüdiger von Kummer
Authors
- Rüdiger von Kummer
View author publications
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Рюдигер фон Куммер.
Декларации по этике
Финансирование
Для данного исследования не было получено финансирования.
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов.
Этическое одобрение
Все процедуры, выполненные в исследованиях с участием людей, соответствовали этическим стандартам институционального и/или национального исследовательского комитета и 1964 Хельсинкская декларация и ее более поздние поправки или сопоставимые этические стандарты.
Информированное согласие
Эта статья не содержит каких-либо исследований с участием людей или животных, проведенных автором.
Права и разрешения
Перепечатка и разрешения
Об этой статье
Стратегии увеличения временного интервала тромболизиса для лечения ишемического инсульта: неудовлетворенная клиническая потребность
1. Albers GW. Расширение возможностей тромболитической терапии при остром инсульте. Потенциальная роль острой МРТ для отбора пациентов. Ход 1999;30:2230-2237.
2. Hacke W, Kaste M, Bluhmki E, Brozman M, Dávalos A, Guidetti D, et al. Тромболизис альтеплазой через 3-4,5 часа после острого ишемического инсульта. N Engl J Med 2008; 359:1317-1329.
3. Go AS, Mozaffarian D, Roger VL, Benjamin EJ, Berry JD, Blaha MJ, et al. Статистика сердечных заболеваний и инсультов — обновление 2014 г. : отчет Американской кардиологической ассоциации. Тираж 2014;129:e28-e292.
: отчет Американской кардиологической ассоциации. Тираж 2014;129:e28-e292.
4. Группа по изучению инсульта NINDS rt-PA. Внутримозговое кровоизлияние после внутривенной терапии tPA по поводу ишемического инсульта. Ход 1997;28:2109-2118.
5. Гринберг Д.А. Нейрогенез и инсульт. Лекарственные препараты для лечения неврологических расстройств ЦНС 2007; 6:321-325.
6. Adams HP Jr, Adams RJ, Brott T, del Zoppo GJ, Furlan A, Goldstein LB, et al. Рекомендации по раннему лечению пациентов с ишемическим инсультом: научное заявление Совета по инсульту Американской ассоциации по инсульту. Ход 2003;34:1056-1083.
7. Wang X, Tsuji K, Lee SR, Ning M, Furie KL, Buchan AM, et al. Механизмы геморрагической трансформации после реперфузионной терапии тканевым активатором плазминогена при ишемическом инсульте. Ход 2004;35:2726-2730.
Ход 2004;35:2726-2730.
8. Wang W, Li M, Chen Q, Wang J. Геморрагическая трансформация после реперфузионной терапии тканевым активатором плазминогена при ишемическом инсульте: механизмы, модели и биомаркеры. Мол Нейробиол 2015;52:1572.
9. Jickling GC, Liu DZ, Stamova B, Ander BP, Zhan X, Lu A, et al. Геморрагическая трансформация после ишемического инсульта у животных и человека. J Cereb Blood Flow Metab 2014;34:185-199.
10. Лапчак П.А. Геморрагическая трансформация после ишемического инсульта: значение, причины и связь с терапией и лечением. Curr Neurol Neurosci Rep 2002; 2:38-43.
11. Won S, Lee JH, Wali B, Stein DG, Sayeed I. Прогестерон ослабляет геморрагическую трансформацию после отсроченного лечения tPA в экспериментальной модели инсульта у крыс: участие пути VEGF-MMP.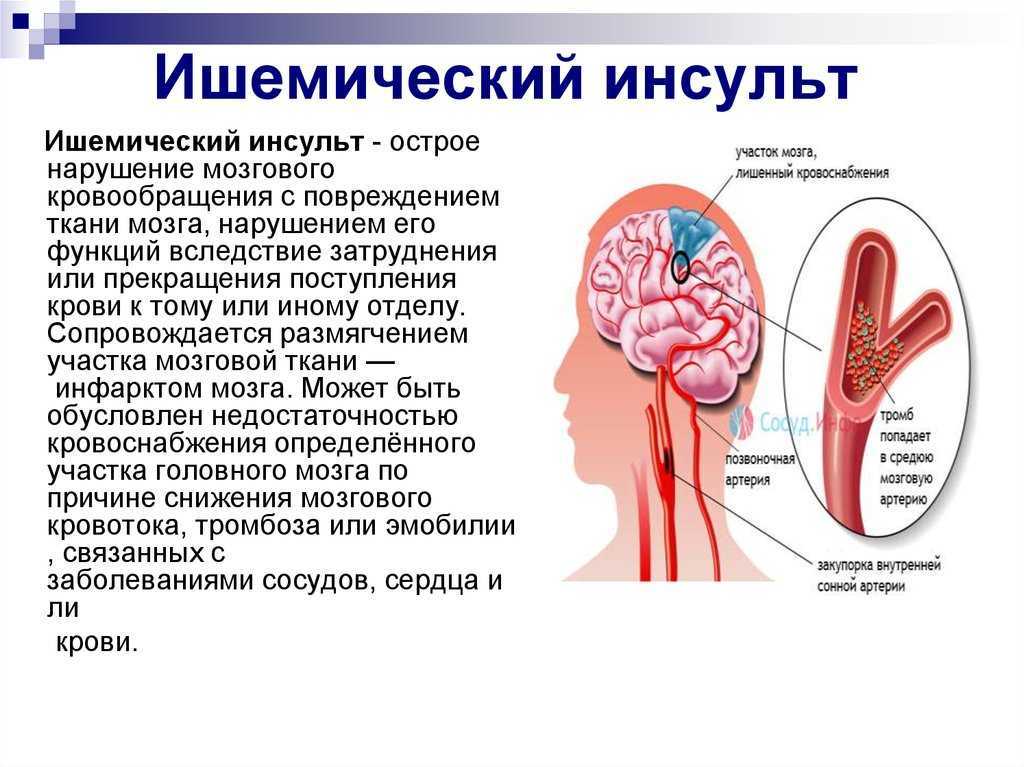 J Cereb Blood Flow Metab 2014;34:72-80.
J Cereb Blood Flow Metab 2014;34:72-80.
12. Ballabh P, Braun A, Nedergaard M. Гематоэнцефалический барьер: обзор: структура, регулирование и клинические последствия. Neurobiol Dis 2004; 16:1-13.
13. Исигуро М., Кавасаки К., Судзуки Ю., Исидзука Ф., Миширо К., Эгашира Ю. и др. Ингибитор Rho-киназы (ROCK), фасудил, предотвращает геморрагическую трансформацию, связанную с матриксной металлопротеиназой-9, у мышей, получавших тканевой активатор плазминогена. Неврология 2012;220:302-312.
14. Исигуро М., Миширо К., Фудзивара Ю., Чен Х., Изута Х., Цурума К. и др. Ингибитор фосфодиэстеразы-III предотвращает геморрагическую трансформацию, вызванную очаговой церебральной ишемией у мышей, получавших tPA. PLoS One 2010;5:e15178.
15. Мачадо Л.С., Козак А. , Эргул А., Гесс Д., Борлонган К.В., Фаган С.К. Отсроченный миноциклин ингибирует активируемые ишемией матриксные металлопротеиназы 2 и 9 после экспериментального инсульта. BMC Neurosci 2006;7:56.
, Эргул А., Гесс Д., Борлонган К.В., Фаган С.К. Отсроченный миноциклин ингибирует активируемые ишемией матриксные металлопротеиназы 2 и 9 после экспериментального инсульта. BMC Neurosci 2006;7:56.
16. Мурата Ю., Розелл А., Сканневин Р.Х., Родс К.Дж., Ван Х., Ло Э.Х. Расширение тромболитического временного окна с миноциклином при экспериментальном инсульте. Ход 2008;39:3372-3377.
17. Fagan SC, Waller JL, Nichols FT, Edwards DJ, Pettigrew LC, Clark WM, et al. Миноциклин для улучшения неврологического исхода при инсульте (MINOS): исследование по подбору дозы. Ход 2010;41:2283-2287.
18. Switzer JA, Hess DC, Ergul A, Waller JL, Machado LS, Portik-Dobos V, et al. Матриксная металлопротеиназа-9 в предварительном исследовании внутривенного введения миноциклина при остром ишемическом инсульте. Ход 2011;42:2633-2635.
19. Blacker DJ, Prentice D, Alvaro A, Bates TR, Bynevelt M, Kelly A, et al. Уменьшение геморрагической трансформации после тромболизиса при инсульте: стратегия с использованием миноциклина. Stroke Res Treat 2013;2013:362961.
20. Мацумото М. Цилостазол во вторичной профилактике инсульта: влияние исследования профилактики инсульта с применением цилостазола. Atheroscler Suppl 2005;6:33-40.
21. Koto T, Takubo K, Ishida S, Shinoda H, Inoue M, Tsubota K, et al. Гипоксия нарушает барьерную функцию нервных кровеносных сосудов за счет изменения экспрессии клаудина-5 в эндотелиальных клетках. Am J Pathol 2007;170:1389-1397.
22. Хао Дж.Л., Нагано Т., Накамура М., Кумагаи Н., Мисима Х., Нисида Т. Галардин ингибирует деградацию коллагена кератоцитами кролика путем ингибирования активации про-матриксных металлопротеиназ. Exp Eye Res 1999;68:565-572.
Exp Eye Res 1999;68:565-572.
23. Mishiro K, Ishiguro M, Suzuki Y, Tsuruma K, Shimazawa M, Hara H. Ингибитор матриксной металлопротеиназы широкого спектра действия предотвращает геморрагические осложнения, вызванные тканевым активатором плазминогена у мышей. Неврология 2012;205:39-48.
24. Mayne M, Ni W, Yan HJ, Xue M, Johnston JB, Del Bigio MR, et al. Ингибирование экспрессии фактора некроза опухоли-альфа антисмысловыми олигодезоксинуклеотидами оказывает нейропротекторное действие после внутримозгового кровоизлияния. Ход 2001;32:240-248.
25. Шибуя М., Судзуки Ю., Сугита К., Сайто И., Сасаки Т., Такакура К. и др. Влияние AT877 на спазм сосудов головного мозга после аневризматического субарахноидального кровоизлияния. J Нейросург 1992;76:571-577.
26. Fu H, Hosomi N, Pelisch N, Nakano D, Liu G, Ueno M, et al. Терапевтические эффекты постишемического лечения блокаторами рецепторов ангиотензина II в гипотензивных дозах при транзиторной очаговой ишемии головного мозга. Дж Гипертензия 2011;29:2210-2219.
Fu H, Hosomi N, Pelisch N, Nakano D, Liu G, Ueno M, et al. Терапевтические эффекты постишемического лечения блокаторами рецепторов ангиотензина II в гипотензивных дозах при транзиторной очаговой ишемии головного мозга. Дж Гипертензия 2011;29:2210-2219.
27. Ишрат Т., Пиллаи Б., Эргул А., Хафез С., Фаган С.К. Кандесартан уменьшает кровоизлияние, связанное с отсроченным введением тканевого активатора плазминогена при эмболическом инсульте у крыс. Нейрохим Рез 2013;38:2668-2677.
28. Судзуки Ю., Нагаи Н., Умемура К., Коллен Д., Лийнен Х.Р. Стромелизин-1 (ММП-3) имеет решающее значение для внутричерепного кровотечения после лечения инсульта у мышей t-PA. Дж Тромб Хемост 2007;5:1732-1739.
29. Huang Z, Huang PL, Ma J, Meng W, Ayata C, Fishman MC, et al. Увеличенные инфаркты у мышей с нокаутом эндотелиальной синтазы оксида азота ослабляются нитро-L-аргинином. J Cereb Blood Flow Metab 1996;16:981-987.
J Cereb Blood Flow Metab 1996;16:981-987.
30. Tan Z, Turner RC, Leon RL, Li X, Hongpaisan J, Zheng W, et al. Бриостатин улучшает выживаемость и уменьшает ишемическое повреждение головного мозга у старых крыс после острого ишемического инсульта. Ход 2013;44:3490-3497.
31. Tan Z, Lucke-Wold BP, Logsdon AF, Turner RC, Tan C, Li X, et al. Бриостатин продлевает временное окно tPA до 6 часов после окклюзии средней мозговой артерии у старых самок крыс. Eur J Pharmacol 2015; 764:404-412.
32. Ding Q, Chai H, Mahmood N, Tsao J, Mochly-Rosen D, Zhou W. Матриксные металлопротеиназы, модулируемые протеинкиназой Cepsilon, опосредуют резистин-индуцированную миграцию гладкомышечных клеток коронарной артерии человека. J Vasc Surg 2011;53:1044-1051.
33. Keep RF, Zhou N, Xiang J, Andjelkovic AV, Hua Y, Xi G. Сосудистые нарушения и дисфункция гематоэнцефалического барьера при внутримозговом кровоизлиянии. Жидкостные барьеры CNS 2014;11:18.
Сосудистые нарушения и дисфункция гематоэнцефалического барьера при внутримозговом кровоизлиянии. Жидкостные барьеры CNS 2014;11:18.
34. Минакшисундарам Т., Хосе А.Ф., Стивен М.Л., Джон Х.Г., Берислав В.З. Активированный протеин С способствует неоваскуляризации и нейрогенезу в постишемическом мозге через активируемый протеазой рецептор 1. J Neurosci 2008;28:12788-12797.
35. Филактакиду К.С., Хаджипаклу-Литина Д.Дж., Литинас К.Е., Николаидес Д.Н. Натуральные и синтетические производные кумарина с противовоспалительной/антиоксидантной активностью. Curr Pharm Design 2004; 30:3813-3833.
36. Zuo W, Chen J, Zhang S, Tang J, Liu H, Zhang D, et al. IMMH004 предотвращает токсичность, вызванную отсроченным лечением tPA, в крысиной модели фокальной церебральной ишемии, включающей PKA- и PI3K-зависимую активацию Akt. Eur J Neurosci 2014;39:2107-2118.
Eur J Neurosci 2014;39:2107-2118.
37. Хартунг Т. Противовоспалительные эффекты гранулоцитарного колониестимулирующего фактора. Curr Opin Hematol 1998; 5:221-225.
38. Дела Пенья И.С., Ю А., Тадзири Н., Акоста С.А., Джи С., Канеко Ю. и др. Гранулоцитарный колониестимулирующий фактор ослабляет отсроченную tPA-индуцированную геморрагическую трансформацию у крыс с ишемическим инсультом за счет усиления ангиогенеза и васкулогенеза. J Cereb Blood Flow Metab 2015;35:338-346.
39. Собрино Т., Миллан М., Кастельянос М., Бланко М., Бреа Д., Дорадо Л. и др. Ассоциация факторов роста с реканализацией артерий и клиническим исходом у пациентов с ишемическим инсультом, получавших tPA. J Thromb Haemost 2010;8:1567-1574.
40. Ullegaddi R, Powers HJ, Gariballa SE. Антиоксидантные добавки с витаминами группы В или без них после острого ишемического инсульта: рандомизированное контролируемое исследование. JPEN J Parenter Enteral Nutr 2006;30:108-114.
Антиоксидантные добавки с витаминами группы В или без них после острого ишемического инсульта: рандомизированное контролируемое исследование. JPEN J Parenter Enteral Nutr 2006;30:108-114.
41. Аллахтаваколи М., Амин Ф., Эсмаэли-Надими А., Шамзизаде А., Каземи-Арабабади М., Кеннеди Д. Аскорбиновая кислота снижает неблагоприятные последствия отсроченного введения тканевого активатора плазминогена в модели инсульта у крыс. Basic Clin Pharmacol Toxicol 2015; 117:335-339.
42. Калп В.К., Браун А.Т., Лоури Д.Д., Артур М.С., Роберсон П.К., Скиннер Р.Д. Эмульсия додекафторпентана расширяет окно для терапии tPA в модели инсульта у кроликов. Мол Нейробиол 2015;52:979-984.
43. Albers GW, Goldstein LB, Hess DC, Wechsler LR, Furie KL, Gorelick PB, et al. Рекомендации отраслевого круглого стола по лечению инсульта (STAIR) по максимальному использованию внутривенных тромболитиков и расширению вариантов лечения с помощью внутриартериальной и нейропротекторной терапии. Ход 2011;42:2645-2650.
Ход 2011;42:2645-2650.
44. Лапчак П.А., Чжан Дж.Х., Ноубл-Хеуссляйн Л.Дж. Руководство RIGOR: эскалация STAIR и STEPS для эффективного трансляционного исследования. Transl Stroke Res 2013;4:279-285.
45. Korninger C, Collen D. Исследования специфического фибринолитического действия внешнего (тканевого) активатора плазминогена человека в крови человека и у различных видов животных in vitro. Тромб Хемост 1981;46:561-565.
46. Хэлевин Б., Риссо Дж.Дж., Абраини Дж.Х. Человеческий рекомбинантный активатор тканевого плазминогена (альтеплаза): почему бы не использовать «человеческую» дозу для исследований инсульта у крыс? J Мозговой кровоток Metab 2010;30:900-903.
47. Jiang Y, Fan X, Yu Z, Cheng C, Wang XS, Lo EH, et al. Комбинация низкой дозы tPA и аннексина A2 ослабляет отсроченное кровоизлияние, связанное с лечением tPA, и улучшает восстановление после эмболического очагового инсульта у крыс. Neurosci Lett 2015;602:73-78.
Neurosci Lett 2015;602:73-78.
48. Zhu H, Fan X, Yu Z, Liu J, Murata Y, Lu J, et al. Аннексин А2 в сочетании с низкими дозами tPA улучшает тромболитическую терапию в крысиной модели фокального эмболического инсульта. J Мозговой кровоток Metab 2010;30:1137-1146.
49. Резюме Борлонган. Мобилизация стволовых клеток костного мозга при инсульте: в конце концов, «болванка» может быть полезной! Лейкемия 2011;25:1674-1686.
50. Дела Пенья И., Антуан А., Рейес С., Эрнандес Д., Акоста С., Пабон М. и др. Стратегии нейропротекции на основе стволовых клеток при инсульте. В: Шетти А.К., редактор. Нервные стволовые клетки в области здоровья и болезней Сингапур: World Scientific Publishing Co.; 2015. с. 371-408.
51. Bentley P, Ganesalingam J, Carlton Jones AL, Mahady K, Epton S, Rinne P, et al. Прогнозирование исхода тромболизиса при инсульте с помощью машинного обучения КТ головного мозга. Neuroimage Clin 2014;4:635-640.
Прогнозирование исхода тромболизиса при инсульте с помощью машинного обучения КТ головного мозга. Neuroimage Clin 2014;4:635-640.
52. Berkhemer OA, Fransen PSS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ, et al. Рандомизированное исследование внутриартериального лечения острого ишемического инсульта. N Engl J Med 2014;372:1009-1018.
53. Minnerup J, Wersching H, Teuber A, Wellmann J, Eyding J, Weber R, et al. Исход после тромбэктомии и внутривенного тромболизиса у больных с острым ишемическим инсультом: проспективное обсервационное исследование. Инсульт 2016;47:1584-1592.
54. Рубин М.Н., Барретт К.М. Что делать при инсульте после пробуждения. Неврологический госпиталь 2015;5:161-172.
55. Уайтли В.Н., Эмберсон Дж., Лиз К.Р., Блэквелл Л., Альберс Г. , Блюмки Э. и соавт. Риск внутримозгового кровоизлияния при применении альтеплазы после острого ишемического инсульта: вторичный анализ метаанализа данных отдельных пациентов. Ланцет Нейрол 2016;15:925-933.
, Блюмки Э. и соавт. Риск внутримозгового кровоизлияния при применении альтеплазы после острого ишемического инсульта: вторичный анализ метаанализа данных отдельных пациентов. Ланцет Нейрол 2016;15:925-933.
56. Амаро С., Ларедо С., Рену А., Лулль Л., Рудилоссо С., Обач В. и другие. Терапия мочевой кислотой предупреждает раннее прогрессирование ишемического инсульта: третичный анализ исследования URICO-ICTUS (исследование эффективности комбинированного лечения мочевой кислотой и р-тАП при остром ишемическом инсульте). Ход 2016;47:2874-2876.
57. Toni D, Fiorelli M, Gentile M, Bastianello S, Sacchetti ML, Argentino C, et al. Прогрессирующий неврологический дефицит на фоне острого ишемического инсульта. Исследование предсказуемости, патогенеза и прогноза. Arch Neurol 1995;52:670-675.
58. Парсонс М., Спратт Н.


 N Engl J Med 378 (8): 708–718
N Engl J Med 378 (8): 708–718 , Тилли Б., Тони Д., Тойода К., Уолгрен Н., Уордлоу Дж., Уайтли В., дель Зоппо Г., Бейджент С., Сандеркок П., Хак В., Исследователи тромболизиса инсульта Collaborative Group (2014)Влияние отсрочки лечения, возраста и тяжести инсульта на эффекты внутривенного тромболизиса альтеплазой при остром ишемическом инсульте: метаанализ данных отдельных пациентов из рандомизированных исследований. Ланцет 384(9958):1929–1935
, Тилли Б., Тони Д., Тойода К., Уолгрен Н., Уордлоу Дж., Уайтли В., дель Зоппо Г., Бейджент С., Сандеркок П., Хак В., Исследователи тромболизиса инсульта Collaborative Group (2014)Влияние отсрочки лечения, возраста и тяжести инсульта на эффекты внутривенного тромболизиса альтеплазой при остром ишемическом инсульте: метаанализ данных отдельных пациентов из рандомизированных исследований. Ланцет 384(9958):1929–1935 Stroke 47(12):2880–2887
Stroke 47(12):2880–2887