Исследование плотности костной ткани: Денситометрия: измерение плотности костной ткани в Москве | Цена на исследование и проверку плотности костей на остеопороз в Центре Дикуля
Минеральная плотность костной ткани и кальций-фосфорный обмен у больных сахарным диабетом типа 1 | Косарева
Проблема остеопороза в связи с его широкой распространенностью, тяжестью осложнений, часто приводящих к инвалидизации и даже смерти больных, высокой стоимостью лечения и профилактики в 90-е годы XX века вышла по значимости на 4-е место после сердечно-сосудистых, онкологических заболеваний и сахарного диабета (СД) [3, 4, 7, 8, 11-13].
В современной классификации остеопороза [5, 9] к группе вторичных остеопорозов, связанных с заболеваниями эндокринной системы, относится и остеопороз при СД типа 1 (СД1). Однако исследований, посвященных этому вопросу, явно недостаточно [5, 6].
Целью исследования явились оценка состояния минеральной плотности костной ткани (МПКТ), показателей ее метаболизма и кальций-фосфорного обмена у больных СД1, повышение эффективности диагностики остеопороза при этом заболевании.
Материалы и методы
Обследовано 95 больных СД1: 44 мужчины в возрасте 34,2 ± 2,1 года с длительностью заболевания 9,8 ± 1,6 года и 51 женщина в возрасте 35,8 ± 1,9 года с длительностью заболевания
- ± 1,8 года, а также 65 человек контрольной группы: 32 мужчины и 33 женщины в возрасте
- ± 0,9 года.

У обследованных больных были выявлены следующие осложнения СД: у 89 (93,7%) — диабетический гепатоз, у 88 (92,6%) — ангиопатия и нейропатия нижних конечностей, из них у 12 (12,6%) с трофическими нарушениями кожи (больных с синдромом диабетической стопы в исследуемую группу не включали, у 83 (87,4%) — простая ретинопатия, у 11 (11,6%) — пролиферативная ретинопатия. У 49 пациентов с СД 1 была обнаружена диабетическая нефропатия: I стадии — у 27 (28,4%), II стадии — у 22 (23,1%). Пациентов с III стадией нефропатии в опытную группу не включали. У 3 (5,9%) пациенток в возрасте 43-44 лет была ранняя менопауза, а у 14 (27,4%) — нарушения по типу гипо- и опсоменореи.
Методом ультразвуковой денситометрии оценивали Stiffness — аналог МПКТ («Achilles+», Lunar, США). Основными показателями, характеризующими МПКТ, поданным денситометрического исследования, являются индексы Т и Z. Результаты выражают в единицах стандартного отклонения (SD) к соответствующей норме.
Согласно рекомендациям ВОЗ, диагностику остеопороза проводили на основании индекса Т: за норму принимали отклонения менее чем на 1 SD, т.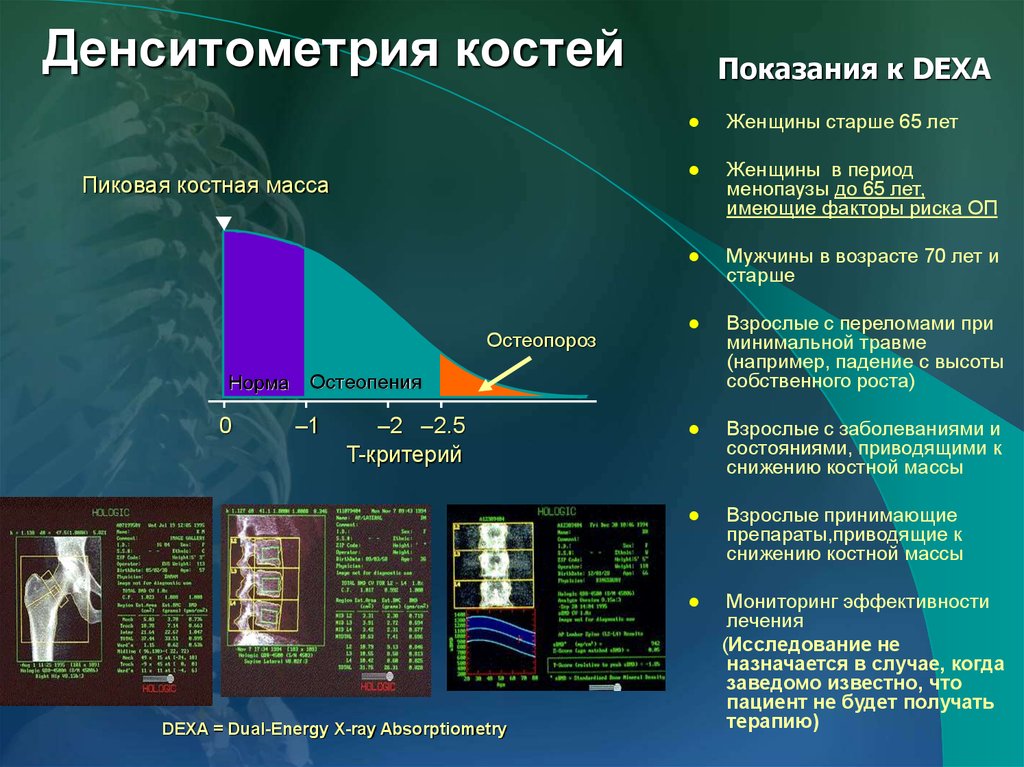 е. выше чем -1SD; значения меньше -1SD, но больше -2,5SD оценивали как остеопению, значения индекса Т меньше -2,5SD — как остеопороз.
е. выше чем -1SD; значения меньше -1SD, но больше -2,5SD оценивали как остеопению, значения индекса Т меньше -2,5SD — как остеопороз.
Показатели кальций-фосфорного обмена оценивали по концентрации общего кальция и неорганического фосфора в сыворотке крови, а также по уровню их экскреции с мочой натощак по отношению к экскреции креатинина (Кр). О состоянии формирования костной ткани судили по активности общей щелочной фосфатазы (ЩФ) и содержанию остеокальцина (ОК) в сыворотке крови, об уровне резорбции костной ткани — по содержанию оксипролина (ОПР) в моче по отношению к экскреции Кр.
Исследовали также уровни паратгормона (ПТГ), тестостерона, лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов.
Полученные данные обрабатывали статистически с использованием /-критерия Стьюдента.
Результаты и их обсуждение
Известно, что дефицит половых гормонов существенно влияет на МПКТ и ее метаболизм [2, 10], поэтому у части больных СД и лиц контрольной группы определяли уровень ФСГ и ЛГ, а у мужчин — и тестостерона. Отсутствие достоверных различий уровня ЛГ, ФСГ у женщин и ЛГ, ФСГ, тестостерона у мужчин, больных СД1 и лиц контрольной группы этого же возраста позволяет, по нашему мнению, исключить дополнительное влияние этой группы гормонов на МПКТ.
Отсутствие достоверных различий уровня ЛГ, ФСГ у женщин и ЛГ, ФСГ, тестостерона у мужчин, больных СД1 и лиц контрольной группы этого же возраста позволяет, по нашему мнению, исключить дополнительное влияние этой группы гормонов на МПКТ.
Анализ данных денситометрических исследований показал, что при СД1 снижение МПКТ (табл. 1) было обнаружено у 64,2% больных, причем у мужчин и женщин практически с одинаковой частотой (63,6 и 64,7%), в контрольной группе снижение МПКТ было выявлено в 20% случаев (у 21,2% женщин и 18,7% мужчин). Таким образом, при СД1 остеопороз и остеопения выявляются в 3,2 раза чаще, чем у лиц контрольной группы аналогичного возраста.
Оказалось, что нет достоверной зависимости между возрастом больных и степенью снижения МПКТ как у мужчин, так и у женщин (г = 0,3; р > 0,05). В группе больных мужчин не выявлено также связи между снижением МПКТ и длительностью заболевания (г = 0,2; р > 0,05). В то же время у больных женщин такая связь имеется: чем длительнее заболевание, тем значительнее снижается МПКТ (г = 0,5; р < 0,05).
Для анализа показателей кальций-фосфорного обмена (табл. 2) больные СД были разделены на 3 группы в зависимости от МПКТ: с нормальной МПКТ, остеопенией и остеопорозом.
В группе больных с нормальной МПКТ показатели кальция, фосфора, ЩФ и ОК в крови у мужчин и женщин практически не отличались от показателей контрольной группы. В то же время экскреция ОПР и кальция по отношению к экскреции Кр у женщин в отличие от мужчин повышается достоверно, что свидетельствует об усилении резорбции у женщин еще при нормальной МПКТ.
Таблица 1
МПКТ у больных СД
Группа обследованных | Пол | Число обследованных | Частота изменений МПКТ, % | |||
нормальная МПКТ | остеопения | остеопороз | пониженная МПКТ | |||
Контрольная | М. | 32 | 81,3 | 18,7 | — | 18,7 |
Ж. | 33 | 78,8 | 21,2 | — | 21,2 | |
Всего… | 65 | 80,0 | 20,0 | — | 20,0 | |
Больные СД1 | М. | 44 | 36,4 | 40,9 | 22,7 | 63,6 |
Ж. | 51 | 35,3 | 43,1 | 21,6 | 64,7 | |
Всего… | 95 | 35,8 | 42,1 | 22,1 | 64,2 | |
Примечание, р — достоверность различий с контрольной группой.
Согласно полученным данным, при СД1 (на фоне остеопении и остеопороза) уменьшается содержание кальция в крови и увеличивается его экскреция по отношению к экскреции Кр, т.
Таким образом, при СД1 одновременно происходит угнетение процессов костеобразования и усиление резорбции костной ткани.
В этих процессах существенную роль играет ПТГ, значительное и достоверное увеличение уровня которого выявлено в наших исследованиях. Его динамика отражает повышенный уровень метаболизма костной ткани при СД1, реализацию его костно-резорбирующего действия. Оно опосредовано через остеобласты, которые отвечают как за стимуляцию костного формирования, так и за активацию остеокластов.
Анализ денситометрических и биохимических показателей больных СД1 в зависимости от степени его компенсации показал наличие прямой корреляции между степенью компенсации СД и снижением МПКТ (г = 0,5; р< 0,05).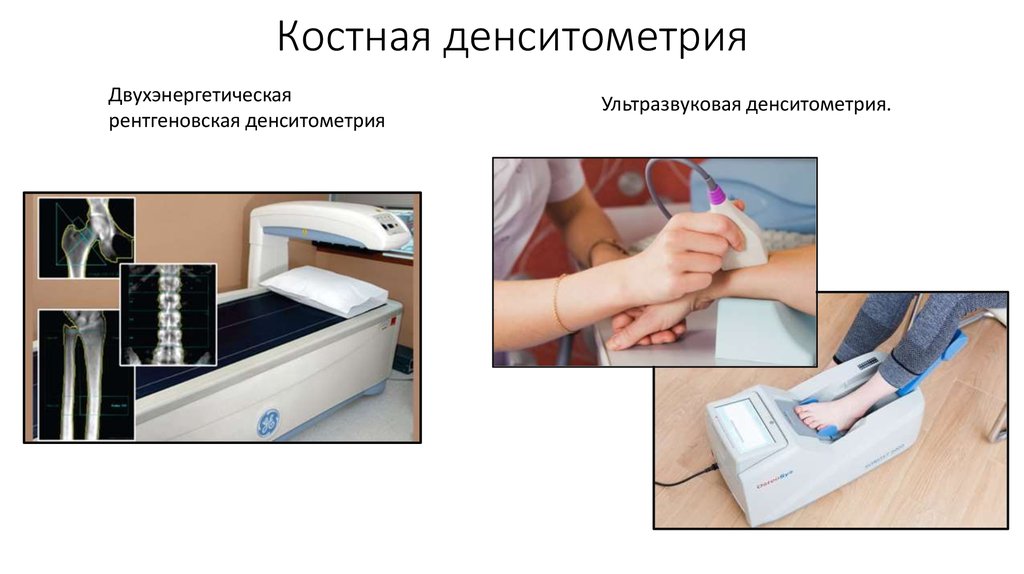 Снижение активности остеобластов, ведущее к дефициту костеобразования, подтверждается уменьшением содержания ОК — наиболее специфичного маркера костеобразования [1]. Выявленные нами снижение содержания кальция в крови, увеличение его выделения с мочой, усиленная экскреция ОПР по отношению к экскреции Кр свидетельствуют об усилении костной резорбции.
Снижение активности остеобластов, ведущее к дефициту костеобразования, подтверждается уменьшением содержания ОК — наиболее специфичного маркера костеобразования [1]. Выявленные нами снижение содержания кальция в крови, увеличение его выделения с мочой, усиленная экскреция ОПР по отношению к экскреции Кр свидетельствуют об усилении костной резорбции.
Выводы
- Снижение МПКТ является осложнением СД1 и встречается достоверно чаще, чем в общей популяции, зависит от степени компенсации заболевания, а у женщин — и от его длительности.
- В основе нарушений МПКТ лежит разобщение процессов костного ремоделирования — преобладание процессов резорбции костной ткани за счет ее усиления над процессами костного формирования вследствие угнетения последних.
Проблема остеопороза в связи с его широкой распространенностью, тяжестью осложнений, часто приводящих к инвалидизации и даже смерти больных, высокой стоимостью лечения и профилактики в 90-е годы XX века вышла по значимости на 4-е место после сердечно-сосудистых, онкологических заболеваний и сахарного диабета (СД) [3, 4, 7, 8, 11-13].

В современной классификации остеопороза [5, 9] к группе вторичных остеопорозов, связанных с заболеваниями эндокринной системы, относится и остеопороз при СД типа 1 (СД1). Однако исследований, посвященных этому вопросу, явно недостаточно [5, 6].
Целью исследования явились оценка состояния минеральной плотности костной ткани (МПКТ), показателей ее метаболизма и кальций-фосфорного обмена у больных СД1, повышение эффективности диагностики остеопороза при этом заболевании.
Материалы и методы
Обследовано 95 больных СД1: 44 мужчины в возрасте 34,2 ± 2,1 года с длительностью заболевания 9,8 ± 1,6 года и 51 женщина в возрасте 35,8 ± 1,9 года с длительностью заболевания
- ± 1,8 года, а также 65 человек контрольной группы: 32 мужчины и 33 женщины в возрасте
- ± 0,9 года.
У обследованных больных были выявлены следующие осложнения СД: у 89 (93,7%) — диабетический гепатоз, у 88 (92,6%) — ангиопатия и нейропатия нижних конечностей, из них у 12 (12,6%) с трофическими нарушениями кожи (больных с синдромом диабетической стопы в исследуемую группу не включали, у 83 (87,4%) — простая ретинопатия, у 11 (11,6%) — пролиферативная ретинопатия.

Методом ультразвуковой денситометрии оценивали Stiffness — аналог МПКТ («Achilles+», Lunar, США). Основными показателями, характеризующими МПКТ, поданным денситометрического исследования, являются индексы Т и Z. Результаты выражают в единицах стандартного отклонения (SD) к соответствующей норме.
Согласно рекомендациям ВОЗ, диагностику остеопороза проводили на основании индекса Т: за норму принимали отклонения менее чем на 1 SD, т. е. выше чем -1SD; значения меньше -1SD, но больше -2,5SD оценивали как остеопению, значения индекса Т меньше -2,5SD — как остеопороз.
Показатели кальций-фосфорного обмена оценивали по концентрации общего кальция и неорганического фосфора в сыворотке крови, а также по уровню их экскреции с мочой натощак по отношению к экскреции креатинина (Кр).
 О состоянии формирования костной ткани судили по активности общей щелочной фосфатазы (ЩФ) и содержанию остеокальцина (ОК) в сыворотке крови, об уровне резорбции костной ткани — по содержанию оксипролина (ОПР) в моче по отношению к экскреции Кр.
О состоянии формирования костной ткани судили по активности общей щелочной фосфатазы (ЩФ) и содержанию остеокальцина (ОК) в сыворотке крови, об уровне резорбции костной ткани — по содержанию оксипролина (ОПР) в моче по отношению к экскреции Кр.Исследовали также уровни паратгормона (ПТГ), тестостерона, лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов.
Полученные данные обрабатывали статистически с использованием /-критерия Стьюдента.
Результаты и их обсуждение
Известно, что дефицит половых гормонов существенно влияет на МПКТ и ее метаболизм [2, 10], поэтому у части больных СД и лиц контрольной группы определяли уровень ФСГ и ЛГ, а у мужчин — и тестостерона. Отсутствие достоверных различий уровня ЛГ, ФСГ у женщин и ЛГ, ФСГ, тестостерона у мужчин, больных СД1 и лиц контрольной группы этого же возраста позволяет, по нашему мнению, исключить дополнительное влияние этой группы гормонов на МПКТ.
Анализ данных денситометрических исследований показал, что при СД1 снижение МПКТ (табл.
 1) было обнаружено у 64,2% больных, причем у мужчин и женщин практически с одинаковой частотой (63,6 и 64,7%), в контрольной группе снижение МПКТ было выявлено в 20% случаев (у 21,2% женщин и 18,7% мужчин). Таким образом, при СД1 остеопороз и остеопения выявляются в 3,2 раза чаще, чем у лиц контрольной группы аналогичного возраста.
1) было обнаружено у 64,2% больных, причем у мужчин и женщин практически с одинаковой частотой (63,6 и 64,7%), в контрольной группе снижение МПКТ было выявлено в 20% случаев (у 21,2% женщин и 18,7% мужчин). Таким образом, при СД1 остеопороз и остеопения выявляются в 3,2 раза чаще, чем у лиц контрольной группы аналогичного возраста.Оказалось, что нет достоверной зависимости между возрастом больных и степенью снижения МПКТ как у мужчин, так и у женщин (г = 0,3; р > 0,05). В группе больных мужчин не выявлено также связи между снижением МПКТ и длительностью заболевания (г = 0,2; р > 0,05). В то же время у больных женщин такая связь имеется: чем длительнее заболевание, тем значительнее снижается МПКТ (г = 0,5; р < 0,05).
Для анализа показателей кальций-фосфорного обмена (табл. 2) больные СД были разделены на 3 группы в зависимости от МПКТ: с нормальной МПКТ, остеопенией и остеопорозом.
В группе больных с нормальной МПКТ показатели кальция, фосфора, ЩФ и ОК в крови у мужчин и женщин практически не отличались от показателей контрольной группы.
 В то же время экскреция ОПР и кальция по отношению к экскреции Кр у женщин в отличие от мужчин повышается достоверно, что свидетельствует об усилении резорбции у женщин еще при нормальной МПКТ.
В то же время экскреция ОПР и кальция по отношению к экскреции Кр у женщин в отличие от мужчин повышается достоверно, что свидетельствует об усилении резорбции у женщин еще при нормальной МПКТ.Таблица 1
МПКТ у больных СД
Группа обследованных
Пол
Число обследованных
Частота изменений МПКТ, %
нормальная МПКТ
остеопения
остеопороз
пониженная МПКТ
Контрольная
М.
32
81,3
18,7
—
18,7
Ж.
33
78,8
21,2
—
21,2
Всего…
65
80,0
20,0
—
20,0
Больные СД1
М.

44
36,4
40,9
22,7
63,6
Ж.
51
35,3
43,1
21,6
64,7
Всего…
95
35,8
42,1
22,1
64,2
Примечание, р — достоверность различий с контрольной группой.
Согласно полученным данным, при СД1 (на фоне остеопении и остеопороза) уменьшается содержание кальция в крови и увеличивается его экскреция по отношению к экскреции Кр, т. е. происходит потеря кальция. Содержание же фосфора в крови увеличивается при неизменной его экскреции. Выявлено уменьшение содержания ОК в крови. Это означает, что происходит угнетение процессов костеобразования. Одновременно значительно и достоверно увеличивались и процессы резорбции костной ткани, о чем свидетельствовало повышение экскреции ОПР и кальция по отношению к экскреции Кр.
 Процесс резорбции костной ткани, по нашим данным, был более выражен у женщин.
Процесс резорбции костной ткани, по нашим данным, был более выражен у женщин.Таким образом, при СД1 одновременно происходит угнетение процессов костеобразования и усиление резорбции костной ткани.
В этих процессах существенную роль играет ПТГ, значительное и достоверное увеличение уровня которого выявлено в наших исследованиях. Его динамика отражает повышенный уровень метаболизма костной ткани при СД1, реализацию его костно-резорбирующего действия. Оно опосредовано через остеобласты, которые отвечают как за стимуляцию костного формирования, так и за активацию остеокластов.
Анализ денситометрических и биохимических показателей больных СД1 в зависимости от степени его компенсации показал наличие прямой корреляции между степенью компенсации СД и снижением МПКТ (г = 0,5; р< 0,05). Снижение активности остеобластов, ведущее к дефициту костеобразования, подтверждается уменьшением содержания ОК — наиболее специфичного маркера костеобразования [1]. Выявленные нами снижение содержания кальция в крови, увеличение его выделения с мочой, усиленная экскреция ОПР по отношению к экскреции Кр свидетельствуют об усилении костной резорбции.

Выводы
- Снижение МПКТ является осложнением СД1 и встречается достоверно чаще, чем в общей популяции, зависит от степени компенсации заболевания, а у женщин — и от его длительности.
- В основе нарушений МПКТ лежит разобщение процессов костного ремоделирования — преобладание процессов резорбции костной ткани за счет ее усиления над процессами костного формирования вследствие угнетения последних.
1. Аметов А. С., Чечурин Р. Е., Рубин М. П. // Тезисы лекций и докл. третьего Российского симпозиума по остеопорозу. — СПб, 2000. — С. 102.
2. Вакс В. В. // Тезисы лекций и докл. третьего Российского симпозиума по остеопорозу. — СПб, 2000. — С. 99-101.
3. Дедов И. И., Марова Е. И., Рожинская Л. Я. Остеопороз: патогенез, диагностика, принципы профилактики и лечения: Метод, пособие для врачей. — М., 1999.
4. Демидова И. Ю., Глинкина И. В., Перфилова А. Н. // Доказательная медицина. — 2000. — № 5. — С. 211-215.
5. Марова Е. И. // Остеопороз и остеопатии. — 1998. — № 1.С. 8-12.
— 1998. — № 1.С. 8-12.
6. Марова Е. И. // Тезисы лекций и докл. третьего Российского симпозиума по остеопорозу. — СПб, 2000. — С. 46-47.
7. Насонов Е. Л. // Рус. мед. журн. — 1999. — № 8. — С. 377-384.
8. Насонова В. А. // Тезисы лекций и докл. третьего Российского симпозиума по остеопорозу. — СПб, 2000. — С. 34-35.
9. Родионова С. С., Рожинская Л. Я. Остеопороз: патогенез, диагностика, лечение: Практическое пособие для врачей.М., 1997.
10. Сметник В. П. // Остеопороз и остеопатии. — 1998. — № 2. — С. 21-24.
11. Спиртус Т. В., Михайлов Е. Е., Беневолнская Л. И. // Клин, ревматол. — 1997. — № 3. — С. 31-36.
12. Chishlles S. R., Shireman Т., Wallace R. // Bone. — 1994. — Vol. 15. — P. 377-386.
13. Cooper C. /I Br. J. Rheumatol. — 1990. — Vol. 30, N 2. — P. 135-137.
QСT и остеопороз
Остеопороз, наиболее распространенное из всех метаболических костных нарушений, определяется ВОЗ как «заболевание скелета, характеризующееся снижением массы кости и микроархитектурными изменениями костной ткани, с последующим увеличением хрупкости костей и восприимчивости к разрушению».
WHO “А skeletal disease, characterized by low bone mass and micro-architectural deterioration of bone tissue, with a consequent increase in bone fragility and susceptibility to fracture” -
Патогенез остеопороза не имеет единого механизма, поскольку снижение плотности костной ткани и нарушение структуры кости происходит по-разному, в зависимости от преобладающего фактора риска болезни, однако определяющим является десинхронизация костеобразования и костеразрушения, со смещением равновесия в сторону катаболизма.
Остеопороз долгое время протекает латентно. Пациент, не подозревая о его наличии, получает переломы при совершении привычных действии или минимальной травме. Единичный перелом позвонка может протекать бессимптомно, а болевой синдром в спине постепенно приходит. От компрессии страдают передние отделы тел позвонков, вызывая их клиновидную деформацию, приводя к изменению осанки и уменьшению роста. Такие пациенты не испытывают боли, но у них постепенно развивается дорсальный кифоз и усиливается шейный лордоз, формируя «круглую спину». Болевой синдром обычно выражен, когда страдают позвонки в нижнегрудном сегменте, с усилением при резких поворотах тела, кашле, чихании, поднятии тяжести и др.
Диагностическая визуализация остеопороза имеет два основных задачи: определить наличие остеопороза, и количественная оценка костной массы. Визуальная диагностика остеопороза при традиционной рентгенографии достоверно возможна при снижении плотности костной ткани 30% и более. Существует большое количество радиологических и ультразвуковых технологий для измерения минеральной плотности костной ткани (SXA, SPA, DPA, QCT, RA и т.д.). При одних проводятся исследование позвоночника, при других – периферические костей. Среди всего разнообразия денситометрических методов для остеопороза согласно рекомендаций Американской коллегии акушеров и гинекологов «золотым стандартом» является двухэнергетическая рентгеновская абсорбциометрия, которая позволяет исследовать осевой скелет, обладает приемлемой чувствительностью, достаточной точностью и относительно не высокой стоимостью.
Болевой синдром обычно выражен, когда страдают позвонки в нижнегрудном сегменте, с усилением при резких поворотах тела, кашле, чихании, поднятии тяжести и др.
Диагностическая визуализация остеопороза имеет два основных задачи: определить наличие остеопороза, и количественная оценка костной массы. Визуальная диагностика остеопороза при традиционной рентгенографии достоверно возможна при снижении плотности костной ткани 30% и более. Существует большое количество радиологических и ультразвуковых технологий для измерения минеральной плотности костной ткани (SXA, SPA, DPA, QCT, RA и т.д.). При одних проводятся исследование позвоночника, при других – периферические костей. Среди всего разнообразия денситометрических методов для остеопороза согласно рекомендаций Американской коллегии акушеров и гинекологов «золотым стандартом» является двухэнергетическая рентгеновская абсорбциометрия, которая позволяет исследовать осевой скелет, обладает приемлемой чувствительностью, достаточной точностью и относительно не высокой стоимостью. Но исходя из результатов последних исследований, даже DXA метод может давать 20-30% ошибку измерения.
Quantitative computed tomography (QCT)
Количественная компьютерная томография (ККТ) измеряет минеральную плотность костной ткани (МПКТ) в поясничном отделе позвоночника с помощью стандартного МСКТ томографа со специальной калибровочным эталонным фантомом, который сканируется вместе с пациентом. Кроме того количественная КТ дает полное представление о форме и размерах тел позвонков, микро и макроструктуре костной ткани, состоянии костных трабекул, замыкательных пластинок, точное соотношении костной и жировой ткани. На точность результатов этого метода исследования, в отличие от других методов не оказывают анатомические особенности: наличие сколиотической деформации, компрессионные переломы тел позвонков, склеротические изменения окружающих мягких тканей, а также наличие желтого (жирового) костного мозга.
Усиление вертикальной исчерченности тел позвонков за счет гиперминерализации оставшихся трабекул, обнаруживаемое при проведении количественной компьютерной томографии, сходно с таковым при гемангиоме , однако последующий анализ за рабочей станции с построением трехмерных изображений позволяет провести дифференциальную диагностику.
Но исходя из результатов последних исследований, даже DXA метод может давать 20-30% ошибку измерения.
Quantitative computed tomography (QCT)
Количественная компьютерная томография (ККТ) измеряет минеральную плотность костной ткани (МПКТ) в поясничном отделе позвоночника с помощью стандартного МСКТ томографа со специальной калибровочным эталонным фантомом, который сканируется вместе с пациентом. Кроме того количественная КТ дает полное представление о форме и размерах тел позвонков, микро и макроструктуре костной ткани, состоянии костных трабекул, замыкательных пластинок, точное соотношении костной и жировой ткани. На точность результатов этого метода исследования, в отличие от других методов не оказывают анатомические особенности: наличие сколиотической деформации, компрессионные переломы тел позвонков, склеротические изменения окружающих мягких тканей, а также наличие желтого (жирового) костного мозга.
Усиление вертикальной исчерченности тел позвонков за счет гиперминерализации оставшихся трабекул, обнаруживаемое при проведении количественной компьютерной томографии, сходно с таковым при гемангиоме , однако последующий анализ за рабочей станции с построением трехмерных изображений позволяет провести дифференциальную диагностику.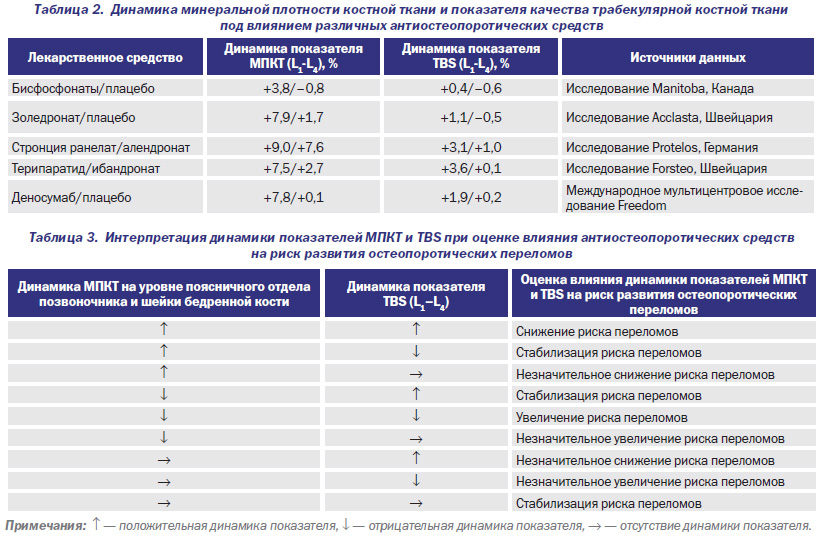 Порядок проведения. После выполнения обзорного сканирования проводится позиционирование срезов по центру каждого позвонка и МСКТ сканирование трех заранее выбранных позвонков с минимальными изменениями формы и размеров. При анализе выбирается область интереса в губчатой ткани передней части тела позвонков (из 3 заранее выбранных ThXI, ThXII, LI, LII, LIII) диаметром 10мм с тщательным позиционированием для исключения кортикального слоя и очевидных патологических изменений и для каждого поясничного позвонка (из 3 заранее выбранных ThXI, ThXII, LI, LII, LIII) плотность сравнивается автоматически с фантомом и в результате вычисляется значение минеральной плотности костной ткани в г\см3 по гидроксиапатиту (К2НРО4-эквивалент).
ККТ была изобретена в Калифорнийском университете Сан-Франциско в 1980х годах Douglas Boyd и Harry Genant. Сегодня ККТ использусь в сотнях медицинских центров изображений по всему миру, дает возможность получать трехмерное изображение и производить прямое определение плотности, а также выполнять пространственное разделение от трабекулярной и кортикальной кости.
Порядок проведения. После выполнения обзорного сканирования проводится позиционирование срезов по центру каждого позвонка и МСКТ сканирование трех заранее выбранных позвонков с минимальными изменениями формы и размеров. При анализе выбирается область интереса в губчатой ткани передней части тела позвонков (из 3 заранее выбранных ThXI, ThXII, LI, LII, LIII) диаметром 10мм с тщательным позиционированием для исключения кортикального слоя и очевидных патологических изменений и для каждого поясничного позвонка (из 3 заранее выбранных ThXI, ThXII, LI, LII, LIII) плотность сравнивается автоматически с фантомом и в результате вычисляется значение минеральной плотности костной ткани в г\см3 по гидроксиапатиту (К2НРО4-эквивалент).
ККТ была изобретена в Калифорнийском университете Сан-Франциско в 1980х годах Douglas Boyd и Harry Genant. Сегодня ККТ использусь в сотнях медицинских центров изображений по всему миру, дает возможность получать трехмерное изображение и производить прямое определение плотности, а также выполнять пространственное разделение от трабекулярной и кортикальной кости. В позвоночнике, ККТ используется для измерения минеральной плотности костей только губчатой внутренней кости отдельно от плотной кортикальной кости, которая формирует наружные стены позвонков. Трабекулярная кость имеет гораздо более высокую метаболическую активность, чем кортикальная кость и на ее состояние влияют возраст, болезни и проводимая терапия тяжелых заболевания. Это означает, что ККТ позвоночника имеет преимущество по сравнению с другими тестами плотности костной ткани из-за высокой чувствительности, и изменения в минеральной плотности костной ткани на фоне лечения остеопороза могут быть выявлены значительно раньше чем другими методами.
Противопоказания для использования
ККТ костная денситометрия не должны использоваться для пациентов после лучевой терапии, рентгенконтрастных исследований в предшествуюшие дни, беременным женщинам.
ККТ протоколы сканирования с низкой дозой облучения, сопоставимые с маммографией и существенно меньше, чем при стандартом МСКТ исследовании позвоночника.
В позвоночнике, ККТ используется для измерения минеральной плотности костей только губчатой внутренней кости отдельно от плотной кортикальной кости, которая формирует наружные стены позвонков. Трабекулярная кость имеет гораздо более высокую метаболическую активность, чем кортикальная кость и на ее состояние влияют возраст, болезни и проводимая терапия тяжелых заболевания. Это означает, что ККТ позвоночника имеет преимущество по сравнению с другими тестами плотности костной ткани из-за высокой чувствительности, и изменения в минеральной плотности костной ткани на фоне лечения остеопороза могут быть выявлены значительно раньше чем другими методами.
Противопоказания для использования
ККТ костная денситометрия не должны использоваться для пациентов после лучевой терапии, рентгенконтрастных исследований в предшествуюшие дни, беременным женщинам.
ККТ протоколы сканирования с низкой дозой облучения, сопоставимые с маммографией и существенно меньше, чем при стандартом МСКТ исследовании позвоночника. ККТ позволяет проводить измерения минеральной плотности костной ткани у пациентов со сколиозом, которые обычно не могут быть измерены с помощью DXA. Кроме того, ККТ можно избежать ошибок, которые могут возникнуть у пациентов с выраженными дегенеративно-дистрофическими изменениями в позвоночники, а также у пациентов с ИМТ >35 (ожирением), массивными кальцинированными атеросклеротическими бляшками в стенках брюшной аорты.
Измеряются две величины: площадь проекции исследуемого участка (Аrеа, см2), содержание костного минерала (Bone Mineral Content – BMC, г). Вычисляется клинически значимый параметр – минеральная плотность кости Bone Mineral Density, (BMD). ВМD=ВМС/Аrеа; МПК г/см2.
Минеральной плотности костной ткани вычисляется и сравнивается с возрастом и полом из контрольной группы. При ККТ вместо использования Т-баллов определяется плотность костной ткани в мг / см3. Значения 80 мг / см3соответствует остеопении; и значение выше 120 мг / см3 считается нормальным.
ККТ позволяет проводить измерения минеральной плотности костной ткани у пациентов со сколиозом, которые обычно не могут быть измерены с помощью DXA. Кроме того, ККТ можно избежать ошибок, которые могут возникнуть у пациентов с выраженными дегенеративно-дистрофическими изменениями в позвоночники, а также у пациентов с ИМТ >35 (ожирением), массивными кальцинированными атеросклеротическими бляшками в стенках брюшной аорты.
Измеряются две величины: площадь проекции исследуемого участка (Аrеа, см2), содержание костного минерала (Bone Mineral Content – BMC, г). Вычисляется клинически значимый параметр – минеральная плотность кости Bone Mineral Density, (BMD). ВМD=ВМС/Аrеа; МПК г/см2.
Минеральной плотности костной ткани вычисляется и сравнивается с возрастом и полом из контрольной группы. При ККТ вместо использования Т-баллов определяется плотность костной ткани в мг / см3. Значения 80 мг / см3соответствует остеопении; и значение выше 120 мг / см3 считается нормальным. Фантом, содержавший К2НРО4 в различных концентрациях, помещается во время исследования под пациентом.
Трехмерный характер исследований позволяет оценить объемную минеральную плотность в мг/см3 трабекулярного вещества. Метод позволяет измерить плотность кости, общее содержание минералов, получить информацию об анатомии позвоночника, дифференцированно оценить состояние компактного слоя, губчатого вещества. Различие в объеме мягких тканей не влияет на точность измерения МПК.
ККТ используется главным образом для измерения плотности трабекулярной костной ткани позвоночника, и его диагностическая ценность в случае остеопороза даже выше, чем ДРА. Переломы редко встречаются при значениях МПК выше 110 мг/см3и очень часто – при МПК
Фантом, содержавший К2НРО4 в различных концентрациях, помещается во время исследования под пациентом.
Трехмерный характер исследований позволяет оценить объемную минеральную плотность в мг/см3 трабекулярного вещества. Метод позволяет измерить плотность кости, общее содержание минералов, получить информацию об анатомии позвоночника, дифференцированно оценить состояние компактного слоя, губчатого вещества. Различие в объеме мягких тканей не влияет на точность измерения МПК.
ККТ используется главным образом для измерения плотности трабекулярной костной ткани позвоночника, и его диагностическая ценность в случае остеопороза даже выше, чем ДРА. Переломы редко встречаются при значениях МПК выше 110 мг/см3и очень часто – при МПК
Плотность костей и риск развития рака Последующее исследование женщин, участвовавших в испытании вмешательства при переломах (BFIT)
Плотность костей стала потенциально важным предиктором риска некоторых видов рака, на которые влияют гормоны, таких как рак молочной железы и рак эндометрия. В 1992 году более 25 000 женщин в постменопаузе вызвались добровольцами для FIT, клинического испытания, чтобы определить, может ли препарат алендронат снизить частоту переломов при остеопорозе. Исследование BFIT представляет собой ретроспективное когортное исследование, в котором используются данные клинического исследования FIT для оценки того, как минеральная плотность кости тазобедренного сустава связана с последующим риском развития рака; включая вложенное когортное исследование циркулирующих половых стероидных гормонов в связи с риском рака молочной железы, эндометрия, яичников и колоректального рака.
В 1992 году более 25 000 женщин в постменопаузе вызвались добровольцами для FIT, клинического испытания, чтобы определить, может ли препарат алендронат снизить частоту переломов при остеопорозе. Исследование BFIT представляет собой ретроспективное когортное исследование, в котором используются данные клинического исследования FIT для оценки того, как минеральная плотность кости тазобедренного сустава связана с последующим риском развития рака; включая вложенное когортное исследование циркулирующих половых стероидных гормонов в связи с риском рака молочной железы, эндометрия, яичников и колоректального рака.
Исследователи NCI и FIT связались с добровольцами FIT, чтобы выявить случаи рака и оценить, предсказывает ли информация о факторах риска, собранная в 1992 году, такая как измеренная минеральная плотность костей, факторы образа жизни и определенные факторы роста, последующий риск рака. Сбор дополнительной информации о факторах риска во время этого наблюдения, включая обновленные факторы образа жизни и образец буккальных клеток для генетического анализа, позволяет исследователям дополнительно изучить сложные взаимосвязи между костной массой и другими факторами риска рака молочной железы, эндометрия и других видов рака. В настоящее время предпринимаются попытки понять связь между андрогенами и метаболитами андрогенов, а также метаболитами, связанными с прогестероном, и риском рака молочной железы, а также взаимосвязь между костной массой и эндогенными гормонами и риском рака молочной железы, эндометрия и других видов рака.
В настоящее время предпринимаются попытки понять связь между андрогенами и метаболитами андрогенов, а также метаболитами, связанными с прогестероном, и риском рака молочной железы, а также взаимосвязь между костной массой и эндогенными гормонами и риском рака молочной железы, эндометрия и других видов рака.
Метаболиты эстрогена в сыворотке и риск рака в исследовании BFIT
Несмотря на то, что циркулирующие эстрогены оценивались в предыдущих эпидемиологических исследованиях рака, остаются многочисленные вопросы относительно роли метаболитов эстрогена в развитии рака, связанного с гормонами. Исследователи провели групповое исследование в рамках BFIT, чтобы изучить циркулирующие эстрогены и метаболиты эстрогенов в отношении четырех конкретных конечных точек рака. Женщины, прошедшие скрининг для участия в испытании, заполнили анкету о факторах риска, сдали исходный образец крови и прошли сканирование минеральной плотности костей. В рамках исследования BFIT за этими женщинами наблюдали (в среднем 10,3 года) для определения случаев возникновения рака и переломов в период с 2001 по 2004 год./59/59.jpg)
Комплексный профиль эндогенных эстрогенов, включая 15 эстрогенов и метаболитов эстрогенов, был измерен в преддиагностической сыворотке с использованием анализа ЖХ-МС/МС, разработанного в Лаборатории характеристики белков в Национальном онкологическом центре им. Фредерика. Эти показатели были изучены в отношении рака молочной железы (n ~ 420), эндометрия (n ~ 62), рака яичников (n ~ 65) и колоректального рака (n ~ 178). Было обнаружено, что повышенный уровень циркулирующего эстрадиола связан с повышенным риском рака молочной железы. Кроме того, повышенные уровни метаболитов в путях 2- и 4-гидроксилирования исходных эстрогенов были обратно пропорциональны риску. Более высокое соотношение пути 2/16-гидроксилирования также было связано со сниженным риском. Повышенные уровни эстрадиола также были связаны с увеличением риска рака эндометрия без значимой связи с отдельными метаболитами. Напротив, ни исходные эстрогены, ни метаболиты не были связаны с рисками рака яичников или колоректального рака.
Адипоцитокины и риск рака эндометрия в исследовании BFIT
Ожирение является общепризнанным фактором риска рака эндометрия и может независимо влиять на риск рака эндометрия, даже после корректировки на половые стероиды. Жировая ткань продуцирует несколько адипоцитокинов, в том числе лептин и адипонектин, и, хотя несколько исследований оценивали эти маркеры в связи с риском рака эндометрия, в большинстве исследований использовались постдиагностические образцы крови. Исследователи в настоящее время проводят вложенное исследование случай-контроль для изучения циркулирующих преддиагностических уровней адипонектина, высокомолекулярного адипонектина, лептина и С-пептида в связи с риском рака эндометрия среди подгруппы женщин в постменопаузе (~ 60 случаев / 120 контролей). ) в последующем исследовании BFIT. В рамках этого исследования исследователи также смогут оценить полную панель циркулирующих эстрогенов и метаболитов эстрогенов, а также изучить взаимосвязь с показателями ожирения, такими как индекс массы тела и соотношение талии и бедер.
Просмотр публикаций исследования BFIT.
За дополнительной информацией обращайтесь к Гретхен Гирак.
Отделение интегративной эпидемиологии опухолей – Области исследований
Тест на плотность костей
Что такое детский тест на плотность костей?
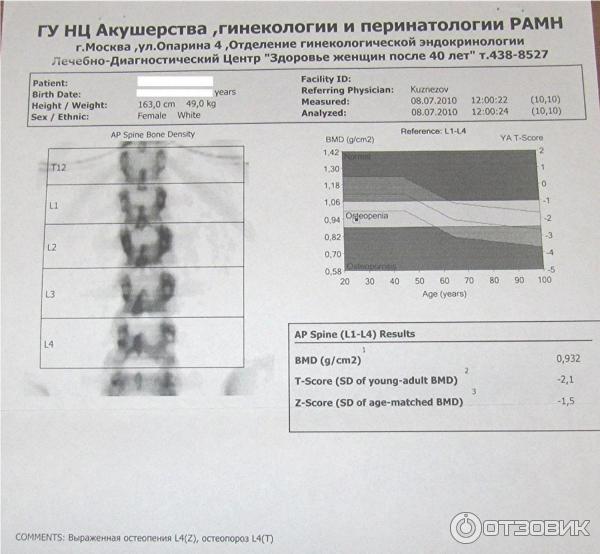
Педиатрический тест плотности костей измеряет уровни кальция и других минералов в определенных костях тела вашего ребенка. Полное название теста — денситометрия костей с помощью двухэнергетической рентгеновской абсорбциометрии (DEXA). Иногда его просто называют сканированием костей или денситометрией костей.
Наша команда адаптирует тест плотности костей вашего ребенка к его возрасту и состоянию. Мы используем специальные сканеры и рентген, чтобы сделать снимки позвоночника и всего тела вашего ребенка. Результаты DEXA дают нашей команде подробную информацию о прочности костей вашего ребенка. Эта информация помогает нам понять состояние здоровья вашего ребенка или то, как лекарства влияют на кости вашего ребенка.
Каковы преимущества педиатрического теста плотности костей?
Сканирование костей может помочь нам предсказать риск будущих переломов костей или рассказать нам, как работает лечение. Детям может потребоваться проверка плотности костной ткани, если у них есть такие состояния, как:
- Состояния, при которых дети не могут носить вес, такие как расщелина позвоночника, церебральный паралич или мышечная дистрофия
- Расстройства пищевого поведения, такие как нервная анорексия и булимия
- Гипофосфатазия (ГФП), нарушение обмена веществ, которое может размягчить или ослабить кости
- Болезнь почек (почечная)
- Алиментарные и генетические формы остеомаляции (рахита)
- Несовершенный остеогенез, генетическое заболевание, которое может повлиять на формирование кости
- Остеопетроз (болезнь мраморной кости), состояние, при котором кости становятся плотными, легко ломающимися
- Остеопороз (хрупкость костей) или остеопения (слабость костей)
- Проблемы с усвоением питательных веществ
- Ревматологические состояния
Каковы побочные эффекты педиатрического теста плотности костей?
Тесты плотности костей очень безопасны. У них нет никаких известных побочных эффектов.
У них нет никаких известных побочных эффектов.
Каковы риски педиатрического теста плотности костей?
Сканирование плотности костей является безопасным тестом с очень небольшим риском. Он использует гораздо меньше радиации, чем обычный рентген.
Чего ожидать от педиатрического теста плотности костей
Полное сканирование DEXA занимает около 30 минут. Вы должны сообщить своему ребенку, что ему нужно будет лежать очень неподвижно, чтобы врачи могли сделать хорошие снимки его костей.
Чего ожидать перед педиатрическим исследованием плотности костей
Есть несколько ограничений относительно того, когда и как мы проводим сканирование плотности костей. Поговорите с нами, прежде чем запланировать сканирование, если ваш ребенок или подросток:
- Имеет металлические стержни или другие имплантаты в теле: Мы не можем сканировать эти участки тела.
- Прошел рентген с барием в течение 10 дней: нам нужно перенести сканирование плотности костей на более поздний срок.

- Возможна беременность: мы проводим анализ мочи для исключения беременности у пациенток старше 10 лет или у которых началась менструация. Сканирование DEXA может быть небезопасным для плода.
Чего ожидать во время педиатрического теста плотности костей
Ваш ребенок лежит на спине на мягком рентгеновском столе. Мы подпираем их ноги, чтобы получить четкие снимки их позвоночника.
Им нужно лежать неподвижно, пока техник делает снимки. Одна машина движется над их телом, а другая движется под ними. Они могут слышать и разговаривать с техником во время теста. Техник может попросить их ненадолго задержать дыхание, чтобы получить наиболее четкие снимки.
Мы часто сканируем два типа костей, чтобы получить полное представление о здоровье костей вашего ребенка. Мы смотрим на губчатые кости в позвоночнике и бедре вашего ребенка, а также на компактную кость в предплечье вашего ребенка. Во время этого тестирования техник осторожно перемещает ногу или руку вашего ребенка в разные положения.
Чего ожидать после педиатрического теста плотности костей
После завершения обследования ваш ребенок может вернуться к своим обычным занятиям и диете.
Врачи сравнивают результаты вашего ребенка со средними показателями для обычных детей того же возраста, пола и телосложения. Этот анализ сообщает медицинской бригаде вашего ребенка, насколько хорошо растет ваш ребенок, насколько крепки его кости и насколько эффективно лечение.
Как подготовить ребенка к педиатрическому тесту плотности костей?
Сканирование DEXA не требует специальной подготовки. Ваш ребенок должен носить удобную одежду без какого-либо металла (например, молнии или кнопки). Они могут быть в своей собственной одежде во время теста, или техник может попросить их переодеться в халат.
Что разрешено есть и пить моему ребенку перед педиатрическим тестом плотности костей?
Большинство детей могут есть и пить перед тестом, как обычно.



 О состоянии формирования костной ткани судили по активности общей щелочной фосфатазы (ЩФ) и содержанию остеокальцина (ОК) в сыворотке крови, об уровне резорбции костной ткани — по содержанию оксипролина (ОПР) в моче по отношению к экскреции Кр.
О состоянии формирования костной ткани судили по активности общей щелочной фосфатазы (ЩФ) и содержанию остеокальцина (ОК) в сыворотке крови, об уровне резорбции костной ткани — по содержанию оксипролина (ОПР) в моче по отношению к экскреции Кр. 1) было обнаружено у 64,2% больных, причем у мужчин и женщин практически с одинаковой частотой (63,6 и 64,7%), в контрольной группе снижение МПКТ было выявлено в 20% случаев (у 21,2% женщин и 18,7% мужчин). Таким образом, при СД1 остеопороз и остеопения выявляются в 3,2 раза чаще, чем у лиц контрольной группы аналогичного возраста.
1) было обнаружено у 64,2% больных, причем у мужчин и женщин практически с одинаковой частотой (63,6 и 64,7%), в контрольной группе снижение МПКТ было выявлено в 20% случаев (у 21,2% женщин и 18,7% мужчин). Таким образом, при СД1 остеопороз и остеопения выявляются в 3,2 раза чаще, чем у лиц контрольной группы аналогичного возраста./!mir/10/10_3.jpg) В то же время экскреция ОПР и кальция по отношению к экскреции Кр у женщин в отличие от мужчин повышается достоверно, что свидетельствует об усилении резорбции у женщин еще при нормальной МПКТ.
В то же время экскреция ОПР и кальция по отношению к экскреции Кр у женщин в отличие от мужчин повышается достоверно, что свидетельствует об усилении резорбции у женщин еще при нормальной МПКТ.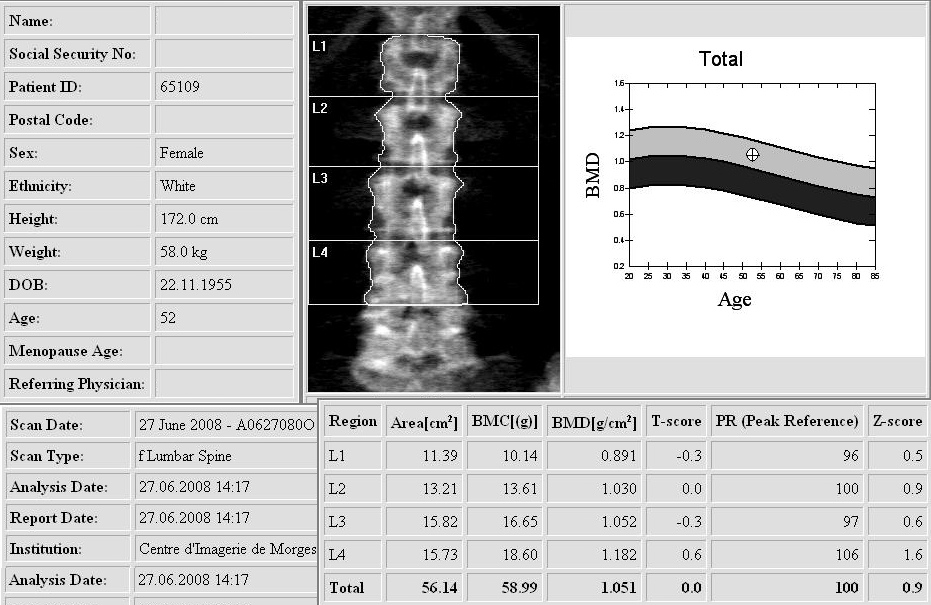
 Процесс резорбции костной ткани, по нашим данным, был более выражен у женщин.
Процесс резорбции костной ткани, по нашим данным, был более выражен у женщин.
