Ишемический инсульт сердца: 404 Страница не найдена
Из сердца — в мозг
О причинах и предупреждении кардиоэмболического инсульта рассказывает врач-аритмолог ФЦВМТ Наталья Федоренко
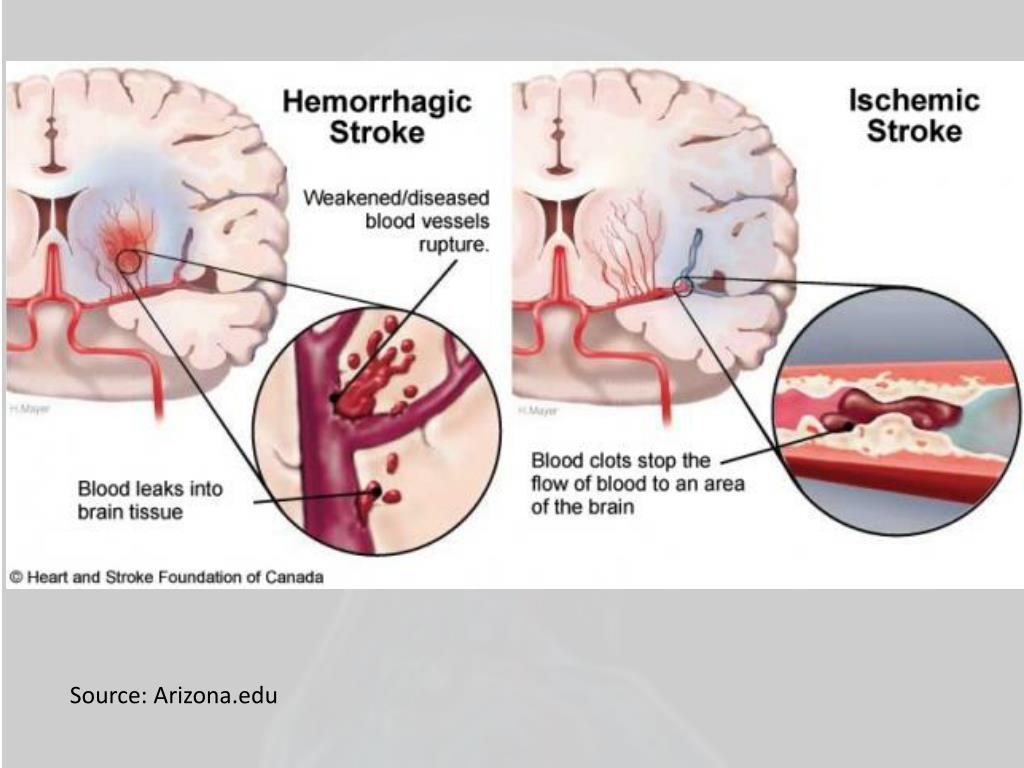
Разновидностью ишемического инсульта является кардиоэмболический инсульт, который развивается вследствие закупорки просвета сосудов головного мозга тромбами, которые образовываются внутри сердца и при наличии неблагоприятных факторов отрываются, далее с током крови проникают в головной мозг человека. В результате пораженные тканевые структуры мозга не получают необходимого кислорода и прочих полезных веществ для нормального функционирования, поэтому происходит отмирание клеток с последующим поражением ЦНС и развитием характерных симптомов.
Согласно наблюдениям, кардиоэмболический ишемический инсульт чаще возникает при наличии у пациента нарушения сердечного ритма по типу фибрилляции, трепетания предсердий или, как называли раньше, мерцательной аритмии.
Пациентам, перенесшим ишемический инсульт неясной этиологии, необходимо проходить желательно многодневный холтеровский мониторинг ЭКГ для выявления возможно бессимптомно протекающей пароксизмальной фибрилляции предсердий, выполнять ЭХОКС, а при показаниях и чрезпищеводное ЭХОКС.
Фибрилляция предсердий – это асинхронное возбуждение и последующее сокращение отдельных участков предсердий, возникающее в результате неправильной, дезорганизованной электрической активности миокарда предсердий, сопровождающееся нарушением ритмичности сокращения желудочков сердца.
Люди, страдающие фибрилляцией предсердий, подвержены повышенному риску возникновения инсульта. Тромбы образуются, как правило, в ушке левого предсердия вследствие замедления кровотока и нарушения сокращения в том месте. В случае обрыва тромба и его перемещения в головной мозг, происходит инсульт. Предотвращение образования тромбов, назначение антикоагулянтной терапии — наиболее важная часть лечения фибрилляции предсердий.
Для предотвращения образования тромбов врачи назначают разжижающие кровь лекарства. Это один из таких препаратов, как Варфарин, Прадакса, Эликвис, Ксарелто. Людям, принимающим разжижающие кровь препараты, необходимо регулярно сдавать анализы крови. При терапии Варфарином подбирают препарат в индивидуальных дозах, достаточных для увеличения протромбинового времени до значения, соответствующего показателю МНО 2,0-3,0 по шкале INR (International Normalized Ratio) для проверки того, насколько хорошо лекарство работает.
Применение любых форм аспирина неоправданно, так как этот препарат не может защитить больного и предотвратить образование тромбов при фибрилляции предсердий.
Адекватную антикоагулянтную терапию, при наличии фибрилляции предсердий обязательно необходимо применять для пациентов с митральными пороками, гипертонической болезнью, сахарным диабетом, перенесенным инфарктом миокарда и эпизодами ишемической атаки головного мозга, инсультов в анамнезе, при подтвержденной ишемической болезни сердца, а также в возрасте старше 65 лет.
Принятие решения о начале антикоагулянтного лечения по поводу фибрилляции предсердий базируется на балансе между относительным риском инсульта и риском осложнений в виде явного кровотечения, которое может случиться на фоне применения разжижающих кровь лекарств.
Исходя из проявлений аритмии, возраста, сопутствующей патологии в индивидуальном порядке составляется план лечения. Это может быть медикаментозное поддержание целевой частоты пульса, медикаментозная профилактика повторных эпизодов фибрилляции, проведение хирургических методов лечения, проводимых в ФЦВМТ г. Калининграда, таких как катетерная радиочастотная абляция устьев легочных вен (РЧА УЛВ) или, как говорят пациенты, «прижигания очага аритмии», торакоскопическая РЧА УЛВ с одновременным проведением лигирования(перевязки) ушка левого предсердия, как дополнительный фактор профилактики тромбоэмболических осложнений.
Калининграда, таких как катетерная радиочастотная абляция устьев легочных вен (РЧА УЛВ) или, как говорят пациенты, «прижигания очага аритмии», торакоскопическая РЧА УЛВ с одновременным проведением лигирования(перевязки) ушка левого предсердия, как дополнительный фактор профилактики тромбоэмболических осложнений.
Также пациентам с тяжелыми клапанными пороками, атеросклеротическими поражениями сосудов сердца, сопутствующей фибрилляции предсердий проводятся операции на открытом сердце в условиях искусственного кровообращения: коррекция клапанной патологии, при необходимости шунтирование сосудов + процедура Maze или «Лабиринт» с одновременным ушиванием ушка левого предсердия.
Операции, проводимые в нашем Центре, дают шанс пациентам навсегда избавиться от такого коварного нарушения ритма сердца, как фибрилляция предсердий и, соответственно, избежать ее грозного осложнения — кардиоэмболического инсульта.
Заболевания сердца и инсульт Текст научной статьи по специальности «Клиническая медицина»
СИБИРСКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ № 32009 (выпуск 2)
МАТЕРИАЛЫ СИМПОЗИУМА
«СЕРДЦЕ-МОЗГ» СЪЕЗДА КАРДИОЛОГОВ И КАРДИОХИРУРГОВ СФО, г. ТОМСК, 28 И 29 мая, 2009 г.
ТОМСК, 28 И 29 мая, 2009 г.
УДК 616.12- 06:616.831-005.1 В.М. Алифирова, О.М. Антухова
E-mail: [email protected]
ЗАБОЛЕВАНИЯ СЕРДЦА И ИНСУЛЬТ
ГОУ ВПО Сибирский государственный медицинский университет, г Томск
Интерес к изучению состояния сердца у больных, перенесших ишемический инсульт, имеет давнюю историю и сохраняется по настоящее время. Широкое распространение кардиологических методов диагностики в ангионеврологическую практику не только расширило представления о причинах ишемического инсульта, но и продемонстрировало тот факт, что целый ряд серьезных кардиальных заболеваний длительное время может протекать асимптом-но и манифестировать инсультом. В настоящее время имеется ряд публикаций, посвященных не только кардиальным аспектам патогенеза инсульта, но и цереброгенным нарушениям сердечной деятельности.
46
ишемией смертность вследствие кардиальных причин превышает смертность от самого инсульта. Течение постинсультного периода может осложняться развитием коронарных катастроф, включая тяжелый инфаркт миокарда, причем в ряде случаев без каких-либо клинических признаков коронарной нестабильности. Это обстоятельство ставит перед врачом необходимость изучения и своевременного выявления бессимптомных вариантов ИБС и факторов, влияющих на стабильность течения коронарного атеросклероза у больных ишемическим инсультом.
Течение постинсультного периода может осложняться развитием коронарных катастроф, включая тяжелый инфаркт миокарда, причем в ряде случаев без каких-либо клинических признаков коронарной нестабильности. Это обстоятельство ставит перед врачом необходимость изучения и своевременного выявления бессимптомных вариантов ИБС и факторов, влияющих на стабильность течения коронарного атеросклероза у больных ишемическим инсультом.
Заболевания сердца ассоциируются с риском возникновения инсульта в силу ряда обстоятельств. Во-первых, причиной ведущего заболевания сердца (ИБС) и инсульта является единый патологический процесс, во-вторых, заболевания сердца могут стать потенциальным источником эмболии в сосуды головного мозга.
Наиболее распространенными среди них являются ИБС, ревматизм и клапанные пороки сердца. Отмечена тесная функциональная взаимосвязь кровоснабжения сердца и мозга, при этом установлено, что миокард разных отделов сердца является рефлексогенной зоной для разных участков церебрального сосудистого бассейна: при тяжелой ишемии задних отделов сердца в патологический процесс вовлекается система сонных артерий, передняя стенка левого желудочка является рефлексогенной зоной мозгового ствола.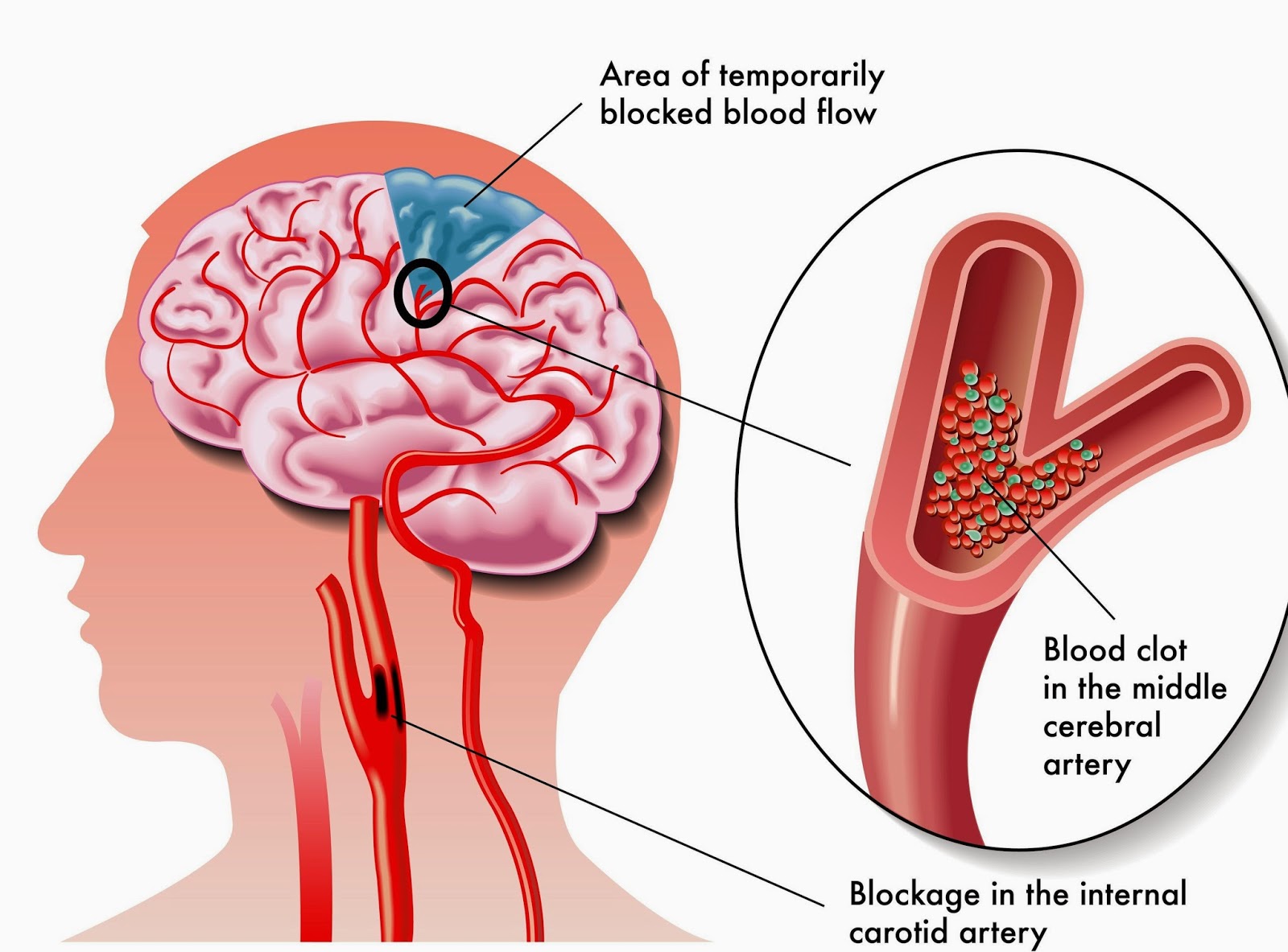 Болевые синдромы при стенокардии, особенно тяжелые, могут приводить к возникновению тран-зиторных ишемических атак и инсультов [2]. Помимо нервно-рефлекторных механизмов, имеют значение нарушения сократительной функции сердца и центральной гемодинамики, гипоксия, гуморальные и метаболические сдвиги.
Болевые синдромы при стенокардии, особенно тяжелые, могут приводить к возникновению тран-зиторных ишемических атак и инсультов [2]. Помимо нервно-рефлекторных механизмов, имеют значение нарушения сократительной функции сердца и центральной гемодинамики, гипоксия, гуморальные и метаболические сдвиги.
Исследованиями последних лет с применением трансэзофагеальной эхокардиографии установлено, что у 40-50% больных с ИИ выявляется потенциальная причина кардиальной эмболии [3].
Источником большинства кардиоэмболий являются камеры сердца (неклапанная фибрилляция предсердий, инфаркт миокарда, аневризма левого желудочка), заболевания клапанов, а также эмболы из венозной системы при наличии открытого овального окна, дефектов межжелудочковой и межпред-сердной перегородки (парадоксальная кардиоэмболия) [4].
У большинства больных встречается сочетанное атеросклеротическое поражение артерий различных сосудистых бассейнов различной степени выраженности.
Стеноз внутренней сонной артерии является доказанным фактором риска инсульта. Его распространенность (более 50% просвета) у лиц старше 65 лет достигает 5-7% [6].
Атероматозная бляшка располагается в местах изгиба и деления артерий, может вызвать сужение просвета артерии, ее окклюзию, а также быть источником атероэмболии, что приводит к развитию инфаркта мозга в соответствующем сосудистом бассейне [7].
Нарушения мозгового кровообращения при остром инфаркте миокарда чаще носят транзиторный характер, развиваются вследствие падения сердечного выброса, при нарушениях ритма и проводимости, при кардиогенном шоке. Инсультная форма инфаркта миокарда связана с локальной ишемией мозга вследствие одновременного тромбоза или спазма мозговых и коронарных артерий.
На фоне инфаркта миокарда ишемический инсульт может развиться в результате кардиальной эмболии или системного падения артериального давления, а геморрагический — вследствие применения тромбо-литиков и антикоагулянтов [9, 10]. После острого периода инфаркта миокарда при наличии персисти-рующего тромба в полости левого желудочка возможен кардиоэмболический инсульт [11]. У многих пациентов имеется патология экстра- и интрацереб-ральных артерий, а также другие не кардиальные причины инсульта [12].
В докладе экспертов ВОЗ в 1989 г. отмечается рост заболеваемости ревматизмом и аутоиммунными ревматическими заболеваниями в средних слоях населения некоторых экономически развитых стран, несмотря на повышение уровня жизни [13]. При снижении заболеваемости ревматизмом в России в 3 раза за последние 25 лет распространенность пороков сердца составляет 1,4%, или 0,02-0,03 на 1000 населения [14, 15].
Ревматические заболевания возникают преимущественно у лиц молодого возраста. Поражение нервной системы обусловлено васкулопатией, тромбозами, васкулитами, стенозами магистральных артерий головы. Аутоиммунные процессы в стенке церебральных сосудов приводят к сужению и окклюзии артерий мелкого калибра с нарушением микроциркуляции, патологическим изменениям реологических свойств крови, нарушению ауторегуляции мозгового кровотока[16].
При ревматических заболеваниях возможны не только тромбозы и эмболии мозговых сосудов, но и геморрагические формы инсультов, обусловленные пиогенным васкулитом и образованием микроаневризм. Инфекционный и возвратный эндокардит осложняется ишемическим инсультом в результате эмболии инфицированными вегетациями в 20% случаев [5]. Ревматическое поражение клапанов сердца, особенно митрального, может стать причиной эмболии, даже если у больного синусовый ритм, в кровоток могут попадать кальцифицированные фрагмен-
ты клапанов. При наличии искусственных клапанов сердца достаточно высок риск инфекционного эндокардита, особенно это касается митральных клапанов. Дилятационные кардиомиопатии часто осложняются внутрисердечным тромбообразованием и церебральной эмболией. В 75-80% случаев эмбол закрывает просвет среднемозговой артерии и ее ветвей, другой излюбленной локализацией являются мозжечковые сосуды, отходящие от позвоночной артерии. Цереброваскулярные синдромы могут быть первыми проявлениями этих заболеваний. Общий риск церебральной эмболии для всех искусственных клапанов составляет 2% в год [5].
При наличии искусственных клапанов сердца достаточно высок риск инфекционного эндокардита, особенно это касается митральных клапанов. Дилятационные кардиомиопатии часто осложняются внутрисердечным тромбообразованием и церебральной эмболией. В 75-80% случаев эмбол закрывает просвет среднемозговой артерии и ее ветвей, другой излюбленной локализацией являются мозжечковые сосуды, отходящие от позвоночной артерии. Цереброваскулярные синдромы могут быть первыми проявлениями этих заболеваний. Общий риск церебральной эмболии для всех искусственных клапанов составляет 2% в год [5].
По данным Научного центра неврологии РАМН в структуре ишемических нарушений мозгового кровообращения кардиоэмболические инсульты составляют 22% [17].
Фибрилляция предсердий, не связанная с ревматическим поражением клапанов сердца, является наиболее частой причиной кардиоэмболического инсульта, риск которого в этом случае повышается в 4-6 раз по сравнению с лицами, имеющими синусовый ритм, особенно резко увеличиваясь в старческом возрасте [5]. Примерно половина кардиоэм-болических инсультов обусловлена фибрилляцией предсердий [18]. Не все инсульты у больных с фибрилляцией предсердий носят тромбоэмболический характер, есть среди них внутримозговые геморрагии, а также лакунарные и гемодинамические синдромы, обусловленные поражением мелких сосудов и стенозом сонной артерии. Тем не менее у двух третей пациентов с фибрилляцией предсердий возникают инсульты кардиоэмболического характера, у части из них определяются тромбы в предсердиях.
Примерно половина кардиоэм-болических инсультов обусловлена фибрилляцией предсердий [18]. Не все инсульты у больных с фибрилляцией предсердий носят тромбоэмболический характер, есть среди них внутримозговые геморрагии, а также лакунарные и гемодинамические синдромы, обусловленные поражением мелких сосудов и стенозом сонной артерии. Тем не менее у двух третей пациентов с фибрилляцией предсердий возникают инсульты кардиоэмболического характера, у части из них определяются тромбы в предсердиях.
Было проведено пять рандомизированных контролируемых исследований по первичной профилактике инсульта у больных с фибрилляцией предсердий: Copenhagen Atrial Fibrillation Aspirin and Anticoagulation (AFASAK), Boston Area Anticoagulation Trial for Stroke Prevention (BAATAF), Stroke Prevention of Atrial Fibrillation (SPAF 1), Veterans Affairs Stroke Prevention in Stroke Prevention (SPINAF), Canadian Atrial Fibrillation Anticoagulation (CAFA). По их результатам, опубликованным в 1990-1992 гг. в журналах Stroke, Lancet, Circulation, N Eng J Med, получены данные о снижении риска инсульта на фоне приема аспирина и варфарина [19,
в журналах Stroke, Lancet, Circulation, N Eng J Med, получены данные о снижении риска инсульта на фоне приема аспирина и варфарина [19,
20, 21, 22, 23].
В исследованной нами когорте больных инсультом (883 больных мозговым инсультом) заболевания сердца находились на 2-м месте после артериальной гипертонии, встречались в 44,2% случаев, преобладали в группе женщин, одинаково часто встречались при ишемических и геморрагических инсультах, с высокой степенью достоверности преобладали в группе умерших пациентов [24, 25].
Эти данные согласуются с результатами популяционного исследования, проведенного в Новоси-
МАТЕРИАЛЫ СИМПОЗИУМА «СЕРДЦЕ-МОЗГ» СЪЕЗДА КАРДИОЛОГОВ И КАРДИОХИРУРГОВ СФО
бирске в 90-е годы ХХ века, в котором показано, что наиболее значимыми факторами риска после артериальной гипертонии являются гипертрофия левого желудочка по данным ЭКГ, ИБС, заболевание митрального клапана [26].
В ранее проведенных исследованиях по изучению летальных исходов инсультов и выборок населения было установлено, что ИБС часто связана с увеличением риска мозгового инсульта [27, 28]. Патология сердца в ряде случаев определяет исход инсульта, часто являясь непосредственной причиной смерти.
В остром периоде инсульта клинические проявления ИБС, как правило, мало выражены из-за тяжести основного заболевания. Наряду с этим у большинства больных отмечается декомпенсация коронарного кровообращения, в этих ситуациях показана диагностическая ценность суточного (холтеров-ского) мониторирования ЭКГ [29].
Фибрилляция предсердий является самостоятельным фактором риска инсульта и выявлена у 17% обследованных нами в ходе популяционного регистра пациентов с некоторым преобладанием, хотя и статистически не значимым, среди женщин.
Эта частота сопоставима с результатами исследования в России и Великобритании, по данным которых фибрилляция предсердий встречается почти в 20% случаев инсульта. По данным регистра инсульта, в Северске выявлено статистически значимое преобладание данного фактора риска в группе умерших больных. При этом отмечено, что распространенность фибрилляции предсердий при недифференцированных и ишемических инсультах значительно выше, чем при геморрагических. Показатель распространенности перенесенного инфаркта миокарда составил 13,3% и также был выше в группе умерших [24, 25].
По данным регистра инсульта, в Северске выявлено статистически значимое преобладание данного фактора риска в группе умерших больных. При этом отмечено, что распространенность фибрилляции предсердий при недифференцированных и ишемических инсультах значительно выше, чем при геморрагических. Показатель распространенности перенесенного инфаркта миокарда составил 13,3% и также был выше в группе умерших [24, 25].
Эта закономерность, выявляемая преимущественно за счет подвыборки мужчин, подтверждает факт более высокой опасности летального исхода инсульта у больных, ранее перенесших острый инфаркт миокарда.
В ходе проведенного нами исследования установлены электрокардиографические признаки, с высокой степенью достоверности ассоциированные со смертельным исходом: гипертрофия левого желудочка, синусовая тахикардия, фибрилляция предсердий, острая ишемия миокарда. Относительный риск фибрилляции предсердий (RR) колеблется от 2,6 до 4,5 в зависимости от возраста [5]. В проведенном нами анализе факторов риска по методу «случай -контроль» относительный риск фибрилляции предсердий составил 4,8.
В проведенном нами анализе факторов риска по методу «случай -контроль» относительный риск фибрилляции предсердий составил 4,8.
Снижение риска инсульта, инфаркта и сосудистой смерти при применении антиагрегантной терапии показано в мета-анализе группы по исследованиям антитромботической терапии, многоцентровом исследовании CAPRIE и CURE. Доказано снижение
относительного риска (RRR) на 68% при терапии варфарином и на 21% при терапии аспирином [30].
В настоящее время с учетом неоднородности этиологических причин и патогенетических механизмов развития, полиморфизма клинической картины ишемического инсульта всеобщее признание получила концепция гетерогенности инсульта. В нашей стране это учение разработано НЦН РАМН. Раскрытие патогенетической гетерогенности ишемического инсульта стало одним из наиболее значительных достижений последних десятилетий в области ангионеврологии. В настоящее время различают пять вариантов ишемического инсульта: атеротромботиче-ский, кардиоэмболический, лакунарный, гемодина-мический, по типу гемореологической окклюзии.
В настоящее время различают пять вариантов ишемического инсульта: атеротромботиче-ский, кардиоэмболический, лакунарный, гемодина-мический, по типу гемореологической окклюзии.
Патология сердца имеет наибольшее значение в развитии кардиоэмболического и гемодинамическо-го инсультов, которые встречаются с частотой 22% и 15% соответственно.
Патогенез гемодинамического инсульта основан на концепции нарушений церебральной перфузии вследствие ограничения кровотока в стенозирован-ных экстракраниальных и мозговых сосудах на фоне транзиторного снижения артериального давления. Причины церебральной гипоперфузии, приводящие к гемодинамическому инсульту, включают ортостатическую и ятрогенную гипотензию, ортостатическую церебральную ишемию без гипотензии, пери-операционные осложнения (особенно в сердечной хирургии), миокардиальную ишемию, сердечные аритмии, уменьшение или перераспределение массы циркулирующей крови, включая отвлечение крови к периферии.
В настоящее время установлено, что потенциальные причины кардиогенных ишемических инсультов обширны. Однако далеко не всегда выявление этой кардиальной патологии означает, что именно она стала непосредственной причиной очаговой ишемии мозга. Многообразие кардиальных нарушений, наблюдаемое почти у 70% больных с ишемическим инсультом, различная степень патогенетической значимости этих нарушений, идентичность патологии сердца, реализующейся через альтернативные механизмы инсульта, — все это требует от врача индивидуального похода к пациенту, проведения целенаправленного обследования экстра- и интракраниальных сосудов наряду с тщательным кардиологическим обследованием.
ЛИТЕРАТУРА
1. Инсульт: диагностика, лечение, профилактика. /Под редакцией З.А. Суслиной, М.А. Пирадова. — М.:Мед-пресс-информ, 2008. — 288 с.
2. Дудко В.А., Карпов Р.С. Атеросклероз сосудов сердца и головного мозга. — Томск: 8ТТ, 2002. — 416 с.
Дудко В.А., Карпов Р.С. Атеросклероз сосудов сердца и головного мозга. — Томск: 8ТТ, 2002. — 416 с.
3. Шевченко Ю.Л., Одинак М.М., Михайленко А.А., Кузнецов А.Н. Кардиоэмболический инсульт. // Клиническая медицина. — 1998. — Т. 76. — №12. — С. 13-18.
4. Верещагин Н.В., Борисенко В.В., Миловидов Ю.К., Гулевская Т. С. Кардионеврология: проблемы кардио-генной церебральной эмболии (Обзор зарубежной литературы). // Журнал неврологии и психиатрии им С.С. Корсакова. — 1993. — Т. 93. — №2. — С. 90-96.
5. Ворлоу Ч.П., Денис М.С., Ван Гейн Ж. и др.; пер. с англ. А.В. Борисова, Л.В. Бульбы, Ю.И. Бульбы и др.; под ред. А.А. Скоромца и В.А. Сорокоумова. Инсульт: практическое руководство для ведения больных. -С-Пб.: Политехника, 1998. — 629 с.
6. O’Leary D.H., Polak J.F., Kronmal R.A. et al. Distribution and correlates of sonographically defected carotid artery disease in the Cardiovascular Health Study: the CHS Collaborative Research Group // Stroke. — 1992. — V 23. -P. 1752-1760.
Distribution and correlates of sonographically defected carotid artery disease in the Cardiovascular Health Study: the CHS Collaborative Research Group // Stroke. — 1992. — V 23. -P. 1752-1760.
7. Шмидт Е.В. Сосудистые заболевания нервной системы. — М.: Медицина, 1975. — 662 с.
8. Руда М.Я., Зыско А.П. Инфаркт миокарда. — М. — Ме-дицина,1981. — 288 с.
9. Fibrinolytic Therapy Trialists’ (FTT) Collaborative Group. Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomized trials of more than 1000 patients // Lancet. — 1994.
— №343. — P. 311-322.
10. Vaitkus P.T., Barnathan E.S. Embolic potential, prevention and management of mural thrombus complication anterior myocardial infarction: a meta-analysis // J Am Coll Cardiol.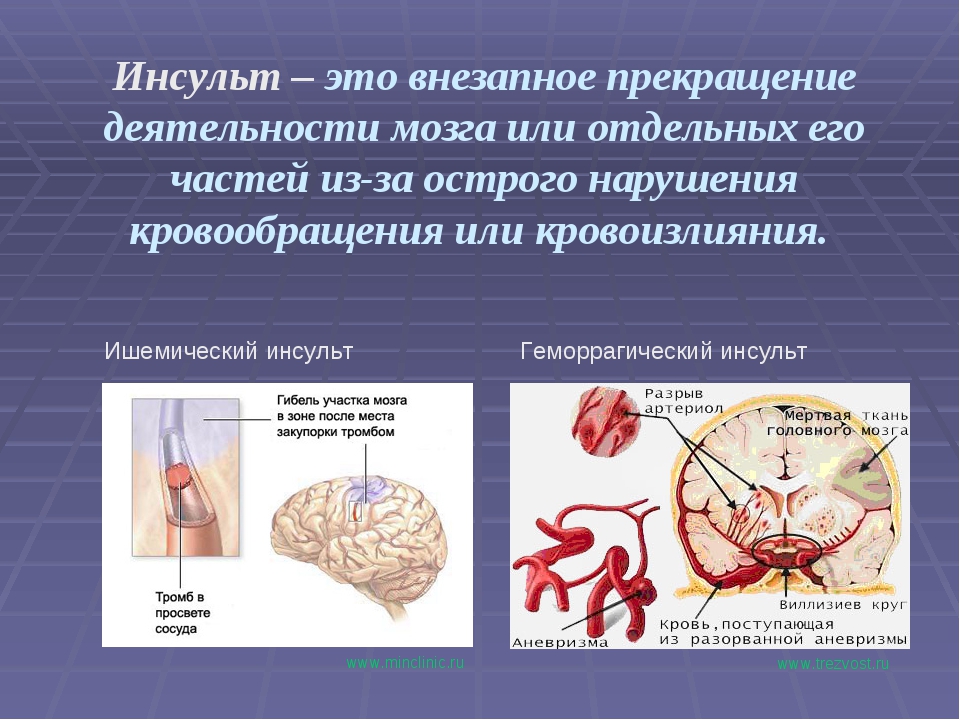
— 1993. — Vol. 22. — P. 1004-1009.
11. Tanne D., Goldbourt U., Zion M., et al. Frequency and prognosis of stroke/TIA among 4808 survivors of acute myocardial infarction. // Stroke. — 1993. — Vol. 24. -P. 1490-1495.
12. Martin R., Bogousslavsky J., for the Lausanne Stroke Registry Group. Mechanisms of late stroke after myocardial infarct: the Lausanne Stroke Registry. // J Neurol Neurosurg Psychiatr. — 1993. — Vol. 56. — P. 760-764.
13. Ревматизм и ревматическая болезнь сердца: доклад исследовательской группы ВОЗ. /Всемирная организация здравоохранения. — Женева, 1989. — 57 с.
14. Беневоленская Л.И., Бржезовский М.М. Эпидемиология ревматических болезней — М.: Медицина, 1988. — 240 с.
15. Насонова В.А., Астапенко М.Г. Клиническая ревматология: руководство для врачей — АМН СССР — М.: Медицина, 1989. — 592 с.
Насонова В.А., Астапенко М.Г. Клиническая ревматология: руководство для врачей — АМН СССР — М.: Медицина, 1989. — 592 с.
16. Пизова, Н.В., Спирин Н.Н., Шилкина Н.П. Факторы риска острых нарушений мозгового кровообращения при ревматических заболеваниях //Инсульт: приложение к Журналу неврологии и психиатрии им. С.С. Корсакова. — 2001. — Вып. 3. — С. 16-20.
17. Верещагин Н.В., Пирадов М.А., Суслина З.А. Инсульт. Принципы диагностики, лечения и профилактики: краткое руководство для врачей. — М.: Интермедика, 2002. — 208 с.
18. Wolf P.A., Abbot R.D., Kannel WB. Atrial fibrillation as an independent risk factor for stroke: Framingham Study // Stroke. — 1991. — Vol. 22. — P. 983-988.
19. Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators. The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation // N Engl J Med. — 1990. — Vol. 22. — P 1505-1511
— 1990. — Vol. 22. — P 1505-1511
20. Connolly S.J., Laupacis A., Gent M. et al. Canadian Atrial Fibrillation Anticoagulation (CAFA) Study // J Am Coll Cordiol. — 1991. — №18. — P 349-355.
21. Ezekowitz M.D., Bridgers S.L., James K.E. et al. Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation: Veterans Affairs Stroke Prevention in Nonrheumatic Atrial Fibrillation Investigators // N EngI J Med. — 1992. — №327. — P 1406-1412.
22. Petersen P., Boysen G., Godtfredsen J. et al. Placebo -controlled, randomized trial of warfarin and aspirin for prevention of tromboembolic complications in chronic atrial fibrillation: the Copenhagen AFASAK study // Lancet. — 1989. — Vol. 1. — P. 175-179.
23. Stroke Prevention in Atrial Fibrillation Investigators. Stroke prevention in atrial fibrillation study: final results // Circulation. — 1991. — Vol. 84. — P. 527-539.
— 1991. — Vol. 84. — P. 527-539.
24. Алифирова В.М., Антухова О.М. Результаты регистра инсульта в популяции закрытого территориального образования. //Материалы IX Всероссийского съезда неврологов. — Ярославль, 2006. — С. 361.
25. Алифирова В.М., Антухова О.М. Смертность от инсульта в промышленном центра Западной Сибири. //Инсульт: приложение к Журналу неврологии и психиатрии им. С.С. Корсакова. — 2007. — Спецвыпуск: материалы II Российского международного конгресса «Цереброваскулярная патология и инсульт». — С. 198.
26. Фейгин В.Л., Никитин Ю.П., Виноградова Т.Е. и др. Эпидемиология мозгового инсульта в Сибири. //Журнал неврологии и психиатрии им. С.С. Корсакова. -2001. — Том 101. — №1. — С. 52-57.
27. Shaper A.G., Phillips A.N., Pocock S.J. et al. Risk factors for stroke in middle — aged British men // Br. Med. J. -1991. — №302. — P. 1111-1115.
Med. J. -1991. — №302. — P. 1111-1115.
28. Stemmermann G.N., Hayashi T., Resch J.A. et al. Risk factors related to ischaemic and haemorrhagic cerebrovascular disease at autopsy: the Honolulu Heart Study // Stroke. — 1984. — №15. — P. 23-28.
29. Суслина З.А., Фонякин А.В., Петрова Е.А. и др. Значение холтеровского мониторирования ЭКГ в остром периоде ишемического инсульта. //Терапевтический архив. — 1997. — Т. 69. — №4. — С. 24-26.
30. Никитин Ю.П., Пилипенко П.И. Инсульт: первичная и вторичная профилактика // INTERMEDINFO. — 2001.
— №1 (6). — С. 4-20.
Риск развития ишемического инсульта у больных, перенесших обострение ишемической болезни сердца | Бражник
1. Park KL, Budaj A, Goldberg RJ, Anderson FA, Agnelli G, Kennelly BM et al. Risk-Prediction Model for Ischemic Stroke in Patients Hospitalized With an Acute Coronary Syndrome (from the Global Registry of Acute Coronary Events [GRACE]). The American Journal of Cardiology. 2012;110(5):628–35. DOI: 10.1016/j.amjcard.2012.04.040
Park KL, Budaj A, Goldberg RJ, Anderson FA, Agnelli G, Kennelly BM et al. Risk-Prediction Model for Ischemic Stroke in Patients Hospitalized With an Acute Coronary Syndrome (from the Global Registry of Acute Coronary Events [GRACE]). The American Journal of Cardiology. 2012;110(5):628–35. DOI: 10.1016/j.amjcard.2012.04.040
2. Yaghi S, Pilot M, Song C, Blum CA, Yakhkind A, Silver B et al. Ischemic Stroke Risk After Acute Coronary Syndrome. Journal of the American Heart Association. 2016;5(7):e002590. DOI: 10.1161/JAHA.115.002590
3. Goff DC, Lloyd-Jones DM, Bennett G, Coady S, D’Agostino RB, Gibbons R et al. 2013 ACC/AHA Guideline on the Assessment of Cardiovascular Risk: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;129(25 suppl 2):S49–73. DOI: 10.1161/01. cir.0000437741.48606.98
cir.0000437741.48606.98
4. Guerra F, Scappini L, Maolo A, Campo G, Pavasini R, Shkoza M et al. CHA(2)DS(2)-VASc risk factors as predictors of stroke after acute coronary syndrome: A systematic review and meta-analysis. European Heart Journal: Acute Cardiovascular Care. 2018;7(3):264–74. DOI: 10.1177/2048872616673536
5. Аверкова А.О., Бражник В.А., Королева О.С., Зубова Е.А., Хасанов Н.Р., Чичков Ю.М. и др. Особенности течения острого коронарного синдрома у молодых больных с гиперлипидемией по данным наблюдательного проекта ОРАКУЛ II. Медицинский вестник Северного Кавказа. 2017;12(1):5-8. DOI: 10.14300/mnnc.2017.12001
6. Эрлих А.Д., Грацианский Н.А. Российский регистр острого коронарного синдрома ‘РЕКОРД-3’. Характеристика пациентов и лечение до выписки из стационара. Кардиология. 2016;56(4):16-24. DOI: 10.18565/cardio.2016.4.16-24
7. Chandiramani R, Chen H, Aoi S, Giustino G, Claessen B, Sartori S et al. Incidence, predictors and impact of stroke on mortality among patients with acute coronary syndromes following percutaneous coronary intervention – Results from the PROMETHEUS registry. Catheterization and Cardiovascular Interventions. 2020;95(5):885–92. DOI: 10.1002/ccd.28369
8. Ge Z, Baber U, Claessen BE, Farhan S, Chandrasekhar J, Li SX et al. The prevalence, predictors and outcomes of guideline-directed medical therapy in patients with acute myocardial infarction undergoing PCI, an analysis from the PROMETHEUS registry. Catheterization and Cardiovascular Interventions. 2019;93(3):E112–9. DOI: 10.1002/ccd.27860
9. Wang Y, Yan BP, Nichol MB, Tomlinson B, Lee VWY. Real-world study of low-density lipoprotein cholesterol levels and cardiovascular outcomes in Chinese: A retrospective cohort study in post-percutaneous coronary intervention acute coronary syndrome patients. International Journal of Cardiology. 2017;249:18–24. DOI: 10.1016/j.ijcard.2017.07.016
10. Cordero A, Rodriguez-Mañero M, García-Acuña JM, BertomeuGonzález V, Agra-Bermejo R, Cid B et al. Incidence and predictors of stroke in patients discharged with the diagnosis of acute coronary syndrome. International Journal of Cardiology. 2019;276:20–5. DOI: 10.1016/j.ijcard.2018.10.082
11. Lucà F, Caretta G, Vagnarelli F, Marini M, Iorio A, Di Fusco SA et al. Clinical characteristics, management and outcomes of patients with acute coronary syndrome and atrial fibrillation: real-world data from two nationwide registries in Italy. Journal of Cardiovascular Medicine. 2020;21(2):99–105. DOI: 10.2459/JCM.0000000000000911
12. Luo J, Li H, Qin X, Liu B, Zhao J, Maihe G et al. Increased risk of ischemic stroke associated with new-onset atrial fibrillation complicating acute coronary syndrome: A systematic review and meta-analysis. International Journal of Cardiology. 2018;265:125–31. DOI: 10.1016/j.ijcard.2018.04.096
13. Shen Y, Shi L, Nauman E, Katzmarzyk PT, Price-Haywood EG, Bazzano AN et al. Inverse Association Between HDL (High-Density Lipoprotein) Cholesterol and Stroke Risk Among Patients With Type 2 Diabetes Mellitus. Stroke. 2019;50(2):291–7. DOI: 10.1161/STROKEAHA.118.023682
14. Zheng J, Sun Z, Zhang X, Li Z, Guo X, Xie Y et al. Non-traditional lipid profiles associated with ischemic stroke not hemorrhagic stroke in hypertensive patients: results from an 8.4 years follow-up study. Lipids in Health and Disease. 2019;18(1):9. DOI: 10.1186/s12944-019-0958-y
15. Reina SA, Llabre MM, Allison MA, Wilkins JT, Mendez AJ, Arnan MK et al. HDL cholesterol and stroke risk: The Multi-Ethnic Study of Atherosclerosis. Atherosclerosis. 2015;243(1):314–9. DOI: 10.1016/j.atherosclerosis.2015.09.031
16. Álvarez-Álvarez B, Raposeiras-Roubín S, Abu-Assi E, CambeiroGonzález C, Gestal-Romaní S, López-López A et al. Is 6-month GRACE risk score a useful tool to predict stroke after an acute coronary syndrome? Open Heart. 2014;1(1):e000123. DOI: 10.1136/openhrt-2014-000123
Состояние сердца и течение острого периода ишемического инсульта
На правах рукописи
00316861В
ТРУНОВА ЕЛЕНА СЕРГЕЕВНА
СОСТОЯНИЕ СЕРДЦА И ТЕЧЕНИЕ ОСТРОГО ПЕРИОДА ИШЕМИЧЕСКОГО ИНСУЛЬТА
14 00./¡-ОЦЛ 2008 г. в 12 часов на заседании диссертационного совета Д 001.006 01 при ГУ Научном центре неврологии Российской академии медицинских наук по адресу 125367 Москва, Волоколамское шоссе, 80.
С диссертацией можно ознакомиться в библиотеке ГУ НЦН РАМН
Автореферат разослан « » 2008 г.
Ученый секретарь диссертационного совета, кандидат медицинских наук
М А Домашенко
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Концепция патогенетической гетерогенности ишемического инсульта базируется на многообразии причин развития острых нарушений мозгового кровообращения (ОНМК), среди которых кардиальная патология занимает одно из ведущих мест (Верещагин Н.В с соавт., 1997, Суслина З.А., 2002) Внедрение кардиологических методов диагностики в клиническую ангионеврологию позволило обнаружить более чем у 70% пациентов различные сердечные изменения, которые не только выступают как причина ОНМК, но и влияют на течение ишемического инсульта (Суслина ЗА. с соавт, 2003; Фонякин А.В с соавт, 2005, Bartko D. et al., 1996).
Важнейшей задачей раннего постинсультного периода является максимальное восстановление нарушенных функций с учетом индивидуальных компенсаторных возможностей, которые определяются церебральным поражением и состоянием сердца (Petty G W. et al., 2000) Адаптация сердца к возрастающей нагрузке представляет собой один из центральных вопросов всей проблемы ранней реабилитации, так как ограниченная способность сердца увеличивать свою функцию нередко становится звеном, лимитирующим интенсивность и длительность приспособительных реакций целого организма (Меерсон Ф.З., 1975) Наличие коронарной патологии, хронической сердечной недостаточности (ХСН), клапанных пороков, разнообразных аритмий, эпизодов ишемии миокарда и нарушение автономной регуляции сердца могут неблагоприятно повлиять на темпы постинсультного восстановления (Hier D.B , Edelstein G , 1991, Lamassa M. et al, 2001)
Цикл исследований, выполненных в НИИ неврологии РАМН (Устинова Е.З., 1967, Усман В.Б., 1973; Петрова Е.А., 1999, Фонякин А.В , 2000), продемонстрировал значимость ряда нарушений ритма сердца и эпизодов безболевой ишемии миокарда в патогенезе ишемического инсульта, течении и прогнозировании его исходов. В последние годы в мире возрос интерес к изучению вариабельности сердечного ритма (ВСР) как показателя, отражающего автономную регуляцию сердца и определяющего риск внезапной сердечной смерти (Makikallio A.M. et al., 2004; McLaren A. et al., 2005). Показано, что в остром периоде инсульта регистрируется наибольшее количество аритмий, оказывающих негативное влияние на центральную и церебральную гемодинамику, а также происходит снижение ВСР, обусловленное поражением определенных мозговых структур (Korpelainen JT. et al, 1997, 1999) Однако исследований, посвященных
динамике показателей суточного мониторирования ЭКГ в течение острого периода инсульта, взаимосвязи изменений электрофизиологических характеристик сердца с особенностями мозгового поражения и формой сердечной патологии, в доступной литературе встречено не было. Не изучено влияние сократимости сердца и кардиальных аритмий на динамику неврологического статуса. Кроме того, ранее не проводилось детальной оценки циркадных характеристик сердечного ритма, являющихся индикатором отклонений, возникающих в регулирующих системах и имеющих важное диагностическое и прогностическое значение при разнообразной кардиальной и церебральной патологии. Своевременная коррекция выявленных сердечных нарушений может содействовать совершенствованию ранней постинсультной реабилитации
В связи с этим изучение влияния кардиальных аритмий, сократимости левого желудочка (ЛЖ), автономной регуляции сердца на течение острого периода ишемического инсульта, определение церебрального воздействия на кардиальные функции призвано оптимизировать процессы адаптации сердца в динамике острого периода ишемического инсульта и помочь в реабилитации больных.
Цель исследования. Изучить состояние сердечного ритма и динамику неврологического восстановления в течение острого периода ишемического инсульта в зависимости от формы кардиальной патологии и особенностей церебрального поражения. Задачи исследования:
1. Оценить характер кардиальной патологии у пациентов с острым ишемическим инсультом в сравнении с больными хроническими цереброваскулярными заболеваниями
2. Исследовать аритмии, циркадные характеристики ритма сердца, ишемические изменения миокарда (по данным холтеровского мониторирования с проведением спектрального анализа ВСР) в начале (1-4 сутки) и по окончании острого периода (21-22 сутки) ишемического инсульта.
3. Сопоставить выявленные кардиальные изменения с локализацией и величиной острого очагового поражения мозга, а также с формой кардиальной патологии.
4. Проанализировать динамику неврологического дефицита во взаимосвязи с систолической функцией сердца, кардиальными аритмиями, показателями автономной регуляции сердца и характеристиками церебрального поражения.
Научная новизна. Впервые в динамике острой фазы ишемического инсульта изучено цереброгенное воздействие на частоту, характер нарушений ритма сердца и эпизоды ишемических изменений миокарда. Впервые в остром периоде ишемического инсульта во взаимосвязи с кардиальной и церебральной патологией методом суточного мониторирования ЭКГ исследованы циркадные колебания частоты сердечных сокращений (ЧСС) и ВСР как маркеров адаптационных возможностей сердца Продемонстрировано, что величина и динамика дневной ЧСС обусловлены уровнем двигательной активности пациента, а ночной ЧСС — состоянием автономных воздействий. Наиболее выраженные нарушения вегетативной регуляции сердца связаны с локализацией инфаркта в вертебрально-базилярной системе (ВБС) и большим размером церебрального поражения. Приспособительные возможности сердца к возрастающей физической нагрузке в процессе ранней постинсультной реабилитации находятся в зависимости от локализации ишемического очага и характера сердечной патологии.
Практическая значимость. Установлено, что в острейшем периоде ишемического инсульта происходит усиление наджелудочковой и желудочковой эктопической активности, наиболее выраженное у больных с большими очагами в зоне васкуляризации каротидной системы, с коронарной патологией и ХСН. Адаптация сердца при этом протекает в условиях стойких нарушений циркадного ритма ЧСС, дефицита автономной регуляции сердца в виде редукции симпатических и вагусных влияний Локализация ишемического очага в ВБС связана со стойким и прогрессирующим угнетением парасимпатической регуляции сердца, особенно в ночное время Увеличение наджелудочковой и желудочковой экстрасистолии сопряжено со снижением темпов постинсультного восстановления у больных с большими ишемическими очагами и наличием симптомной ХСН. При ИБС выявляется тенденция к обратной взаимосвязи между регрессом неврологического дефицита и значениями ударного объема (УО) ЛЖ и минутного объема сердца (МОС)
Основные положения, выносимые на защиту:
1. В острейшей фазе ишемического инсульта регистрируется нарастание наджелудочковой и желудочковой эктопической активности и нарушение вегетативной регуляции сердца.
2. По окончании острого периода инсульта при большом очаговом поражении мозга, ХСН II стадии и коронарной патологии сохраняется
увеличенное количество наджелудочковых и желудочковых аритмий, эпизодов брадиаритмий и безболевой ишемии миокарда.
3 Регресс неврологического дефицита в острой фазе ишемического инсульта находится в обратной связи с частотой эпизодов брадиаритмий и ишемических изменений сегмента ST.
4 При локализации ишемического очага в ВБС нарушение циркадного индекса ЧСС ассоциируется с замедлением неврологического восстановления.
Апробация работы
Работа апробирована и рекомендована к защите на совместном заседании сотрудников I, II и III сосудистых отделений, нейрогенетического, нейроинфекционного, научно-консультативного отделений, отделения реанимации и интенсивной терапии, отделения лучевой диагностики, научно-координационного отдела, лаборатории эпидемиологии и профилактики заболеваний нервной системы, лабораторий экспериментальной патологии нервной системы, гемостаза, нейрохимии, медицинской информатики НЦН РАМН 16 ноября 2007 г. Материалы диссертации были представлены на научных конференциях и лекциях НЦН РАМН (2005, 2006), на Российском Национальном конгрессе кардиологов (Москва, 2005), Международном симпозиуме «Актуальные вопросы кардионеврологии» (Судак, АР Крым, 2006), Седьмой Всероссийской конференции «Современные возможности холтеровского мониторирования», Пятой Северо-Западной международной научно-практической конференции по проблемам внезапной смерти (С-Петербург, 2006), Республиканском семинаре «Академия ангионеврологии и инсульта» (Уфа, 2006; Красноярск, 2006, Иваново, 2007; Хабаровск, 2007), на VI Международной конференции по реабилитологии (Москва, 2006), IX Всероссийском научно-образовательном форуме «Кардиология 2007» (Москва, 2007), Первой международной конференции «Актуальные вопросы теории и практики нейрореабилитации» (Москва, 2007), IX Международном симпозиуме стран Восточной Европы и Средней Азии «Неврологические расстройства» (Судак, АР Крым, 2007), на заседании Московского общества неврологов (2007), II конгрессе общества специалистов по сердечной недостаточности «Сердечная недостаточность’ 2007» (Москва, 2007).
Публикации. По теме диссертации опубликовано 19 научных работ.
Структура и объем диссертации. Диссертация изложена на 147 страницах машинописного текста, содержит 42 таблицы и иллюстрирована 12 рисунками. Работа состоит из введения, обзора литературы, общей характеристики обследованных лиц и методов исследования, 3 глав, отражающих собственные исследования, обсуждения полученных результатов, выводов и литературного указателя, содержащего 70 отечественных и 156 зарубежных источников
ОБЪЕМ И МЕТОДЫ ИССЛЕДОВАНИЯ
Диссертационная работа основана на анализе данных обследования 95 больных в острой стадии ишемического инсульта (1 группа), 50 больных с хроническими цереброваскулярными заболеваниями (2 группа) и 30 здоровых лиц, вошедших в группу контроля.
Всем больным 1 и 2 группы были проведены компьютерно-томографическое (КТ) или магнитно-резонансно-томографическое (МРТ) исследование головы, дуплексное сканирование (ДС) экстра- и интракраниальных артерий. Суточное холтеровское мониторирование (ХМ) выполнено всем обследованным лицам. Изучение центральной гемодинамики включало проведение всем пациентам и лицам контрольной группы трансторакалыюй эхокардиографии (Dormer AI 4800, Vivid 3 GE, США) Из парастернальной позиции по длинной оси ЛЖ, в М-режиме определяли толщину межжелудочковой перегородки (МЖП), толщину задней стенки ЛЖ (ЗСЛЖ), конечный диастолический и систолический размер ЛЖ, УО ЛЖ Конечный диастолический объем (КДО), конечный систолический объем (КСО) и фракцию выброса (ФВ) ЛЖ рассчитывали по формуле Teicholz L.E. (1991). Кроме того, рассчитывали МОС и сердечный индекс (СИ) Состояние диастолической функции ЛЖ оценивали на основании изучения параметров трансмитрального кровотока в импульсном допплеровском режиме из верхушечной 4-камерной позиции сердца.
ХМ (Кардиотехника-4000, С-Пб) пациентам 1 группы осуществляли дважды: в острейшей фазе инсульта (1-4 сутки) и по окончании острого периода (21-22 сутки). Оценивалась максимальная ЧСС, минимальная ЧСС и средняя ЧСС за весь период наблюдения. Циркадный индекс (ЦИ) рассчитывался как отношение средней дневной к средней ночной ЧСС. Проводилась количественная оценка наджелудочковых аритмий, включая одиночные, парные и групповые наджелудочковые экстрасистолы (НЖЭ), эпизоды суправентрикулярной тахикардии, пароксизмальной тахикардии и мерцательной аритмии; желудочковых аритмий, эпизодов синоаурикулярной (СА) и атриовентрикулярной (АВ) блокады 2 степени и безболевой ишемии
миокарда Изучались спектральные характеристики ВСР по высоким (ВЧ) и низким частотам (НЧ) Суточный индекс вариабельности (СИВ) рассчитывался как отношение дневных и ночных значений в спектре высоких и низких частот (НЧ день/НЧ ночь и ВЧ день/ВЧ ночь).
Компьютерная статистическая обработка полученных результатов проводилась на основе пакета программ STATISTICA 6.0 (StatSoft, США). При нормальном распределении признака результаты описаны в виде среднего значения ± стандартное отклонение (M±SD). При распределении признака, отличном от нормального, данные представлены как медиана значений и межквартильный интервал [Me (25%, 75%)] Для проверки гипотезы о различии выборок (групп больных) использованы Mann-Whitney U-test, t-test Изменения признака в динамике оценивали с помощью Wilcoxon matched pairs test Для выявления связи признаков применялся непараметрический корреляционный анализ по Gamma. Статистически достоверными различия считали при р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Основным заболеванием сердечно-сосудистой системы у большинства пациентов 1 и 2 групп была артериальная гипертония (АГ) и сочетание АГ с атеросклерозом. Атеросклероз без АГ встречался реже: у 5 (5%) больных 1 группы и 5 (10%) пациентов 2 группы. Ведущей кардиальной патологией, обнаруженной у большинства пациентов 1 и 2 группы: 65 (68%) и 29 (58%) больных соответственно, была ХСН I и II стадии Основными причинами ее развития послужили АГ и ИБС Второй по частоте выявляемости патологией была ИБС, представленная стенокардией и постинфарктным кардиосклерозом (ПИКС) у 24 (25%) больных 1 группы и 19 (38%) пациентов 2 группы. Приобретенные пороки сердца выявлялись реже и имелись соответственно у 19 (20%) пациентов 1 группы и 6 (12%) больных 2 группы.
Неврологическая характеристика больных
В 1 группе лакунарный инсульт (ЛИ) диагностирован у 28 (29%) пациентов, кардиоэмболический (КЭИ) и атеротромботический (АТИ) имели по 26 (28%) больных, гемодинамический (ГДИ) — 8 (8%) пациентов (рис. 1). Из прочих 7 (7%) пациентов у 3 больных инсульт развился на фоне выраженных нарушений гемостаза (гемореологическая микрооклюзия), у оставшихся 4 пациентов причина инсульта осталась неуточненной
□ Кардиоэмболический Е2 Атеротромботический
□ Лакунарный ® Гемодинамический ■ Прочие _
Рис. 1. Распределение больных 1 группы по подтипам ишемического инсульта (число больных)
Для оценки выраженности неврологического дефицита была использована Скандинавская шкала. Выраженность неврологических расстройств у больных варьировала от легкой до тяжелой степени (рис. 2). При этом большинство — 61 (64%) пациентов — имели легкую степень неврологических расстройств, у 24 (25%) пациентов неврологический дефицит соответствовал средней тяжести, а у 10 (11%) больных имелась тяжелая степень неврологических расстройств. Регресс неврологического дефицита определяли как разницу между количеством баллов, полученных в результате оценки по Скандинавской шкале при поступлении в стационар (во время проведении 1-го ХМ) и на 21 сутки от развития инсульта (во время проведения 2-го ХМ).
11%
0 Тяжелая ■ Средняя □ Легкая
Рис. 2. Распределение больных 1 группы по степени выраженности неврологических расстройств в острейшем периоде инсульта
Обширное ишемическое поражение головного мозга визуализировано у 2 (2%) больных. Несколько чаще размер инфаркта мозга соответствовал большому -11 (12%) пациентов. Большинство лиц, включенных в 1 группу, имели средние и малые очаги: 43 (45%) и 39 (41%) больных соответственно Обнаружено, что в 1 группе у 17 (18%) больных ишемический инсульт развился в вертебрально-базилярной системе (ВБС), а у 78 (82%) — в каротидной системе (КС). При этом поражение правой и левой КС диагностировано с одинаковой частотой — по 39 (41%) пациентов.
Ультразвуковая характеристика магистральных артерий головы (МАГ) и сердца
По данным дуплексного сканирования в 1 группе атеросклеротические поражения МАГ встречались у 48 (51%) больных, причем доминировали невыраженные изменения- плоские фиброзные или кальцифицированные бляшки, стенозирующие просвет сосуда менее 70% — 33 (35%) больных Гемодинамически значимые стенозы (70% просвета сосуда и более), окклюзии встречались реже — у 15 (16%) больных. Деформации сосудов в виде изгибов, извитостей обнаружены у 14 (15%) больных У остальных пациентов 1 группы изменения МАГ отсутствовали либо отмечалось утолщение комплекса «интима-медиа» Аналогичные изменения выявлены и во 2 группе.
Таблица 1. Эхокардиографические показатели больных и лиц контрольной группы _
Эхокардиографические показатели 1 группа (п=95) 2 группа (п=50) Контроль (п=30)
Диаметр ЛП, мм 38,9±5,4 * 38,0±3,2* 34,3±3,1
КДО ЛЖ, мл 121,7±27,1 128,2±33,1 117,9±17,4
КСО ЛЖ, мл 46,2±45,1 46,3±25,9 38,4±7,3
УО ЛЖ, мл 80,3±16,6 82,5±12,5 79,5±11,9
ФВ ЛЖ, % 66,7±7,9 65,5±8,7 67,7±3,6
МОС, л/мин 5,5±1,3 5,7±1,0 5,3±0,8
Толщина МЖП, мм 11,3±2,7 * 11,4±2,0* 8,9±1,1
Толщина ЗСЛЖ, мм 10,8±2,1 * 11,2±2,0* 8,8±1,0
Диастолическая дисфункция ЛЖ (число больных, %) 45 (47%) * 28 (56%)* 1 (3%)
Локальный гипо/акинез ЛЖ (число больных, %) 9 (10%) * 6 (12%)* -
Примечание. * — р<0,001 при сравнении с контрольной группой.
При эхокардиографии у больных 1 и 2 групп (табл.1) регистрировалось увеличение толщины МЖП и ЗСЛЖ, у половины больных выявлена диастолическая дисфункция ЛЖ, Сегментарный гипокинез, обусловленный Рубцовым поражением миокарда, визуализирован у небольшого числа пациентов 1 и 2 групп. В целом, размеры ЛЖ и показатели его систолической функции не отличались от контрольных значений
Нарушения ритма сердца в динамике острого инсульта
У больных 1 группы в острейшем периоде инсульта по сравнению с контрольной и 2 группой отмечено увеличение числа одиночных, парных и залповых НЖЭ, а также числа пароксизмов фибрилляции предсердий (ФП) (табл. 2). Кроме того, было зарегистрировано увеличение желудочковых экстрасистол (ЖЭ), эпизодов брадиаритмий и ишемических изменений (депрессии) сегмента БТ
Таблица 2. Нарушения сердечного ритма в динамике острого периода ишемического инсульта, во 2-ой и в контрольной группе_
Нарушения сердечного ритма 1 группа (п=95) 2 группа (п=50) Контроль (п=30)
1 ХМ 2ХМ
Одиночные НЖЭ 48 т •• (12, 458) 24 #** (10,117) 15 (7,45) 16 (9,5; 46,5)
Парные НЖЭ 1#» (0;6) 1 • (0,3) 0 (0; 1) 0 (0; 1,5)
Залповые НЖЭ 1 ## » (0,3) о ** • (0,1) от (0; 1) 0 (0;0)
Пароксизмы ФП (число больных, %) 26 (27%) № • 20 (21%) * 6 (12%) 1 (3%)
Одиночные ЖЭ 8 т (1, 132) 5 (1; 54) 7,5 (1, Ю0) 2,5 (0,5, 75)
Парные ЖЭ 0 # (0,1) о ** (0,0) 0 (0,0) 0 (0,0)
Частая ЖЭ (число больных, %) 19 (20%) № 11(12%)« 9 (18%) ## 1 (3%)
Брадиаритмии (число больных, %) 11 (12%) 8 (8%) 5 (10%) -
Депрессия сегмента БТ (число больных, %) 5 (5%) 3 (3%) — -
Примечание. * — р=0,07; ** — р<0,05, *** — р<0,001 при сравнении с 1 исследованием; # — р=0,08; ## — р<0,05 при сравнении с контрольной группой; • — р<0,05, •• — р<0,01 при сравнении с 2 группой.
По окончании острого периода у больных 1 группы статистически значимо уменьшилось число одиночных и залповых НЖЭ, а также парных ЖЭ (табл. 2). Вместе с тем парные и залповые НЖЭ продолжали регистрироваться чаще по сравнению со 2 группой Кроме того, отмечено снижение числа пациентов с пароксизмами ФП и частой ЖЭ. Брадиаритмии и ишемические изменения сегмента БТ при повторном ХМ регистрировались с той же частотой, что и при 1 ХМ.
Таким образом, в острейшей фазе ишемического инсульта отмечается повышенная наджелудочковая и желудочковая эктопическая активность, тенденция к более частой регистрации пароксизмов ФП, одиночных ЖЭ и частой ЖЭ.
Неврологическое восстановление
У больных в острой стадии ишемического инсульта установлены статистически значимые ассоциации между динамикой неврологического дефицита, основанной на оценке прироста баллов по Скандинавской шкале, и числом брадиаритмических эпизодов и ишемических изменений сегмента БТ (табл. 3) Чем чаще регистрировались перечисленные нарушения, тем хуже было неврологическое восстановление.
Таблица 3. Взаимосвязь прироста баллов по Скандинавской шкале и кардпальных параметров (корреляционный анализ по Gamma)_
Показатель R Достоверность (р)
Брадиаритмии (1 ХМ) -0,43 0,008
Депрессия сегмента ST (1ХМ) -0,41 0,07
Брадиаритмии (2 ХМ) -0,41 0,03
Депрессия сегмента ST (2ХМ) -0,68 0,02
Автономная регуляция сердца в острой стадии инсульта
У больных в острейшем периоде ишемического инсульта максимальная ЧСС была ниже контрольных значений, а средняя ночная ЧСС — выше (табл. 4). Увеличение средних ночных значений ЧСС указывало на наличие вегетативной дизрегуляции. Это подтверждалось сниженными значениями ЦИ
Таблица 4. Показатели сердечного ритма в динамике острого периода
ишемического инсульта и в группах сравнения
Параметры 1 группа (п=95) 2 группа (п=50) Контроль (п=30)
1 ХМ 2 ХМ
ЧСС макс 104 # (91,117) 108* (100; 122) 107 (95; 113) 116 (99,5, 128,5)
ЧСС ср. 68 (60, 75) 70,5 * (62, 78) 68 (58,73) 67 (65; 91,5)
ЧСС мин. 52 (46; 59) 52« (47; 58) 48 (46, 52) 51 (46,5, 53)
ЧССср день. 70 (62; 79) 74 ** (67, 82) 71 (61; 77) 71,5 (69; 76,5)
ЧССср ночь 63 #• (57; 74) 63 (58, 72) 57 (52, 62) 58,5 (55,5, 61)
ЦИ 1,09 m -(1,04, 1,16) 1,16 **#• (1,1, 1,23) 1,20 (1,17; 1,26) 1,26 (1,12; 1,3)
ВЧ день, мс2 67 # (р=0,06) • • (33, 142) 43 *Ш •• (30, 86) 125 (83; 282) 125,5 (59; 144,5)
ВЧ ночь, мс2 80 # •• (40; 182) 61 ## •• (29, 132) 223 (92,388) 177,5 (106; 272)
НЧ день, мс2 224 # » (118; 379) 191 #•• (100, 376) 588 (258; 1124) 314 (208; 501)
НЧ ночь, мс2 258 #•• (149; 474) 210 ##•• (112,379) 742 # (350; 1401) 394,5 (322,5; 543,5)
СИВ ВЧ 0,88 # (0,62; 1,25) 0,81# (0,54, 1,29) 0,81 (0,56; 0,96) 0,59 (0,43, 0,76)
СИВНЧ 0,89 (0,63, 1,16) 0,82 (0,63, 1,34) 0,67 (0,5, 0,93) 0,73 (0,62, 1,07)
Примечание. *- р<0,05; **- р<0,001 при сравнении с 1 исследованием,
# — р<0,05, # # — р<0,001 при сравнении с контрольной группой;
• — р<0,05, •• — р<0,001 при сравнении с 2 группой
Спектральный анализ ВСР у больных 1 группы выявил снижение мощности ВЧ и НЧ спектров, как в дневные, так и ночные часы. Это могло свидетельствовать о выраженном вегетативном дефиците Показатели СИВ ВЧ были статистически значимо (р<0,05) выше, чем у здоровых лиц: соответственно 0,88 (0,62; 1,25) и 0,59 (1,12; 1,3). Это позволило судить о наличии циркадного вегетативного дисбаланса, заключающегося в отсутствии существенной активации парасимпатической составляющей в ночные часы
При 2 ХМ увеличилась максимальная, средняя суточная и средняя дневная ЧСС. В то же время, минимальные и ночные значения ЧСС превышали аналогичные показатели в сравниваемых группах. В соответствии с этим ЦИ увеличился до 1,16 (1,1; 1,23), но, по-прежнему, был ниже, чем во 2-ой и контрольной группе (р<0,05). Обращало на себя внимание прогрессирующее снижение мощности спектров как ВЧ, так НЧ в дневные и ночные часы. СИВ ВЧ оставался повышенным — 0,81 (0,54; 1,29) -и свидетельствовал о сохраняющемся дисбалансе парасимпатических влияний.
Взаимосвязь локализации церебрального поражения, ритма сердца и восстановления нарушенных неврологических функций в динамике острого периода инсульта
Острое очаговое ишемическое поражение у 78 (82%) обследованных пациентов локализовалось в КС, тогда как поражение в ВБС диагностировано у 17 (18%) пациентов. У большинства больных с локализацией поражения в ВБС (76% пациентов) очаги имели малый размер, тогда как при поражении в КС величина очага чаще соответствовала среднему (51% больных), а у 16% пациентов — большому и обширному. Состояние систолической функции сердца при поражении КС по сравнению с ВБС характеризовалось большими значениями У О ЛЖ (82,5± 15,3 мл против 70,9±18,9 мл, р<0,05), ФВ ЛЖ (67,5±7,9% против 63,4±7,2%, р<0,001) и МОС (5,7±1,2 л/мин против 4,8±1,4 л/мин, р<0,001) Кроме этого, у пациентов с инсультом в ВБС чаще диагностировалось нарушение сегментарной сократимости ЛЖ, обусловленное постинфарктным кардиосклерозом.
У больных с инсультом в КС чаще регистрировались одиночные НЖЭ1 54 (15; 458) против 35 (7; 416), р>0,05. В группе больных с вертебрально-базилярным поражением наблюдалось увеличение одиночных ЖЭ (р>0,05), парных ЖЭ (р<0,05) и повышенная встречаемость брадиаритмий1 4 (24%) против 7 (9%) больных с поражением в КС (р=0,08), что, наиболее вероятно, обусловлено постинфарктным кардиосклерозом. Через 3 недели по данным 2 ХМ произошло нивелирование межгрупповых различий за счет уменьшения наджелудочковой экстрасистолии при поражении в КС и редукции числа ЖЭ и эпизодов депрессии сегмента 8Т при локализации инфаркта в ВБС.
В обеих группах при 1 ХМ (табл. 5) зарегистрировано уменьшение максимальной ЧСС и увеличение минимальной и средней ночной ЧСС по сравнению с контрольными значениями (р<0,05). Соответственно, в обеих
группах оказались редуцированными ЦИ и показатели вагусного (ВЧ) и симпатического (НЧ) воздействия.
Таблица 5. Параметры сердечного ритма в динамике острого периода
ишемического инсульта, локализующегося в каротидной системе и ВБС
Характеристика сердечного ритма 1 хм 2 ХМ
КС (п=78) ВБС (п=17) КС (п=78) ВБС (п=17)
ЧСС макс. 105 л (91,116) 103 л (97, 120) 108 (100; 120) 111,5 # (100, 124,5)
ЧСС ср 66 (60; 75) 70 (64; 74) 70 (61,77) 74 * & (67,5; 78)
ЧСС мин 51 (45; 59) 55 & (49; 60) 51 (47, 56) 55,5 * л & (50; 64,5)
ЧСС ср день 69 (62, 79) 71,5 (67; 78) 74 * (66,5; 82) 75,5 ** (70; 83)
ЧСС ср ночь 63 л& (57, 71) 65 л& (57, 74) 62,5 (55, 70) 67,5 л & (58,5, 75,5)
ЦИ 1,09 А & (1,04, 1,16) 1,09 л & (1,01; 1Д7) 1,16** (1,12, 1,24) 1,1 л& (1,06; 1,21)
ВЧ день, мс2 65 & (34; 148) 75 & (33,115) 50,5 & (31; 92) 38,5 *л& (25,5, 55,5)
ВЧ ночь, мс2 80 л & (41,182) 94 (35, 168) 68 л& (33; 133) 33 л& (18,5, 85,5)
НЧ день, мс2 211 л& (118,365) 259 (119, 392) 192,5 л& (117,377) 89,5 # л & (44,5, 296)
НЧ ночь, мс2 258 л& (149; 390) 310& (152, 853) 232 л& (123, 43 9) 150 л& (52,5, 289)
СИВ ВЧ 0,87 л (0,62, 1,23) 0,92 л (0,69, 1,43) 0,80 (0,52, 1,24) 1,06 л (0,66, 1,47)
СИВНЧ 0,88 (0,64, 1,12) 0,98 (0,63; 1,16) 0,79 (0,63, 1,28) 1,09 (0,67, 1,54)
Примечание # — р=0,08; * — р<0,05, ** — р<0,001 при сравнении с 1 ХМ, А — р<0,01 — при сравнении с контрольной группой; & — р<0,01 — при сравнении со 2 группой.
По данным 2 ХМ при поражении мозга в КС активизация больного сопровождалась физиологической реакцией ЧСС и ВСР. Локализация инфаркта мозга в ВБС, напротив, ассоциировалась с прогрессирующим дефицитом автономной регуляции в виде редукции симпатических и вагусных влияний и стойкими нарушениями циркадного индекса ЧСС
При оценке динамики неврологических нарушений у больных с каротидным поражением обнаружена статистически значимая отрицательная связь прироста баллов по Скандинавской шкале с частотой брадиаритмических эпизодов, зарегистрированных при 2 ХМ (Я = — 0,41; р=0,049), что уже ранее было отмечено при анализе данных всей группы пациентов с острым инсультом. В то же время у пациентов с инсультом в ВБС выявлена статистически значимая положительная связь прироста баллов по Скандинавской шкале с величиной ЦИ по данным 2 ХМ (И. = 0,55; р=0,026). Данная ассоциация может рассматриваться как индикатор самостоятельного негативного влияния вегетативного дисбаланса (выражающегося в утрате нормальных суточных колебаний ЧСС) на динамику неврологического восстановления. Нарушение ЦИ, сохраняющееся на протяжении острого периода инсульта, было сопряжено со снижением уровня восстановления утраченных функций, вероятно, вследствие недостаточной адаптации сердца.
Взаимосвязь величины церебрального поражения, ритма сердца и восстановления нарушенных неврологических функций в динамике острого периода инсульта
У 39 (41%) пациентов величина острого ишемического очага была малой, а у 56 (59%) больных величина соответствовала среднему, большому и обширному размерам. Для удобства последующей обработки эти пациенты были объединены в одну группу, как больные с большими очагами. В данной группе пациентов при 1 ХМ одиночные, парные и залповые НЖЭ регистрировались чаще, чем при очаговом поражении мозга малого размера, во 2-ой и контрольной группах. Настоящая тенденция сохранилась и при повторном ХМ. ЖЭ, брадиаритмии и ишемические изменения сегмента БТ в острейшем периоде в обеих группах были одинаковыми и не отличались от групп сравнения. Однако через три недели число эпизодов брадиаритмий и ишемических изменений сегмента 8Т у больных с большим по величине поражением мозга не изменилось, тогда, как в сравниваемой группе число таких эпизодов снизилось в 2 раза (р<0,05). Таким образом, при больших инфарктах мозга увеличение наджелудочковой и желудочковой эктопической активности наблюдается на протяжении всего острого периода ишемического инсульта.
В то же время, у пациентов с малыми очагами при проведении 1 ХМ зарегистрировано незначительное возрастание одиночной НЖЭ и парной
ЖЭ по сравнению с контрольной и 2-ой группой. При повторном ХМ количество аритмий стало сопоставимым с контрольными значениями
При наличии малых церебральных очагов повышение нагрузок сопровождалось адекватным учащением ЧСС и нормализацией ВСР, что было зарегистрировано при 2 ХМ. При более обширном поражении мозга адаптация сердца проходила в условиях дефицита автономной регуляции в виде редукции симпатических и вагусных влияний, нарушений циркадного ритма ЧСС и парасимпатических модуляций в течение суток. Нарушения циркадных характеристик автономного баланса в основном затрагивали парасимпатическую составляющую, что выражалось в повышении СИВ ВЧ при больших инфарктах мозга по сравнению с показателями группы больных с малыми инфарктами: соответственно 0,85 (0,53; 1,29) и 0,63 (0,46; 1,11) Значения данного коэффициента свидетельствовали об отсутствии значимого ночного вагусного превалирования при большом церебральном поражении
Изучение взаимосвязи кардиологических параметров и степени неврологического восстановления у больных с большими очагами обнаружило множественные ассоциации (табл. 6). Так, прирост баллов по Скандинавской шкале находился в обратной статистически значимой (р<0,05) зависимости от числа парных НЖЭ, залповых НЖЭ и брадиаритмий, отмеченных при 1 ХМ.
Кроме того, установлена отрицательная взаимосвязь между числом пароксизмов ФП и депрессий сегмента БТ, зарегистрированных при повторном ХМ, и постинсультным восстановлением. Таким образом, нарушения сердечного ритма при большом очаговом ишемическом поражении в условиях срыва ауторегуляции мозгового кровотока способны ухудшить церебральную перфузию и вмешаться в течение раннего постинсультного периода. ,
Также обнаружена ассоциация динамики неврологических расстройств с показателями вегетативной регуляции Чем выше и, тем самым, ближе к норме значения ЦИ, ВЧ и НЧ, тем полноценнее протекала реабилитация Подобные корреляции выявлены и с показателями СИВ ВЧ и СИВ НЧ, полученными при 2 ХМ, что свидетельствует о значении сохранности циркадных характеристик ритма ЧСС на этапе раннего постинсультного восстановления при большом ишемическом поражении. Таким образом, ЦИ и СИВ могут рассматриваться как индикаторы состояния адаптационных возможностей сердца и предикторы функционального неврологического прогноза в раннем реабилитационном периоде.
При малом поражении ни по одному кардиологическому параметру корреляций с темпами восстановления выявлено не было
Таблица 6. Взаимосвязь прироста баллов по Скандинавской шкале и кардиальиых параметров у больных со средними, большими и обширными церебральными очагами (по Gamma)_
Показатель R Достоверность (р)
Парные НЖЭ (1 ХМ) -0,31 0,01
Залповые НЖЭ (1 ХМ) -0,22 0,04
Брадиаритмии (1 ХМ) -0,47 0,03
Парные НЖЭ (2 ХМ) -0,23 0,04
Частота эпизодов ФП (2 ХМ) -0,31 0,04
Брадиаритмии (2 ХМ) -0,47 0,03
Депрессия сегмента БТ (2 ХМ) -0,72 0,02
ЦИ (2ХМ) 0,30 0,02
ВЧ день, мс2(1ХМ) 0,23 0,02
ВЧ ночь, мса(1ХМ) 0,20 0,04
НЧ день, мс2 (2 ХМ) 0,23 0,02
НЧ ночь, мс2 (2 ХМ) 0,20 0,04
СИВ ВЧ (2 ХМ) 0,20 0,04
СИВ НЧ (2 ХМ) 0,20 0,01
Влияние ХСН на состояние ритма сердца и динамику неврологических расстройств в остром периоде инсульта
Далее все пациенты были распределены в три группы в зависимости от наличия и стадии ХСН. Число пациентов без ХСН составило 30 (32%) человек ХСН I стадии также была верифицирована у 30 (32%) пациентов и характеризовалась наличием асимптомной диастолической дисфункции ЛЖ ХСН II стадии выявлена у 35 (36%) больных на основании клинических проявлений, обусловленных застойными явлениями по одному из кругов кровообращения (НА стадия) или одновременно по малому и большому кругу кровообращения (ПБ стадия). Пациенты с ХСН были старше, у них
чаще встречалась АГ. В группе ХСН II ст у 7 (20%) больных выявлена стенокардия, у 29% больных — ПИКС, у 13 (37%) пациентов -приобретенные пороки сердца При оценке характеристик церебрального поражения установлено, что у пациентов без ХСН чаще встречались АТИ и КЭИ. У пациентов с ХСН I ст. чаще регистрировали ЛИ, при ХСН II ст -КЭИиЛИ.
По данным эхокардиографии, пациенты с ХСН характеризовались увеличением размеров ЛП, толщины МЖП и ЗСЛЖ (р<0,05) по сравнению с пациентами без ХСН, а также наличием диастолической дисфункции ЛЖ и нарушением его сегментарной сократимости. Последнее различие можно объяснить преобладанием в этой группе пациентов с АГ и ПИКС.
У больных с ХСН в острейшем периоде инсульта одиночные, парные и залповые НЖЭ, пароксизмы ФП, а также ЖЭ регистрировались чаще, чем в сравниваемой группе (табл. 7). По завершении острого периода инсульта при ХСН наблюдалась небольшая положительная динамика1 уменьшилось количество одиночных, залповых НЖЭ и число пароксизмов ФП. Однако количество одиночных, парных, залповых НЖЭ и одиночных ЖЭ, по-прежнему, превосходило значения в сравниваемой группе. Более того, периоды безболевой ишемии миокарда зафиксированы только у больных с ХСН. Но в целом при ХСН количество аритмий по-прежнему оставалось выше, чем у больных без ХСН, во 2-ой и контрольной группах. При ХСН II ст. число больных с брадиаритмиями и с депрессией сегмента БТ за 3 недели осталось прежним (14% и 9% пациентов соответственно).
Зарегистрированные при 1 ХМ у пациентов с ХСН параметры сердечного ритма характеризовались увеличением минимальной ЧСС и ЧСС средней за ночь. Во всех группах больных отмечено снижение ЦИ и показателей вагусного (ВЧ) и симпатического (НЧ) воздействия. Вместе с тем спектральные характеристики в дневные и ночные часы снижались более выражено у пациентов с ХСН I и ХСН II ст. При этом СИВ ВЧ был несколько выше у пациентов с ХСН II, что свидетельствовало об отсутствии значимого вагусного ночного превалирования (рис 3).
Таблица 7. Нарушения ритма сердца в динамике острого периода ншемнческого инсульта в зависимости от наличия и стадии ХСН
Характер или количество аритмий 1 ХМ 2 ХМ
ХСН нет (п=30) ХСН1 ст. (п=30) ХСНП ст. (п=35) ХСН нет (п=30) ХСН1 ст (п=30) ХСН Пег (п=35)
Одиночные НЖЭ 31 № (9,84) 48 у (9,901) 119 лл УУ (27, 681) 17 ##&& (5,26) 26 (12; 479) 40,5 && л V (13,258,5)
Парные НЖЭ 0 ### (0,2) 1 V (0, 5) 2ЛЛ УУ (1,18) о*т (0; 1) 1 ЛУ (0,5) 2 У (0, 7,5)
Залповые НЖЭ ош (0,1) 0 V (0,2) 2м УУ» (1;8) 0 *##&& (0;0) 0У (0,3) 1&УУ (0,2)
Число пароксизмов ФП 0,5 # (0,1) 0 (0,0) 0ЛУ-(0,2) 0 (0,0) 0 (0,0) 0&&ЛУ (0,1)
Пароксизмы ФП (число больных,%) 7 (23%) 5 (17%) 14 л У-(40%) 4 (13%) 5 (17%) llлV (31%)
Одиночные ЖЭ 1**### V (0,6) 10 (2; 74) 57 лл (4,393) 1 *### (0,2) 14 л (2; 75) 16,5 л (3, 97,5)
Парные ЖЭ 0 (0;0) 0 (0,0) 0Л (0,2) 0 (0,0) 0 (0, 0) 0& СО; 0)
Залповые ЖЭ (число больных,%) 1 (3%) 1 (3%) 3 (9%) 1 (3%) 1 (3%) 2 (6%)
Частая ЖЭ (число больных, %) 3 (10%) 7 Л (23%) 9 л (26%) 0*##У 5 (17%) 6 (17%)
Брадиаритмии (число больных,%) 3 (10%) 3 (10%) 5 (14%) 1 (3%) 2 (7%) 5 (14%)
Депрессия сегмента БТ (число больных,%) 1 (3%) 1 (3%) 3 (9%) 0# 0 3 (9%) •
Примечание. * — р<0,05, ** — р<0,001 при сравнении ХСН нет с ХСН I ст.;
# — р=0,08; ## — р<0,05; ### — р<0,001 при сравнении ХСН нет с ХСН II ст;
• — р=0,08; •• — р<0,05 при сравнении ХСН I ст с ХСН II ст.;
& — р=0,07, && — р<0,05; &&& р<0,001 — по сравнению с 1ХМ; Л — р<0,05; ** — р<0,001при сравнении с контрольной группой; V — р<0,05, УУ — р<0,001при сравнении с 2 группой.
ХСНО ХСН1 ХСНН 2 группа Контроль
Рис. 3. Суточный индекс вариабельности ВЧ в динамике острого периода инсульта в зависимости от стадии ХСН
При 2 ХМ через 3 недели восстановительного лечения у пациентов без ХСН увеличились значения ЧСС максимальной, минимальной и средней дневной. У больных с ХСН I ст. возросла ЧСС максимальная, ЧСС средняя дневная и ЦИ. ЧСС средняя ночная осталась на прежнем уровне. Снизились значения как ВЧ, так и НЧ спектров в дневные и ночные часы. Также уменьшились значения СИВ ВЧ и СИВ НЧ. В свою очередь у пациентов с ХСН II ст. не произошло значимого увеличения максимальной, минимальной и средней дневной ЧСС. Показатели ЧСС средней за ночь стали еще ниже. Спектральные характеристики ВСР уменьшились в большей степени, чем аналогичные показатели у больных без ХСН и с ХСН I ст. Соответственно СИВ ВЧ (рис. 3) и СИВ НЧ увеличился, что говорит о более выраженном, стойком вегетативном дисбалансе у данной группы пациентов.
В группе больных ХСН II ст. корреляционный анализ выявил обратную связь между приростом баллов по Скандинавской шкале и брадиаритмиями как при 1 ХМ (И = -0,61, р=0,009), так и при 2 ХМ (Я= -0,68, р=0,008), Выявлена положительная связь между ЦИ при 2 ХМ (рис. 4) и приростом баллов по Скандинавской шкале (Я = 0,29, р=0,04). В группе больных без ХСН и с ХСН I ст. не обнаружено взаимосвязи между динамикой неврологических расстройств и состоянием ритма сердца.
Рис. 4. Прирост баллов по Скандинавской шкале при ХСНII ст. в зависимости от величины ЦИ ЧСС
Влияние ИБС на состояние ритма сердца и динамику неврологических расстройств в остром периоде инсульта
Далее все пациенты с ОНМК были разделены на 2 группы в зависимости от наличия ИБС. В первую группу вошли больные без ИБС (п=71). Вторую группу составили пациенты с ИБС (п=24). Пациенты обеих групп были сопоставимы по возрасту, наличию АГ и пороков сердца При ИБС чаще выявлялась ХСН II ст. Несколько чаще у больных с ИБС регистрировалось умеренное (стенозы < 70%) атеросклеротическое поражение артерий: 12 (50%) против 21 (30%) пациентов соответственно, что свидетельствовало о генерализованности атеросклеротического процесса.
При анализе эхокардиографических параметров установлено, что пациенты с ИБС по сравнению со сравниваемой группой больных и здоровыми лицами имели расширение ЛЖ, более низкую ФВ ЛЖ, у них чаще встречался локальный гипокинез ЛЖ, что можно объяснить наличием ПИКС (табл. 8). Тем не менее, объемные систолические параметры сердца у больных с ИБС соответствовали общепринятым нормативам, что не позволяет говорить о существенном нарушении глобальной сократимости ЛЖ и систолической сердечной недостаточности.
Таблица 8. Эхокардиографические параметры больных в зависимости от наличия ИБС
Эхокардиографические параметры Нет ИБС (п=71) ИБС (п=24)
Диаметр ЛП, мм 38,8±5,8 лл 39,3±4.4 **
КДО ЛЖ, мл 116,4±23,б 136,9±31,2* л
КСО ЛЖ, мл 38,0±11,0 48,5±15,6 * л
УО ЛЖ, мл 79,1±16,2 83,6± 17,7
ФВ ЛЖ, % 68,2±6,7 62,4±9,6 * л
МОС, л/мин 5,4±1,3 5,7±1,3
Толщина МЖП, мм 11,0*2,6 ** 12,1 ±2,7 ™
Толщина ЗСЛЖ, мм 10,7±2,1 лл 11 ¿±2,7™
Диастолическая дисфункция ЛЖ, Количество больных (%) 36 (51%)лл 11 (46%) **
Локальный гипо/акинез ЛЖ, Количество больных (%) 0 V 9 (38%)** **
Примечание. * — р<0,01, ** — р<0,001 при сравнении с группой без ИБС; Л — р<0,05, лл — р<0,001 при сравнении с контрольной группой; V — р<0,05, УУ — р<0,001 при сравнении с 2 группой
У больных без ИБС количество аритмий было сопоставимо с контрольными показателями. Тем не менее, число больных без ИБС, имеющих пароксизмы ФП, составило 25%, и было выше, чем в группе контроля. У больных с ИБС как при первом, так и повторном ХМ значительно чаще регистрировались все изучаемые виды наджелудочковых и желудочковых аритмий, а также — брадиаритмии и транзиторные ишемические изменения сегмента 8Т
В острейшем периоде инсульта при первом ХМ в обеих группах отмечалось снижение ЦИ (рис. 5) и повышение средней ночной ЧСС по сравнению с контрольной и 2-ой группами. Спектральные характеристики ВЧ и НЧ были ниже, чем в группах контроля и сравнения. При этом в группе ИБС это снижение было более отчетливым. СИВ ВЧ в обеих группах был выше показателей здоровых лиц (рис. 6)
□ 1 сутки ■ 21 сутки
ИБС без ИБС 2 группа Контроль
Рис. 5. Циркадиый индекс ЧСС в динамике острого периода инсульта в зависимости от наличия ИБС
При повторном ХМ у больных без ИБС произошло увеличение ЧСС максимальной, средней, средней дневной. Вырос уровень ЦИ до 1,16 (р<0,001 по сравнению с первым ХМ) (рис. 5). Показатели ВЧ и НЧ спектра имели тенденцию к уменьшению, особенно редуцировались показатели ВЧ день (р<0,05). Однако СИВ ВЧ несколько снизился и утратил статистически значимые различия с контрольным уровнем (рис. 6).
ИБС без ИБС 2 группа Контроль
Рис. 6. Суточный индекс вариабельности ВЧ в динамике острого инсульта в зависимости от наличия ИБС
У пациентов с ИБС при повторном ХМ также произошло увеличение ЧСС средней и средней дневной. ЧСС средняя ночная осталась на прежнем уровне, а ЦИ увеличился до 1,16 (р<0,05). Однако спектральные характеристики ВЧ и НЧ уменьшились особенно в ночные часы, что повлекло за собой увеличение СИВ ВЧ (рис.6).
Корреляционный анализ в группе ИБС обнаружил отрицательную связь между частотой эпизодов брадиаритмий при 2 ХМ и динамикой неврологического дефицита (табл. 9). Чем чаще регистрировались эпизоды брадиаритмии, тем хуже было неврологическое восстановление больных У больных с ИБС также установлена прямая взаимосвязь между приростом баллов по Скандинавской шкале и такими показателями как ЦИ при 2 ХМ, УО ЛЖ и МОС (рис 7, табл 9) Это свидетельствовало о том, что чем выше показатели систолической функции сердца, тем более полно происходило восстановление пациентов в острой стадии ишемического инсульта.
Таблица 9. Взаимосвязь прироста баллов по Скандинавской шкале и кардиальных параметров у больных с ИБС (по Gamma)_
Показатель R Достоверность (р)
Брадиаритмии (2 ХМ) -0,88 0,03
ЦИ (2 ХМ) 0,36 0,03
УО ЛЖ, мл 0,29 0,07
МОС, мл/мин 0,30 0,06
Рис. 7. Прирост баллов по Скандинавской шкале у больных с ИБС в зависимости от величины МОС
Таким образом, у пациентов с кардиальной патологией (ИБС, ХСН) ранний реабилитационный период проходит в условиях нарушенной автономной регуляции сердца. На основании этого можно говорить о существовании при хронической патологии сердца дефицита комплекса симпатических и парасимпатических воздействий, связанного с церебральным повреждением, что в конечном итоге негативно влияет на процесс ранней постинсультной реабилитации.
ВЫВОДЫ
1. Кардиальная патология у больных с острым ишемическим инсультом представлена, в основном, ХСН с нормальной систолической и нарушенной диастолической функцией левого желудочка, ИБС и приобретенными пороками сердца и выявляется с той же частотой, что и при хронических сосудистых поражениях головного мозга
2. В острейшем периоде ишемического инсульта увеличивается наджелудочковая и желудочковая эктопическая активность, происходит урежение максимальной и повышение средней ночной ЧСС, нарушается циркадный ритм ЧСС, уменьшаются симпатические и парасимпатические влияния на сердце, что обусловлено цереброгенным воздействием.
3 По окончании острого периода инсульта уменьшается число наджелудочковых и желудочковых экстрасистол, а также количество пароксизмов фибрилляции предсердий. Происходит увеличение максимальной, средней суточной и средней дневной ЧСС в рамках физической активизации, но сохраняется дефицит вагусных влияний на сердце.
4. Локализация ишемического очага в ВБС ассоциируется с транзиторным увеличением брадиаритмий в остром периоде инсульта и стойкими нарушениями вегетативной регуляции сердца. Наличие большого ишемического поражения сопровождается повышенной наджелудочковой и желудочковой эктопической активностью и нарушением парасимпатического звена вегетативных влияний на сердце.
5. У пациентов с симптомной ХСН и коронарной патологией на протяжении всего острого периода инсульта регистрируется повышенная наджелудочковая и желудочковая эктопическая активность, эпизоды брадиаритмий и безболевой ишемии миокарда, а также сохраняется стойкий вегетативный дисбаланс.
6 У всех больных в острой стадии ишемического инсульта выявлена отрицательная связь между степенью неврологического восстановления, числом брадиаритмических эпизодов и ишемических эпизодов сегмента БТ, а при больших инфарктах мозга — и с частотой наджелудочковой экстрасистолии и пароксизмов фибрилляции предсердий Положительная связь между степенью сохранности автономной регуляции сердца и неврологическим восстановлением отмечается при локализации инфаркта мозга в ВБС, у больных с большими очагами, при симптомной ХСН и при коронарной патологии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Больным с ишемическим инсультом показано кардиологическое обследование для своевременного выявления ХСН и ИБС, наличие которых необходимо учитывать при ведении больного в острой фазе заболевания и при планировании реабилитационных мероприятий
2. При больших инфарктах мозга, коронарной патологии и симптомной ХСН в остром периоде ишемического инсульта необходимо быть нацеленным на проведение антиаритмической и антиангинальной терапии. При этом нужно с осторожностью использовать препараты, вызывающие урежение ЧСС и угнетающие функцию синусового узла.
3. С целью оптимизации двигательной реабилитации больным с острыми нарушениями мозгового кровообращения в ВБС и с коронарной патологией рекомендуется проведение ХМ для выявления скрытых нарушений ритма и проводимости сердца, а также безболевой ишемии миокарда.
4. У больных с инсультом в ВБС имеется выраженный вегетативный дисбаланс, ассоциирующийся со снижением адаптационных возможностей сердечно-сосудистой системы, что необходимо учитывать при проведении реабилитационных мероприятий.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Нарушения ритма сердца у больных с ишемическим инсультом и хронической сердечной недостаточностью (Соавт.: Фонякин А В., Гераскина Л А.). Материалы VI ежегодной конференции общества специалистов по сердечной недостаточности 2005: с. 74
2. Нарушения сердечного ритма, ишемическая болезнь сердца и течение раннего постинсультного периода (Соавт.: Фонякин A.B., Гераскина JI.A.). Вестник аритмологии 2006,43: 43-47.
3. Особенности адаптации сердца при стабильной коронарной патологии в раннем реабилитационном периоде ишемического инсульта (Соавт: Фонякин А.В , Гераскина JI А. Самохвалова Е В.). Вестник аритмологии 2006; приложение Б с. 83
4. Кардиологические аспекты ранней постинсультной реабилитации (Соавт.. Фонякин AB , Гераскина JI.A.) Практическая ангиология (Киев) 2006, 3: 60-65.
5. Особенности ритма сердца при коронарной патологии в динамике острого периода ишемического инсульта (Соавт • Фонякин A.B., Гераскина JI.A.). Сосудистые заболевания головного мозга (Киев) 2006; 4. 34-38.
6. Электрофизиологические характеристики сердца в остром периоде ишемического инсульта (Соавт.. Фонякин A.B., Гераскина Л А.). Материалы Первого национального конгресса «Инсульт и сосудисто-мозговые заболевания». Киев, 2006:27-28.
7. Подходы к прогнозированию кардиальных осложнений в постинсультном периоде (Соавт Фонякин А В , Гераскина Л.А., Самохвалова Е.В.). Там же- 70-71
8. Влияние локализации поражения мозга на состояние ритма сердца в остром периоде ишемического инсульта (Соавт.: Фонякин A.B., Гераскина Л А.). Кардиоваскулярная терапия и профилактика 2006; 6 (приложение): 399- 400
9 Состояние ритма сердца на этапе ранней постинсультной реабилитации в зависимости от размера поражения мозга (Соавт.: Фонякин A.B., Гераскина Л.А). Кардиоваскулярная терапия и профилактика 2006; 6 (приложение): 400.
10. Состояние автономной регуляции сердца в раннем реабилитационном периоде ишемического инсульта. Трунова (Соавт • Фонякин А.В, Гераскина Л.А., Самохвалова Е.В). Материалы IV Всероссийской конференции по профилактической кардиологии. Тюмень 2006. 76-77.
11.Нарушение ритма сердца у больных ишемическим инсультом в зависимости от размера очагового поражения мозга (Соавт.: Фонякин А.В , Гераскина Л.А., Самохвалова Е.В.) Там же: 82-83.
12 Течение раннего реабилитационного периода у больных ишемическим инсультом и хронической сердечной недостаточностью (Соавт.: Фонякин A.B., Гераскина Л А.) Сердце 2006,6 301-304.
13. Влияние кардиальной патологии на изменения циркадного индекса частоты сердечных сокращений (ЧСС) в остром периоде ишемического инсульта (Соавт.- Фонякин A.B., Гераскина JI.A, Самохвалова Е В.). Функциональная диагностика 2007; 1: 41-42.
14. Изменения циркадного индекса частоты сердечных сокращений (ЧСС) в остром периоде ишемического инсульта в зависимости от особенностей очагового церебрального поражения (Соавт.: Фонякин А В., Гераскина JI А., Самохвалова Е В.) Функциональная диагностика 2007; 1′ 42.
15. Состояние сердца и восстановление нарушенных неврологических функций у больных в раннем постинсультном периоде (Соавт.: Фонякин AB., Гераскина Л.А.) Сосудистые заболевания головного мозга (Киев) 2007, 3 10-15
16. Факторы риска кардиальных осложнений при ишемическом инсульте. (Соавт.. Фонякин AB, Гераскина Л А, Самохвалова Е.В) Неврологический вестник 2007; выпуск 1 (приложение к журналу). С 227-228.
17. Состояние сердца и течение острого периода ишемического инсульта. (Соавт. Фонякин А В., Гераскина Л А., Самохвалова Е В.). Клиническая фармакология и терапия 2007; 5: 55-58
18 Хроническая сердечная недостаточность, кардиальные аритмии и течение раннего постинсультного периода (Соавт.: Фонякин AB., Гераскина Л А.). Материалы II конгресса общества специалистов по сердечной недостаточности «Сердечная недостаточность, 2007». Москва 2007. 75.
19. Особенности адаптации сердца при хронической сердечной недостаточности в остром периоде ишемического инсульта (Соавт.: Фонякин А В , Гераскина Л.А., Самохвалова Е В.). Там же: 76-77.
УСЛОВНЫЕ СОКРАЩЕНИЯ
АГ Артериальная гипертония
АТИ Атеротромботический инсульт
ВБС Вертебрально-базилярная система
ВСР Вариабельность сердечного ритма
ВЧ Высокие частоты
ГДИ Гемодинамический инсульт
глж Гипертрофия левого желудочка
жэ Желудочковая экстрасистолия
зслж Задняя стенка левого желудочка
ИБС Ишемическая болезнь сердца
КДО Конечный диастолический объем
КС Каротидная система
КСО Конечный систолический объем
КТ Компьютерная томография
кэи Кардиоэмболический инсульт
лж Левый желудочек
ли Лакунарный инсульт
лп Левое предсердие
МАГ Магистральные артерии головы
мжп Межжелудочковая перегородка
мое Минутный объем сердца
МРТ Магнитно-резонансная томография
нжэ Наджелудочковая экстрасистола
нч Низкие частоты
онмк Острое нарушение мозгового кровообращения
пике Постинфарктный кардиосклероз
СА Синоаурикулярная блокада
СИВ Суточный индекс вариабельности
УО Ударный объем
ФВ Фракция выброса
ФП Фибрилляция предсердий
хм Холтеровское мониторирование
хен Хроническая сердечная недостаточность
ци Циркадный индекс
чсс Число сердечных сокращений
ЭКГ Электрокардиография
Подписано в печать 16 04 2008 г
Формат 60/84 1×16 Бумага офсетная Печать офсетная Уел п л 1 5 Тираж 100 экз Заказ №П-197
Типография «Телер» 127299, Москва, ул Космонавта Волкова, 12 Тел (495) 937-8664,156-4084
Ишемическая болезнь: виды, симптомы, лечение, осложнения
Ишемия или ишемическая болезнь – это снижение или прекращение кровоснабжения (циркуляции крови) в органах, возникновение «кислородного голода» – гипоксии в них.
Причина ишемической болезни связана сосудистыми факторами: атеросклеротическим поражением сосудов, сужением, закупоркой просвета артерий, сдавливанием сосудов из вне. Если сердце, кишечник, мозг, почки или другие органы встречаются с этой проблемой, то такие обстоятельства приводят к дисфункции временного характера или хроническому повреждению органа либо его отдельных тканей: например, мышечной ткани сердечного типа, почечной ткани.
К закупорке, сужению сосудов, а затем и развитии ишемической болезни могут привести нарушения липидного обмена, тромбоз, заболевания крови, травмы, спазмы сосудов, регулярно повышенное артериальное давление, нарушения уровня глюкозы в крови, избыточная масса тела, терминальная почечная недостаточность, когда фильтрационная способность почек падает до своего минимума, а также наследственная предрасположенность: например, среди причин ишемии кишечника – наследственная микросфероцитарная (гемолитическая) анемия.
К сдавливанию вен, артерий извне могут привести травмы, спаечный процесс, новообразования, увеличенные лимфатические узлы.
Классификация
В зависимости от того, какой орган затронут, выделяют следующие виды ишемий:
- Ишемия головного мозга.
- Ишемия кишечника.
- Ишемия нижних и верхних конечностей.
- Ишемическая болезнь сердца (ИБС).
- Ишемия почек.
По клиническим проявлениям при этом выделяются различные виды ишемий:
- Стенокардия (стабильная стенокардия напряжения, нестабильная стенокардия, вазоспастическая стенокардия, постинфарктная стенокардия). В немедицинской среде эта патология сердца часто известна как «грудная жаба».
- Инфаркт миокарда (гибель сердечной мышцы). Бывает крупноочаговым и мелкоочаговым.
- Коронарный синдром, объединяющий нестабильную стенокардию и инфаркт миокарда. Один из самых опасных видов ишемий.
- Торпидная (вялотекущая форма) почечной нефропатии.
- Инфаркт почек (острая нефропатия).
- Быстропрогрессирующая нефропатия (инфаркт почек + почечная недостаточность).
- Ишемический инсульт (инфаркт мозга).
- Ишемическая гипоксия мозга (как правило возникает при черепномозговых травмах).
- Церебральная ишемия новорождённых.
- Периферическая артериальная болезнь нижних конечностей.
- Болезнь Рейно. Нарушение притока крови к кистям, пальцам.
- Мезентериальная ишемия кишечника (блокада кровотока сосудов кишечника).
- Ишемия толстой кишки (ишемическая колопатия, язвенный ишемический колит).
Формы ишемической болезни (острая и хроническая)
Острая ишемическая болезнь сопряжена с блокадами артериального кровотока. Возникает при быстрой закупорке сосудов (как правило, крупных). Развивается очень стремительно, поэтому другие сосуды элементарно не успевают подключиться к кровоснабжению. Самые известные острые формы – инфаркт сердца, инсульт.
Хронические формы – патологии, развивающиеся постепенно. Чаще всего болезнь развивается из –за постоянного сдавливания сосудов, разрастания атеросклеротических бляшек. Компенсировать проблему при этом активно пытаются вспомогательные сосуды. Они помогают снабжать органы кислородом, но нагрузка на них самих возрастает, работоспособность органов уменьшается, появляются ряд неприятных симптомов. Так, например, хроническая ишемическая болезнь сердца чревата развитием сердечной недостаточности, мерцательной аритмии, а хроническая ишемия мозга негативно работает на мыслительные процессы, чревата ухудшением памяти.
Симптоматика
- Для ИБС характерны следующие симптомы: одышка (в тяжёлых формах – и в движении, и в спокойном положении, при развивающихся, хронических формах – в движении), учащённое сердцебиение, сбои в ритме сердца, «скачки» артериального давления, боли за грудиной, боль в области сердца.
- Для патологий мозга характерно ухудшение мозговой активности, а вместе с тем, запоминания, концентрации внимания, появление раздражительности, проблемы со сном (при хронических формах), спутанность сознания, падение зрения, нарушения чувствительности рук и ног, рвота, тошнота (при острых формах).
- При ишемических патологиях кишечника появляется боль в области пупка, верхней части живота, понос, кишечное кровотечение, вздутие живота, тахикардия, напряжение брюшины, падение артериального давления, понос, рвота.
- Среди симптомов ишемии почек – частые ночные позывы к мочеиспусканию, сильные отеки лица, ног, рук, слабость, быстрая утомляемость, запах аммиака изо рта.
- Симптомами ишемической болезни конечностей являются перемежающаяся хромота, чувство онемения рук и ног, ощущение что руки и (или ноги) постоянно мёрзнут, язвы на голени. Также пациенты часто замечают, что медленней начинают расти ногти.
Очень часто (особенно при хроническом течении заболеваний, особенно патологиях почек) долгое время симптоматика очень «размазана». Заболевание без проведения комплексной диагностики легко спутать с другим. У некоторых пациентов симптомы затрагивают только один орган, у некоторых же проблема более обширная, и есть проблемы одновременно с сердцем, кишечником, почками.
Ишемия головного мозга
Ишемия головного мозга (дисциркуляторная энцефалопатия, цереброваскулярная недостаточность) – патология, развивающаяся из-за недостатка притока крови к мозгу. Особенно страдает сонная артерия, роль которой – обеспечение кровью большинства участков мозга.
Нарушение кровотока приводит к повреждению нервной ткани. Если нервные клетки гибнут, случается инсульт.
Механизм развития заболевания у разных людей неодинаков, кто-то сразу сталкивается с острой формой болезни, кто-то с хронической формой патологии. Много е зависит от конкретной сосудистой сети. У одних людей блокированные сосуды компенсируют соседние, в том числе более мелкие, у других такая компенсация не происходит. Также усилить скорость гибели клеток могут неврозы, аллергические реакции, новообразования, инфекции.
Ишемия кишечника
Под ишемией кишечника подразумевают целую группу заболеваний, которые вызваны как хроническими, так и острыми процессами. Но все патологии объединены общим фактором. Это снижение притока крови к желудочно-кишечному тракту и непосредственно к кишечнику.
Большую опасность представляет мезентральная эмболическая ишемия. Она наступает внезапно. Для нее характерен «острый живот». Симптоматику без привлечения комплексных средств диагностики моно спутать с симптомами острого панкреатита, аппендицита, прободной язвы. Но природа этой патологии иная – резкое образование непроходимости (окклюзия) в сосуде брызжейки – ткани, которая участвует в креплении к брюшной стенки самого кишечника. Это может быть ответной реакцией на инфекцию, травму, заболевания крови, портальную гипертензию – повышение давления в воротной вене, приём некоторых препаратов (например, противозачаточных средств). Если оперативно не диагностировать патологию и не принять меры, стенки кишечника могут начать некрозировать (отмирать).
Ещё одна разновидность патологии – ишемия, следующая мезентральным тромбозом (тромбозом брыжеечных сосудов). Характеризуется болями интенсивного, схваткообразного характера. При первичном осмотре симптоматика схожа с кишечной коликой, кишечной непроходимостью. Но опять-таки от скорости диагностики зависит дальнейший прогноз. Как правило, проблема решается диагностикой и резекций. Если их не сделать вовремя, летальный исход вероятен в 70-90% случаев.
Но самым распространённым вариантом является ишемия толстой кишки, развивающаяся на фоне атеросклероза сосудов, расслоения аорты или наличия аневризмы. Заболевание сопровождается сильным истощением. У 80% наблюдается потеря массы тела.
Ишемия конечностей
Редко возникает сама по себе. Чаще – проявление облитерирующего атеросклероза. Отложение на стенках сосудов ЛПНП («плохого» холестерина), атеросклеротические бляшки провоцируют перекрытие, сужение артерий. Кровь не может полноценно двигаться по рукам и ногам.
На начальных стадиях речь идёт сугубо о дискомфорте (руки и ноги постоянно мёрзнут). Потом «подключаются» трещины на коже, трофические язвы. При запущенной болезни высок риск некроза, гангрены.
Существенный прорыв в диагностике заболевания начался с широким применением дуплексного сканирования вен, артерий. Своевременная диагностика позволяет как можно раньше начать лечение, обойтись без ампутации ног, рук.
Ишемия сердца (ИБС)
ИБС представляет собой острое или хроническое нарушение кровоснабжения мышечных тканей сердца – миокарда. Механизм ИБС запускается, когда коронарные артерии поражены, артериальная кровь не имеет возможности поступать к сердцу или идёт туда в ограниченном количестве.
ИБС – один из главных факторов смертности на ИБС приходится 30% всех смертельных случаев в мире. В том числе, нередка внезапная коронарная смерть (внезапная остановка сердца)
Чаще ИБС болеют лица в возрасте 40–65 лет. Мужчины болеют ИБС чаще чем женщины.
В наибольшей группе риска – злоупотребляющие курением (из-за постоянного сужения сосудов), жирной пищей (выше риск образования бляшек), лица с высоким уровнем ЛПНП («плохого» холестерина) – сужающего просвет в сосудах. Также опасны постоянные переживания, стрессы (как и курение, способны вызывать сужения сосудов).
Но с развитием диагностики и методов лечения количество летальных исходов уменьшается, продолжительность жизни у хронических больных увеличивается, качество жизни улучшается.
Благодаря современному функциональному диагностическому оборудованию, развитию лабораторной диагностики на ранних этапах удаётся выявить даже бессимптомные формы ИБС.
Диагностика ишемической болезни
Основные диагностические мероприятия направлены на обследование непосредственно сосудов того или иного органа. Проводится аускультация сосудов стетоскопом (на предмет обнаружения шумов), ультразвуковая допплерография (УЗДГ) артерий и вен, КТ обследуемого участка, УЗИ, в том числе, брахиоцефальных артерий (главных артерий головного мозга). Современные методы позволяют не просто изучит и обнаружить просвет сосудов, но и исследовать его стенки.
Немаловажное значение имеет лабораторная диагностика: общий анализ крови, гемостазиограмма, биохимическое исследование крови: особенно важен липидный спектр, мочевина, креатинин, общий белок, обмен электролитов (калий, натрий хлор).
При подозрении на поражения почек актуальны расширенные анализы мочи: общий анализ мочи по Нечипоренко, проба Реберга для определения скорости клубочковой фильтрации, проба Зимницкого для анализа концентрационной и выделительной способности почек.
При диагностике конечностей огромное значение играет расчет лодыжечно-плечевого индекса (важно не упустить разницу АД на голени и на плече).
При ИБС, ишемическом инсульте назначают Холтер-ЭКГ, проблемах с сосудами мозга – электроэнцефалографию.
Лечение ишемической болезни
Для лечения используют медикаментозные и хирургические методы. Среди медицинских препаратов важная роль принадлежит лекарствами, которые нормализуют и поддерживают артериальное давление. Это важно вне зависимости от того, что в зоне внимания – сердце, почки или сосуды ног.
Среди активно применяемых препаратов при ишемиях разных типов – и лекарства, позволяющие быстро расширить сосуды. Именно к ним относится, к примеру, всем известный нитроглицерин – незаменимый помощник во время приступов при ИБС.
Если причина – тромбоз, обязательно используются препараты, направленные на уменьшение вязкости крови.
Что касается хирургического вмешательства, то тут всё зависит от патологии конкретного органа.
При ИБС проводят аорто-коронарное шунтирование (установку протезов для обхода места сужения коронарного сосуда), реваскуляризацию миокарда (фактически разновидность шунтирования на работающем сердце), стентирование коронарных артерий – установку специальных стентов. Это может быть рассасывающийся баллон, металлический стент, лекарственный стент. Задача любого из них – предотвращение повторного сужения просвета сосуда – стеноза.
При ишемии мозга кровоток в сосудах хирургическим путём чаще всего также восстанавливают методом шунтирования. Операция позволяет перенаправить кровь, «обвести» его вокруг закупорки, сохранить или восстановить кровоснабжение мозга.
При ишемических патологиях почек, кишечника в качестве хирургического способа решения проблемы прибегают к резекции. Наиболее щадящая для организма – лапороскопическая резекция.
Немаловажное значение имеет и физиотерапия, ЛФК, в том числе занятия на велотеренажёрах, гипобарическая оксигинация в барокамерах. Особенно роль оксигинации в барокамерах важна при реабилитация после ишемического инсульта.
Осложнение
Ишемия кишечника чревата образованием стриктур (сужений участков кишечника). А у ряда пациентов может появиться синдром короткой кишки, в результате и страх перед приемом пищи.
Самый серьёзный риск при ишемии почек – полное перекрытие сосудов и блокировка сосудов. Главная опасность – прекращение выведения из организма продуктов жизнедеятельности. В результате возникает полная почечная недостаточность, что чревато летальным исходом.
Серьёзные последствия, осложнения вероятны при несвоевременно взятой под врачебный контроль ишемической болезни мозга. Поражение мозговых тканей чревато ограничением двигательной активности (вплоть до паралича), утерей умственных способностей, утратой дееспособности и инвалидность.
Эффективно снизить риск осложнений помогает комплексная реабилитация. Например, на базе 5 больницы доступна специальная программа «Реабилитация после ишемического инсульта». Курс на две недели включает консультации, комплексное обследование, индивидуальную ЛФК, физиолечение, медикаментозную терапию, массаж, иглорефлексотерапию.
Прогнозы
Несмотря на то, что ишемия – очень серьёзное заболевание, своевременная медицина позволяет сделать всё, чтобы прогноз наиболее благоприятным.
Чем раньше пациенту будет поставлен точный диагноз, выбрана схема лечения (медикаментозная, хирургическая), тем выше вероятность успешного результата.
Даже при сложнейших патологиях мозга при своевременной помощи удаётся сохранить максимальное количество нервных клеток, а значит сохранить или восстановить функции организма.
Огромное значение имеет то, как в процессе лечения (особенно после операции) налажен уход за пациентом. Важное значение имеет обеспечение пациенту правильного положения тела, схемы питания, уход за катетерами. Существенно ускорить восстановление помогает массаж.
В 5-й больнице работает опытная команда специалистов: в том числе, неврологи, нейрохирурги, хирурги, кардиологи. Клинико-диагностическая лаборатория, отделение РК и МРТ, отделение клинической и функциональной диагностики оснащены качественным оборудованием, с помощью которого можно оперативно произвести высокоточные исследования. Здесь вам окажут компетентную помощь при ишемической болезни сердца, головного мозга сосудов. Доступны лечебные и реабилитационные программы как для граждан Республики Беларусь, так и иностранных граждан. У врачей 5-й больницы – большой опыт работы лечения пациентов из Москвы и других городов России.
Связь между инсультом и болезнями сердца
Болезни сердца и инсульт имеют много общего. Они возникают из-за проблем с кровеносными сосудами (в сердце или головном мозге) и связаны по своей распространенности, поскольку относятся к ведущим причинам смерти во всем мире, и по длинному списку предотвратимых причин.
Оба типа заболеваний обусловлены сердечно-сосудистыми нарушениями
Сердечно-сосудистые заболевания (ССЗ) — это заболевания сердца и кровеносных сосудов, которые включают ишемическую болезнь сердца, цереброваскулярные болезни, ревматические болезни сердца и другие состояния. Четыре из пяти случаев смерти от ССЗ связаны с сердечными приступами или инсультами. Инсульт возникает, когда кровеносные сосуды ослабевают или сужаются, что может вызвать образование тромбов и прервать приток крови к мозгу (1).
Оба типа заболеваний являются ведущими причинами смерти в мире
Ежегодно от ССЗ умирают 17,7 млн человек, что составляет приблизительно 31% от числа всех случаев смерти в мире. Бремя сердечно-сосудистых заболеваний и инсульта — с учетом потерянных лет жизни, снижения качества жизни, а также прямых и непрямых медицинских расходов — также остается огромным (1).
В 2015 году только прямые расходы на здравоохранение в ЕС составили около 20 млрд. евро, в то время как непрямые расходы, такие как уход, осуществляемый членами семьи или друзьями, и потеря производительности в результате смерти, по оценкам, составили еще 25 млрд. евро (2).
Оба типа заболеваний распространены в странах с низким и средним уровнем дохода
На риск развития болезней сердца и инсульта также, очевидно, влияет, в какой стране Вы живете. За последние десять лет мы наблюдали сдвиг в числе случаев заболеваний в странах с низким и средним уровнем дохода, где эти болезни стали серьезной проблемой здравоохранения, и в настоящее время составляют половину общего бремени болезней (3).
У этих заболеваний общий список факторов риска
Некоторые заболевания можно предотвратить, если принимать антитромботические (антикоагулянтные или антитромбоцитарные) средства, и устранить, или по крайней мере уменьшить поддающиеся исправлению факторы – прекратить курить курения или ограничить воздействие табачного дыма; придерживаться здорового питания и веса тела; поддерживать физическую активность; следовать медицинским рекомендациям в отношении контроля других состояний, например, принимать назначенные антидиабетические лекарства; а также рано выявлять и начинать лечение любых заболеваний сердца или головного мозга (2, 3).
Литература:
- https://www.who.int/cardiovascular_diseases/en/
- https://www.strokeeurope.eu/downloads/TheBurdenOfStrokeInEuropeReport.pdf
- Kathleen Strong, Colin Mathers, Ruth Bonita, Lancet Neurol 2007; 6: 187-87 Preventing stroke: saving lives around the world.
Этиология криптогенного инсульта | Рамазанов
1. Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24(1):35–41. PMID: 7678184 https://doi.org/10.1161/01.str.24.1.35
2. Putaala J, Nieminen T, Haapaniemi E, Meretoja A, Rantanen K, Heikkinen N, et al. Undetermined stroke with an embolic pattern — a common phenotype with high early recurrence risk. Ann Med. 2015;47(5):406–413. PMID: 262242000 https://doi.org/10.3109/07853890.2015.1057612
3. Li L, Yiin GS, Geraghty OC, Schulz UG, Kuker W, Mehta Z, et al. Incidence, outcome, risk factors, and long-term prognosis of cryptogenic transient ischaemic attack and ischaemic stroke: a population-based study. Lancet Neurol. 2015;14(9):903–913. PMID: 26227434 https://doi.org/10.1016/S1474-4422(15)00132-5
4. Putaala J, Metso AJ, Metso TM, Konkola N, Kraemer Y, Haapaniemi E, et al. Analysis of 1008 consecutive patients aged 15 to 49 with first-ever ischemic stroke: the Helsinki young stroke registry. Stroke. 2009;40(4):1195–1203. PMID: 19246709 https://doi.org/10.1161/STROKEAHA.108.529883
5. Foulkes MA, Wolf PA, Price TR, Mohr JP, Hier DB. Stroke Data Bank: design, methods, and baseline characteristics. Stroke. 1988;19(5):547– 554. PMID: 3363589 https://doi.org/10.1161/01.str.19.5.547
6. Kunitz SC, Gross CR, Heyman A, Kase CS, Mohr JP, Price TR, et al. The pilot Stroke Data Bank: definition, design, and data. Stroke. 1984;15(4):740–746. PMID: 6464070 https://doi.org/10.1161/01.str.15.4.740
7. Perera KS, Vanassche T, Bosch J, Swaminathan B, Mundl H, Giruparajah M, et al. Global Survey of the Frequency of Atrial Fibrillation-Associated Stroke: Embolic Stroke of Undetermined Source Global Registry. Stroke. 2016;47(9):2197–2202. PMID: 27507860 https://doi.org/10.1161/STROKEAHA.116.013378
8. Bal S, Patel SK, Almekhlafi M, Modi J, Demchuk AM, Coutts SB. High Rate of Magnetic Resonance Imaging Stroke Recurrence in Cryptogenic Transient Ischemic Attack and Minor Stroke Patients. Stroke. 2012;43(12):3387–3388. PMID: 23033345 https://doi.org/10.1161/STROKEAHA.112.671172
9. Bang OY, Lee PH, Joo SY, Lee JS, Joo IS, Huh K. Frequency and mechanisms of stroke recurrence after cryptogenic stroke. Ann Neurol. 2003;54(2):227–234. PMID: 12891675 https://doi.org/10.1002/ana.10644
10. Ntaios G, Papavasileiou V, Milionis H, Makaritsis K, Vemmou A, Koroboki E, et al. Embolic Strokes of Undetermined Source in the Athens Stroke Registry: An Outcome Analysis. Stroke. 2015;46(8):2087–2093. PMID: 26159795 https://doi.org/10.1161/STROKEAHA.115.009334
11. Choe WC, Passman RS, Brachmann J, Morillo CA, Sanna T, Bernstein RA, et al. A Comparison of Atrial Fibrillation Monitoring Strategies After Cryptogenic Stroke (from the Cryptogenic Stroke and Underlying AF Trial). Am J Cardiol. 2015;116(6):889–893. PMID: 26183793 https://doi.org/10.1016/j.amjcard.2015.06.012
12. Ridker PM, Hennekens CH, Miletich JP. G20210A mutation in prothrombin gene and risk of myocardial infarction, stroke, and venous thrombosis in a large cohort of US men. Circulation. 1999; 99(9): 999– 1004. PMID: 10051291 https://doi.org/10.1161/01.cir.99.8.999
13. Rojo-Martinez E, Sandín-Fuentes M, Calleja-Sanz AI, Cortijo-García E, García-Bermejo P, Ruiz-Piñero M, et al. High performance of an implantable Holter monitor in the detection of concealed paroxysmal atrial fibrillation in patients with cryptogenic stroke and a suspected embolic mechanism. Rev Neurol. 2013;57(6):251–257. PMID: 24008935
14. Sanna T, Diener HC, Passman RS, Di Lazzaro V, Bernstein RA, Morillo CA, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med. 2014;370(26):2478–2486. PMID: 24963567 https://doi.org/10.1056/NEJMoa1313600
15. Gladstone DJ, Spring M, Dorian P, Panzov V, Thorpe KE, Hall J, et al. Atrial Fibrillation in Patients with Cryptogenic Stroke. N Engl J Med. 2014;370(26):2467–2477. PMID: 24963566 https://doi.org/10.1056/NEJMoa1311376
16. Lethen H, Flachskampf FA, Schneider R, Sliwka U, Köhn G, Noth J, et al. Frequency of deep vein thrombosis in patients with patent foramen ovale and ischemic stroke or transient ischemic attack. Am J Cardiol. 1997;80(8):1066–1069. PMID: 9352979 https://doi.org/10.1016/s00029149(97)00604-8
17. Kamel H, Elkind MS, Bhave PD, Navi BB, Okin PM, Iadecola C, et al. Paroxysmal supraventricular tachycardia and the risk of ischemic stroke. Stroke. 2013;44(6):1550–1554. PMID: 23632982 https://doi.org/10.1161/STROKEAHA.113.001118
18. Tanne D, D’Olhaberriague L, Trivedi AM, Salowich-Palm L, Schultz LR, Levine SR. Anticardiolipin antibodies and mortality in patients with ischemic stroke: a prospective follow-up study. Neuroepidemiology. 2002;21(2):93–99. PMID: 11901279 https://doi.org/10.1159/000048623
19. Brambatti M, Connolly SJ, Gold MR, Morillo CA, Capucci A, Muto C, et al. Temporal relationship between subclinical atrial fibrillation and embolic events. Circulation. 2014;129(21):2094–2099. PMID: 24633881 https://doi.org/10.1161/CIRCULATIONAHA.113.007825
20. Glotzer TV, Daoud EG, Wyse DG, Singer DE, Ezekowitz MD, Hilker C, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the trends study. Circ Arrhythm Electrophysiol. 2009;2(5):474–480. PMID: 19843914 https://doi.org/10.1161/CIRCEP.109.849638
21. Keach JW, Bradley SM, Turakhia MP, Maddox TM. Early detection of occult atrial fibrillation and stroke prevention. Heart. 2015;101(14):1097– 1102. PMID: 25935765 https://doi.org/10.1136/heartjnl-2015-307588
22. Bernstein RA, Di Lazzaro V, Rymer MM, Passman RS, Brachmann J, Morillo CA, et al. Infarct topography and detection of atrial fibrillation in cryptogenic stroke: results from CRYSTAL AF. Cerebrovasc Dis. 2015;40(12):91–96. PMID: 26182860 https://doi.org/10.1159/000437018
23. Favilla CG, Ingala E, Jara J, Fessler E, Cucchiara B, Messé SR, et al. Predictors of finding occult atrial fibrillation after cryptogenic stroke. Stroke. 2015;46(5):1210–1215. PMID:25851771 https://doi.org/10.1161/STROKEAHA.114.007763
24. Miller DJ, Khan MA, Schultz LR, Simpson JR, Katramados AM, Russman AN, et al. Outpatient cardiac telemetry detects a high rate of atrial fibrillation in cryptogenic stroke. J Neurol Sci. 2013;324(1–2):57–61. PMID: 23102659 https://doi.org/10.1016/j.jns.2012.10.001
25. Kamel H, Soliman EZ, Heckbert SR, Kronmal RA, Longstreth WT Jr, Nazarian S, et al. P-wave morphology and the risk of incident ischemic stroke in the Multi-Ethnic Study of Atherosclerosis. Stroke. 2014;45(9):2786–2788 PMID: 25052322 https://doi.org/10.1161/STROKEAHA.114.006364
26. Yaghi S, Moon YP, Mora-McLaughlin C, Willey JZ, Cheung K, Di Tullio MR, et al. Left atrial enlargement and stroke recurrence: the Northern Manhattan Stroke Study. Stroke. 2015;46(6):1488–1493 PMID: 25908460 https://doi.org/10.1161/STROKEAHA.115.008711
27. Yaghi S, Boehme AK, Hazan R, Hod EA, Canaan A, Andrews HF, et al. Atrial cardiopathy and cryptogenic stroke: a cross-sectional pilot study. J Stroke Cerebrovasc Dis. 2015;25(1):110–114. PMID: 26476588 https://doi.org/10.1016/j.jstrokecerebrovasdis.2015.09.001
28. Sinner MF, Stepas KA, Moser CB, Krijthe BP, Aspelund T, Sotoodehnia N, et al. B-type natriuretic peptide and C-reactive protein in the prediction of atrial fibrillation risk: the CHARGE-AF consortium of community-based cohort studies. Europace. 2014;16(10):1426–1433. PMID: 25037055 https://doi.org/10.1093/europace/euu175
29. Llombart V, Antolin-Fontes A, Bustamante A, Giralt D, Rost NS, Furie K, et al. B-type natriuretic peptides help in cardioembolic stroke diagnosis: pooled data meta-analysis. Stroke. 2015;46(5):1187–1189. PMID: 25765726 https://doi.org/10.1161/STROKEAHA.114.008311
30. Yaghi S, Elkind MS. Cryptogenic stroke: a diagnostic challenge. Neurol Clin Pract. 2014;4(5):386–393. PMID: 25317376 https://doi.org/10.1212/CPJ.0000000000000086
31. De Bruijn SF, Agema WR, Lammers GJ, van der Wall EE, Wolterbeek R, Holman ER, et al. Transesophageal echocardiography is superior to transthoracic echocardiography in management of patients of any age with transient ischemic attack or stroke. Stroke. 2006;37(10):2531–2534. PMID: 16946152 https://doi.org/10.1161/01.STR.0000241064.46659.69
32. Srichai MB, Junor C, Rodriguez LL, Stillman AE, Grimm RA, Lieber ML, et al. Clinical, imaging, and pathological characteristics of left ventricular thrombus: a comparison of contrast-enhanced magnetic resonance imaging, transthoracic echocardiography, and transesophageal echocardiography with surgical or pathological validation. Am Heart J. 2006;152(1):75–84. PMID: 16824834 https://doi.org/10.1016/j.ahj.2005.08.021
33. Barkhausen J, Hunold P, Eggebrecht H, Schüler WO, Sabin GV, Erbel R, et al. Detection and characterization of intracardiac thrombi on MR imaging. AJR Am J Roentgenol. 2002;179(6):1539–1544. PMID: 12438051 https://doi.org/10.2214/ajr.179.6.1791539
34. Bahrer A, Mowla A, Kodali S, Polsani VR, Nabi F, Nagueh SF, et al. Cardiac MRI improves identification of etiology of acute ischemic stroke. Cerebrovasc Dis. 2014;37(4):277–284. PMID: 24819735 https://doi.org/10.1159/000360073
35. Fisher CM. Occlusion of the internal carotid artery. Arch Neurol Psychiatry. 1951;65(5):346–377. PMID: 13418970
36. Saam T, Underhill HR, Chu B, Takaya N, Cai J, Polissar NL, et al. Prevalence of American Heart Association type VI carotid atherosclerotic lesions identified by magnetic resonance imaging for different levels of stenosis as measured by duplex ultrasound. J Am Coll Cardiol. 2008;51(10):1014– 1021. PMID: 18325441 https://doi.org/10.1016/j.jacc.2007.10.054
37. Freilinger TM, Schindler A, Schmidt C, Grimm J, Cyran C, Schwarz F, et al. Prevalence of Nonstenosing, Complicated Atherosclerotic Plaques in Cryptogenic Stroke. JACC Cardiovasc Imaging. 2012;5(4):397–405. PMID: 22498329 https://doi.org/10.1016/j.jcmg.2012.01.012
38. Winter WJ Jr. Atheromatous emboli; a cause of cerebral infarction; report of two cases. AMA Arch Pathol. 1957;64(2):137–142. PMID: 13443604
39. Di Tullio MR, Sacco RL, Gersony D, Nayak H, Weslow RG, Kargman DE, et al. Aortic atheromas and acute ischemic stroke: A transesophageal echocardiographic study in an ethnically mixed population. Neurology. 1996;46(6):1560–1566. PMID: 8649549 https://doi.org/10.1212/wnl.46.6.1560
40. Amarenco P, Duyckaerts C, Tzourio C, Hénin D, Bousser MG, Hauw JJ. The prevalence of ulcerated plaques in the aortic arch in patients with stroke. N Engl J Med. 1992;326:221. PMID: 1727976 https://doi.org/10.1056/NEJM199201233260402
41. Knebel F, Masuhr F, von Hausen W, Walde T, Dreger H, Raab V, et al. Transesophageal echocardiography in patients with cryptogenic cerebral ischemia. Cardiovasc Ultrasound. 2009;7:15. PMID: 19327171 https://doi.org/10.1186/1476-7120-7-15
42. Okuma H, Kitagawa Y, Yasuda T, Tokuoka K, Takagi S. Comparison between single antiplatelet therapy and combination of antiplatelet and anticoagulation therapy for secondary prevention in ischemic stroke patients with antiphospholipid syndrome. Int J Med Sci. 2009;7(1):15– 18. PMID: 20046230 https://doi.org/10.7150/ijms.7.15
43. Rundek T, Di Tullio MR, Sciacca RR, Titova IV, Mohr JP, Homma S, et al. Association between large aortic arch atheromas and high-intensity transient signals in elderly stroke patients. Stroke. 1999;30(12):2683– 2686. PMID: 10582997 https://doi.org/10.1161/01.str.30.12.2683
44. The French Study of Aortic Plaques in Stroke Group; Amarenco P, Cohen A, Hommel M. Atherosclerotic disease of the aortic arch as a risk factor for recurrent ischemic stroke. N Engl J Med. 1996;334(19):1216–1221. PMID: 8606716 https://doi.org/10.1056/NEJM199605093341902
45. Stone DA, Hawke MW, LaMonte M, Kittner SJ, Acosta J, Corretti M, et al. Ulcerated atherosclerotic plaques in the thoracic aorta are associated with cryptogenic stroke: a multiplane transesophageal echocardiographic study. Am Heart J. 1995;130(1):105–108. PMID: 7611098 https://doi.org/10.1016/0002-8703(95)90243-0
46. Di Tullio MR, Russo C, Jin Z, Sacco RL, Mohr JP, Homma S. Aortic arch plaques and risk of recurrent stroke and death. Circulation. 2009;119(17):2376–2382. PMID: 19380621 https://doi.org/10.1161/CIRCULATIONAHA.108.811935
47. Kamel H, Gialdini G, Baradaran H, Giambrone AE, Navi BB, Lerario MP, et al. Cryptogenic Stroke and Nonstenosing Intracranial Calcified Atherosclerosis. J Stroke Cerebrovasc Dis. 2017;26(4):863–870. PMID: 27887791 https://doi.org/10.1016/j.jstrokecerebrovasdis.2016.10.035
48. Huang YN, Gao S, Li SW, Huang Y, Li JF, Wong KS, et al. Vascular lesions in Chinese patients with transient ischemic attacks. Neurology. 1997;48(2):524–525. PMID: 9040750 https://doi.org/10.1212/wnl.48.2.524
49. Weber R, Kraywinkel K, Diener HC, Weimar C. Symptomatic intracranial atherosclerotic stenoses: prevalence and prognosis in patients with acute cerebral ischemia. Cerebrovasc Dis. 2010;30(2):188–193. PMID: 20588014 https://doi.org/10.1159/000317107
50. Cohnheim J. Vorlesungen über allgemeine Pathologie. Ein Handbuch für Arzte und Studierende. Berlin: Hirschwald, 1878.
51. Homma S, Sacco RL, Di Tullio MR, Sciacca RR, Mohr JP. Effect of medical treatment in stroke patients with patent foramen ovale patent foramen ovale in Cryptogenic Stroke Study. Circulation. 2002;105(22):2625–2631. PMID: 12045168 https://doi.org/10.1161/01.cir.0000017498.88393.44
52. Alsheikh-Ali AA, Thaler DE, Kent DM. Patent foramen ovale in cryptogenic stroke incidental or pathogenic? Stroke. 2009;40(7):2349–2355. PMID: 19443800 https://doi.org/10.1161/STROKEAHA.109.547828
53. Hamedani AG, Cole JW, Mitchell BD, Kittner SJ. Meta-analysis of factor V Leiden and ischemic stroke in young adults: the importance of case ascertainment. Stroke. 2010;41(8):1599–1603. PMID: 20616326 https://doi.org/10.1161/STROKEAHA.110.581256
54. Overell JR, Bone I, Lees KR. Interatrial septal abnormalities and stroke: a meta-analysis of case-control studies. Neurology. 2000;55(8):1172– 1179. PMID: 11071496 https://doi.org/10.1212/wnl.55.8.1172
55. Wessler BS, Thaler DE, Ruthazer R, Weimar C, Di Tullio MR, Elkind MS, et al. Transesophageal echocardiography in cryptogenic stroke and patent foramen ovale analysis of putative high-risk features from the risk of paradoxical embolism database. Circ Cardiovasc Imaging. 2014;7(1):125–131. PMID: 24214884 https://doi.org/10.1161/CIRCIMAGING.113.000807
56. Liberman AL, Daruwalla VJ, Collins JD, Maas MB, Botelho MP, Ayache JB, et al. Diagnostic yield of pelvic magnetic resonance venography in patients with cryptogenic stroke and patent foramen ovale. Stroke. 2014;45(8):2324–2329. PMID: 24938843 https://doi.org/10.1161/STROKEAHA.114.005539
57. Osgood M, Budman E, Carandang R, Goddeau RP Jr, Henninger N. Prevalence of pelvic vein pathology in patients with cryptogenic stroke and patent foramen ovale undergoing MRV pelvis. Cerebrovasc Dis. 2015;39(3–4):216–223. PMID: 257917 https://doi.org/10.1159/000376613
58. Cramer SC, Rordorf G, Maki JH, Kramer LA, Grotta JC, Burgin WS, et al. Increased pelvic vein thrombi in cryptogenic stroke results of the Paradoxical Emboli From Large Veins in Ischemic Stroke (PELVIS) Study. Stroke. 2004;35(1):46–50. PMID: 14657451 https://doi.org/10.1161/01.STR.0000106137.42649.AB
59. Kent DM, Ruthazer R, Weimar C, Mas JL, Serena J, Homma S, et al. An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. Neurology. 2013;81(7):619–625. PMID: 23864310 https://doi.org/10.1212/WNL.0b013e3182a08d59
60. Loscalzo J. Paradoxical embolism: clinical presentation, diagnostic strategies, and therapeutic options. Am Heart J. 1986;112(1):141–145. PMID: 3728270
61. Tanislav C, Puille M, Pabst W, Reichenberger F, Grebe M, Nedelmann M, et al. High Frequency of Silent Pulmonary Embolism in Patients With Cryptogenic Stroke and Patent Foramen Ovale. Stroke. 2011;42(3):822– 824. PMID: 21257827 https://doi.org/10.1161/STROKEAHA.110.601575
62. Wu LA, Malouf JF, Dearani JA, Hagler DJ, Reeder GS, Petty GW, et al. Patent Foramen Ovale in Cryptogenic Stroke: current understanding and management options. Arch Intern Med. 2004;164(9):950–956. PMID: 15136302 https://doi.org/10.1001/archinte.164.9.950
63. Yanagawa S, Ito N, Arima K, Ikeda S. Cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy. Neurology. 2002;58(5):817–820. PMID: 11889251 https://doi.org/10.1212/wnl.58.5.817
64. Chan MY, Andreotti F, Becker RC. Hypercoagulable states in cardiovascular disease. Circulation. 2008;118(22):2286–97. PMID: 19029477 https://doi.org/10.1161/CIRCULATIONAHA.108.778837
65. Schuchlenz HW, Weihs W, Horner S, Quehenberger F. The association between the diameter of a patent foramen ovale and the risk of embolic cerebrovascular events. Am J Med. 2000;109(6):456–462. PMID: 11042234 https://doi.org/10.1016/s0002-9343(00)00530-1
66. Kimura K, Minematsu K, Wada K, Yasaka M, Tagaya M, Kuribayashi S, et al. Transcranial Doppler of a paradoxical brain embolism associated with a pulmonary arteriovenous fistula. AJNR Am J Neuroradiol. 1999;20(10):1881–1884. PMID: 10588113
67. Churton T. Multiple aneurysms of the pulmonary artery. Br Med J. (Clin Res Ed.). 1897; 1: 1223.
68. Westerman LP, Green D, Gilman-Sachs A, Beaman K, Freels S, Boggio L, et al. Antiphospholipid antibodies, proteins C and S, and coagulation changes in sickle cell disease. J Lab Clin Med. 1999;134(4):352–362. PMID: 10521081
69. McDermott S, Oliveira G, Ergül E, Brazeau N, Wicky S, Oklu R. MayThurner syndrome: can it be diagnosed by a single MR venography study. Diagn Interv Radiol. 2013;19(1):44–48. PMID: 22801870 https://doi.org/10.4261/1305-3825.DIR.5939-12.1
70. Crowther MA, Ginsberg JS, Julian J, Denburg J, Hirsh J, Douketis J, et al. A Comparison of Two Intensities of Warfarin for the Prevention of Recurrent Thrombosis in Patients with the Antiphospholipid Antibody Syndrome. N Engl J Med. 2003;349(12):1133–1138. PMID: 13679527 https://doi.org/10.1056/NEJMoa035241
71. Kiernan TJ, Yan BP, Cubeddu RJ, Rengifo-Moreno P, Gupta V, Inglessis I, et al. May-Thurner syndrome in patients with cryptogenic stroke and patent foramen ovale: an important clinical association. Stroke. 2009;40(4):1502–1504. PMID: 19182088 https://doi.org/10.1161/STROKEAHA.108.527366
72. Varona JF, Guerra JM, Bermejo F, Molina JA, Gomez de la Cámara A. Causes of ischemic stroke in young adults, and evolution of the etiological diagnosis over the long term. Eur Neurol. 2007;57(4):212– 218. PMID: 17268202 https://doi.org/10.1159/000099161
73. Nagel MA, Cohrs RJ, Mahalingam R, Wellish MC, Forghani B, Schiller A, et al. The Varicella zoster virus vasculopathies: clinical, CSF, imaging, and virologic features. Neurology. 2008;70(11):853–860. PMID: 18332343 https://doi.org/10.1212/01.wnl.0000304747.38502.e8
74. Caplan LR. Dissections of brain-supplying arteries. Nat Clin Pract Neurol. 2008;4(1):34–42. PMID: 18199995 https://doi.org/10.1038/ncpneuro0683
75. Gilden D, Cohrs RJ, Mahalingam R, Nagel MA. Varicella zoster virus vasculopathies: diverse clinical manifestations, laboratory features, pathogenesis, and treatment. Lancet Neurol. 2009;8(8):731–740. PMID: 19608099 https://doi.org/10.1016/S1474-4422(09)70134-6
76. Askalan R, Laughlin S, Mayank S, Chan A, MacGregor D, Andrew M, et al. Chickenpox and stroke in childhood: a study of frequency and causation. Stroke. 2001;32(6):1257–1262. PMID: 11387484 https://doi.org/10.1161/01.str.32.6.1257
77. Kang JH, Ho JD, Chen YH, Lin HC. Increased risk of stroke after a herpes zoster attack: a population-based follow-up study. Stroke. 2009;40(11):3443–3448. PMID:19815828 https://doi.org/10.1161/STROKEAHA.109.562017
78. Nouh A, Hussain M, Mehta T, Yaghi S. Embolic Strokes of Unknown Source and Cryptogenic Stroke: Implications in Clinical Practice. Front Neurol. 2016;7:37. PMID: 27047443 https://doi.org/10.3389/fneur.2016.00037
79. Sajedi PI, Gonzalez JN, Cronin CA, Kouo T, Steven A, Zhuo J, et al. Carotid Bulb Webs as a Cause of “Cryptogenic” Ischemic Stroke. AJNR Am J Neuroradiology. 2017;38(7):1399–1404. PMID: 28495950 https://doi.org/10.3174/ajnr.A5208
80. Amarenco P, Davis S, Jones EF, Cohen AA, Heiss WD, Kaste M, et al. The Aortic Arch Related Cerebral Hazard Trial Investigators. Clopidogrel Plus Aspirin Versus Warfarin in Patients With Stroke and Aortic Arch Plaques. Stroke. 2014;45(5):1248–1257. PMID:24699050 https://doi.org/10.1161/STROKEAHA.113.004251
81. Ohene-Frempong K, Weiner SJ, Sleeper LA, Miller ST, Embury S, Moohr JW, et al. Cerebrovascular accidents in sickle cell disease: rates and risk factors. Blood. 1998;91(1):288–294. PMID: 9414296
82. Koshy M, Thomas C, Goodwin J. Vascular lesions in the central nervous system in sickle cell disease (neuropathology). J Assoc Acad Minor Phys. 1990;1(3):71–78. PMID: 2136620
83. Razdan S, Strouse JJ, Naik R, Lanzkron S, Urrutia V, Resar JR, et al. Patent Foramen Ovale in Patients with Sickle Cell Disease and Stroke: Case Presentations and Review of the Literature. Case Rep Hematol. 2013;2013: 516705. PMID: 23956892 https://doi.org/10.1155/2013/516705
84. Bertina R.M., Koeleman B.P., Koster T., Rosendaal FR, Dirven RJ, de Ronde H, et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature. 1994;369(6475):64–67. PMID: 8164741 https://doi.org/10.1038/369064a0
85. Casas JP, Bautista LE, Smeeth L, Sharma P, Hingorani AD. Homocysteine and stroke: evidence on a causal link from mendelian randomisation. Lancet. 2005; 365(9455): 224–232. PMID: 15652605 https://doi.org/10.1016/S0140-6736(05)17742-3
86. Morris JG, Singh S, Fisher M. Testing for inherited thrombophilias in arterial stroke: can it cause more harm than good? Stroke. 2010;41(12):2985–2990. PMID: 20947844 https://doi.org/10.1161/STROKEAHA.110.595199
87. Aznar J, Mira Y, Vayб A, Corella D, Ferrando F, Villa P, et al. Factor V Leiden and prothrombin G20210A mutations in young adults with cryptogenic ischemic stroke. Thromb Haemost. 2004;91(5):1031–1034. PMID:15116266 https://doi.org/10.1160/TH03-11-0690
88. De Stefano V, Chiusolo P, Paciaroni K, Casorelli I, Rossi E, Molinari M, et al. Prothrombin G20210A mutant genotype is a risk factor for cerebrovascular ischemic disease in young patients. Blood. 1998; 91(10): 3562–3565. PMID: 9572989
89. Casas JP, Hingorani AD, Bautista LE, Sharma P. Meta-analysis of genetic studies in ischemic stroke: thirty-two genes involving approximately 18,000 cases and 58,000 controls. Arch Neurol. 2004;61(11):1652–1661. PMID: 15534175 https://doi.org/10.1001/archneur.61.11.1652
90. Holmes MV, Newcombe P, Hubacek JA, Sofat R, Ricketts SL, Cooper J, et al. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet. 2011;378(9791):584–594. PMID: 21803414 https://doi.org/10.1016/S0140-6736(11)60872-6
91. Kelly PJ, Rosand J, Kistler JP, Shih VE, Silveira S, Plomaritoglou A, et al. Homocysteine, MTHFR 677C→T polymorphism, and risk of ischemic stroke: results of a meta-analysis. Neurology. 2002;59(4):529–536. PMID: 12196644 https://doi.org/10.1212/wnl.59.4.529
92. Kim RJ, Becker RC. Association between factor V Leiden, prothrombin G20210A, and methylenetetrahydrofolate reductase C677T mutations and events of the arterial circulatory system: a meta-analysis of published studies. Am Heart J. 2003;146(6):948–957. PMID: 14660985 https://doi.org/10.1016/S0002-8703(03)00519-2
93. Pezzini A, Grassi M, Del Zotto E, Lodigiani C, Ferrazzi P, Spalloni A, et al. Common genetic markers and prediction of recurrent events after ischemic stroke in young adults. Neurology. 2009;73(9):717–723. PMID: 19720979 https://doi.org/10.1212/WNL.0b013e3181b59aaf
94. Patel ML, Sachan R, Seth G. Combined deficiency of proteins C and S: ischaemic stroke in young individuals. BMJ Case Reports. 2013;2013: pii: bcr2012008016. PMID: 24334463 https://doi.org/10.1136/bcr-2012008016
95. Brey RL, Stallworth CL, McGlasson DL, Wozniak MA, Wityk RJ, Stern BJ, et al. Antiphospholipid antibodies and stroke in young women. Stroke. 2002;33(10):2396–2400. PMID: 12364727 https://doi.org/10.1161/01.str.0000031927.25510.d1
96. Levine SR, Brey RL, Tilley BC, Thompson JL, Sacco RL, Sciacca RR, et al. Antiphospholipid antibodies and subsequent thrombo-occlusive events in patients with ischemic stroke. JAMA. 2004;291(5):576–584. PMID: 14762036 https://doi.org/10.1001/jama.291.5.576
97. Anticardiolipin antibodies are an independent risk factor for first ischemic stroke. The Antiphospholipid Antibodies in Stroke Study (APASS) Group. Neurology. 1993;43(10):2069–2073. PMID: 8413969
98. Tohgi H, Takahashi H, Kashiwaya M, Watanabe K, Hayama K. The anticardiolipin antibody in elderly stroke patients: its effects on stroke types, recurrence, and the coagulation-fibrinolysis system. Acta Neurol Scand. 1994;90(2):86–90. PMID: 7801744
99. Levine SR, Salowich-Palm L, Sawaya KL, Perry M, Spencer HJ, Winkler HJ, et al. IgG anticardiolipin antibody titer > 40 GPL and the risk of subsequent thrombo-occlusive events and death: a prospective cohort study. Stroke. 1997;28(9):1660–1665. PMID: 9303006 https://doi.org/10.1161/01.str.28.9.1660
100. Nencini P, Baruffi MC, Abbate R, Massai G, Amaducci L, Inzitari D. Lupus anticoagulant and anticardiolipin antibodies in young adults with cerebral ischemia. Stroke. 1992;23(2):189–193. PMID: 1561646 https://doi.org/10.1161/01.str.23.2.189
101. Karttunen V, Alfthan G, Hiltunen L, Rasi V, Kervinen K, Kesäniemi YA, et al. Risk factors for cryptogenic ischaemic stroke. Eur J Neurol. 2002;9(6):625–632 PMID: 12453078
102. Vayá A, Ejarque I, Tembl J, Corella D, Laiz B. Hyperhomocysteinemia, obesity and cryptogenic stroke. Clin Hemorheol Microcirc. 2011;47(1):53– 58. PMID: 21321408 https://doi.org/10.3233/CH-2010-1365
103. Eikelboom JW, Hankey GJ, Anand SS, Lofthouse E, Staples N, Baker RI. Association between high homocyst(e)ine and ischemic stroke due to largeand small-artery disease but not other etiologic subtypes of ischemic stroke. Stroke. 2000;31(5):1069–1075. PMID: 10797167 https://doi.org/10.1161/01.str.31.5.1069
104. Klatsky AL, Armstrong MA, Friedman GD, Sidney S. Alcohol drinking and risk of hemorrhagic stroke. Neuroepidemiology. 2002;21(3):115– 122. PMID: 12006774 https://doi.org/10.1159/000054808
105. Selhub J, Jacques PF, Wilson PW, Rush D, Rosenberg IH. Vitamin status and intake as primary determinants of homocysteinemia in an elderly population. JAMA. 1993;270(22):2693–2698. PMID: 8133587 https://doi.org/10.1001/jama.1993.03510220049033
106. Weintraub G, Sprecace G. Paroxysmal atrial fibrillation and cerebral embolism with apparently normal heart. N Engl J Med. 1958;259(18):875– 876. PMID: 13590468 https://doi.org/10.1056/NEJM195810302591807
107. Hassan A, Sham PC, Markus HS. Planning genetic studies in human stroke Sample size estimates based on family history data. Neurology. 2002;58(10):1483–1488. PMID: 12034783 https://doi.org/10.1212/wnl.58.10.1483
108. Chabriat H, Levy C, Taillia H, Iba-Zizen MT, Vahedi K, Joutel A, et al. Patterns of MRI lesions in CADASIL. Neurology. 1998;51(2):452–457. PMID: 9710018 https://doi.org/10.1212/wnl.51.2.452
109. O’Sullivan M, Jarosz JM, Martin RJ, Deasy N, Powell JF, Markus HS. MRI hyperintensities of the temporal lobe and external capsule in patients with CADASIL. Neurology. 2001;56(5):628–634. PMID: 11245715 https://doi.org/10.1212/wnl.56.5.628
110. Fukutake T. Young-adult-onset hereditary subcortical vascular dementia: cerebral autosomal recessive arteriosclerosis with subcortical infarcts and leukoencephalopathy (CARASIL). Rinsho Shinkeigaku. 1999; 39(1): 50–52. PMID: 10377800
111. Star M, Gill R, Bruzzone M, De Alba F, Schneck MJ, Biller J. Do not forget Susac syndrome in patients with unexplained acute confusion. J Stroke Cerebrovasc Dis. 2015;24(4):e93–95. PMID: 25680663 https://doi.org/10.1016/j.jstrokecerebrovasdis.2014.11.028
112. Jen J, Cohen AH, Yue Q, Stout JT, Vinters HV, Nelson S, et al. Hereditary endotheliopathy with retinopathy, nephropathy, and stroke (HERNS). Neurology. 1997;49(5):1322–1330. PMID: 9371916 https://doi.org/10.1212/wnl.49.5.1322
113. Olin JW, Kaufman JA, Bluemke DA, Bonow RO, Gerhard MD, Jaff MR, et al. Atherosclerotic Vascular Disease Conference: writing Group IV: imaging. Circulation. 2004;109(21):2626-2633. PMID:15173045 https://doi.org/10.1161/01.CIR.0000128521.02390.72
114. Desnick RJ, Ioannou YA, Eng CM. Galactosidase a deficiency: fabry disease. In: Scriver CR, Beaudet AL, Sly WS, Valle D. (eds.) The Metabolic and Molecular Bases of Inherited Disease. 8th ed. New York, NY: McGraw Hill; 2001. p.3733–3774.
115. Moore DF, Kaneski CR, Askari H, Schiffmann R. The cerebral vasculopathy of Fabry disease. J Neurol Sci. 2007;257(1–2):258–263. PMID: 17362993 https://doi.org/10.1016/j.jns.2007.01.053
116. Desnick RJ, Brady R, Barranger J, Collins AJ, Germain DP, Goldman M, et al. Fabry disease, an under-recognized multisystemic disorder: expert recommendations for diagnosis, management, and enzyme replacement therapy. Ann Intern Med. 2003;138(4):338–346. PMID: 1258533 https://doi.org/10.7326/0003-4819-138-4-200302180-00014
117. Manara R, Carlier RY, Righetto S, Citton V, Locatelli G, Colas F, et al. Basilar Artery Changes in Fabry Disease. AJNR Am J Neuroradiol. 2017;38(3):531–536. PMID: 28126747 https://doi.org/10.3174/ajnr.A5069.
118. Moore DF, Ye F, Schiffmann R, Butman JA. Increased signal intensity in the pulvinar on T1weighted images: a pathognomonic MR imaging sign of Fabry disease. AJNR Am J Neuroradiol. 2003;24(6):1096–1101. PMID: 12812932
119. Rolfs A, Böttcher T, Zschiesche M, Morris P, Winchester B, Bauer P, et al. Prevalence of Fabry disease in patients with cryptogenic stroke: a prospective study. Lancet. 2005;366(9499):1794–1796. PMID: 16298216 https://doi.org/10.1016/S0140-6736(05)67635-0
120. Sims K, Politei J, Banikazemi M, Lee P. Stroke in Fabry Disease Frequently Occurs Before Diagnosis and in the Absence of Other Clinical Events Natural History Data From the Fabry Registry. Stroke. 2009;40(3):788– 794. PMID: 19150871 https://doi.org/10.1161/STROKEAHA.108.526293
121. Grisold W, Oberndorfer S, Struhal W. Stroke and cancer: a review. Acta Neurol Scand. 2009;119(1):1–16. PMID: 18616624 https://doi.org/10.1111/j.1600-0404.2008.01059.x
122. Graus F, Rogers LR, Posner JB. Cerebrovascular complications in patients with cancer. Medicine (Baltimore). 1985;64(1):16–35. PMID: 3965856
123. Kim SJ, Park JH, Lee MJ, Park YG, Ahn MJ, Bang OY. Clues to occult cancer in patients with ischemic stroke. PLoS One. 2012;7(9):e44959. PMID: 22984594 https://doi.org/10.1371/journal.pone.0044959
124. Schwarzbach CJ, Schaefer A, Ebert A, Held V, Bolognese M, Kablau M, et al. Stroke and cancer: the importance of cancer-associated hypercoagulation as a possible stroke etiology. Stroke. 2012;43(11):3029–3034. PMID: 22996958 https://doi.org/10.1161/STROKEAHA.112.658625
125. Kim SG, Hong JM, Kim HY, Held V, Bolognese M, Kablau M, et al. Ischemic stroke in cancer patients with and without conventional mechanisms: a multicenter study in Korea. Stroke. 2010;41(4):798–801. PMID: 20150545 https://doi.org/10.1161/STROKEAHA.109.571356
126. Rogers LR. Cerebrovascular complications in cancer patients. Neurol Clin. 2003;21(1):167–192. PMID: 12690649
127. Steiner I. Nonbacterial thrombotic endocarditis – a study of 171 case reports. Cesk Patol. 1993;29(2):58–60. PMID: 8339326
128. Ojeda VJ, Frost F, Mastaglia FL. Non-bacterial thrombotic endocarditis associated with malignant disease: a clinicopathological study of 16 cases. Med J Aust. 1985;142(12):629–631. PMID: 4000038
Heart Disease and Stroke
Знание признаков инсульта — первый шаг в предотвращении инсульта.
Инсульт, иногда называемый «мозговой атакой», возникает, когда прекращается приток крови к определенной области мозга. Клетки мозга, лишенные кислорода и глюкозы, необходимых для выживания, умирают. Если не вовремя обнаружить, это может привести к необратимому повреждению мозга.
Какие типы инсульта?
Есть два типа хода.
- Ишемический инсульт похож на сердечный приступ, за исключением того, что он происходит в кровеносных сосудах головного мозга.Сгустки могут образовываться либо в кровеносных сосудах головного мозга, либо в кровеносных сосудах, ведущих к мозгу, либо даже в кровеносных сосудах в других частях тела, которые затем попадают в мозг. Эти сгустки блокируют приток крови к клеткам мозга. Ишемический инсульт также может возникнуть, когда слишком много бляшек (жировых отложений и холестерина) закупоривает кровеносные сосуды головного мозга. Около 80% всех инсультов имеют этот характер.
- Геморрагический (хе-море-радж-ик) инсульт возникает, когда кровеносный сосуд в головном мозге разрывается или разрывается.В результате кровь просачивается в ткань мозга, вызывая повреждение клеток мозга. Наиболее частыми причинами геморрагического инсульта являются высокое кровяное давление и аневризмы головного мозга. Аневризма — это слабость или истончение стенки кровеносного сосуда.
Каковы симптомы инсульта?
Наиболее частыми симптомами инсульта являются:
- Слабость или онемение лица, руки или ноги с одной стороны тела.
- Потеря зрения или затемнение (например, падающая занавеска) в одном или обоих глазах.
- Потеря речи, трудности при разговоре или понимании того, что говорят другие.
- Внезапная сильная головная боль без известной причины.
- Потеря равновесия или нестабильная ходьба, обычно в сочетании с другим симптомом.
Что делать, если у меня появились симптомы инсульта?
Немедленно позвоните в службу 911, если у вас или вашего знакомого появились симптомы инсульта. Инсульт требует неотложной медицинской помощи. Немедленное лечение может спасти вам жизнь или повысить шансы на полное выздоровление.
Можно ли предотвратить инсульт?
До 50% всех инсультов можно предотвратить. Многие факторы риска инсульта можно контролировать до того, как они вызовут проблемы.
Продолжение
Контролируемые факторы риска инсульта:
Продолжение
Неконтролируемые факторы риска инсульта:
- Возраст (65 лет и старше)
- Пол (у мужчин больше инсультов, у женщин — более смертоносных)
- Раса (афроамериканцы подвержены повышенному риску)
- Семейный анамнез инсульта
Ваш врач может оценить ваш риск инсульта и помочь вам контролировать факторы риска.Иногда предупреждающие знаки появляются еще до инсульта.
Это так называемые транзиторные ишемические атаки (также называемые ТИА или «мини-инсульт») и представляют собой короткие краткие эпизоды симптомов инсульта, перечисленных выше. Это также может быть предупреждающим признаком надвигающегося серьезного инсульта. Любой человек с ТИА должен быть доставлен в отделение неотложной помощи. Однако у некоторых людей нет симптомов, предупреждающих их до инсульта, или симптомы настолько легкие, что не заметны. Регулярные осмотры важны для выявления проблем, прежде чем они станут серьезными.Сообщайте врачу о любых симптомах или факторах риска.
У молодых людей тоже может быть инсульт. Если вы думаете, что у вас инсульт, наиболее важным шагом будет позвонить в службу 9-1-1.
Болезни сердца и инсульт — канал «Лучшее здоровье»
Болезни сердца и инсульт — это оба типа сердечно-сосудистых заболеваний. Сердечно-сосудистая система, также называемая системой кровообращения, включает в себя сердце и все кровеносные сосуды, которые перекачивают и перемещают кровь по телу. Состояние вашей сердечно-сосудистой системы во многом определяется вашим образом жизни.Хотя возраст и генетические факторы играют роль, многие сердечно-сосудистые заболевания можно было бы предотвратить, если бы больше австралийцев ели здоровую пищу, выполняли больше физических нагрузок, поддерживали здоровый вес и кровяное давление и избегали курения.
В 2013 году на сердечно-сосудистые заболевания приходилось почти треть (30 процентов) всех смертей в Австралии, причем каждые 12 минут каждый австралиец умирал.
Типы сердечно-сосудистых заболеваний
Сердечно-сосудистые заболевания включают ряд состояний, связанных с образом жизни, в том числе:
- ишемическая болезнь сердца — стенокардия или сердечный приступ (острый инфаркт миокарда)
- инсульт — вызванный блокадой сгусток крови (называемый ишемическим инсультом) или разрыв кровеносного сосуда и кровотечение (называемый геморрагическим инсультом)
- Заболевание периферических сосудов — закупорка крупных кровеносных сосудов, которые снабжают кровью руки и ноги.
Сердечно-сосудистые заболевания, не связанные с образом жизни, включают:
- острый ревматизм и ревматический порок сердца — вызванные нелеченой инфекцией стрептококками группы А
- врожденный порок сердца — наследственные заболевания, которые влияют на структуру (например, как клапаны) сердца.
Безусловно, самой большой причиной смерти от сердечно-сосудистых заболеваний является прогрессирующая закупорка кровеносных сосудов, приводящая к ишемической болезни сердца и инсульту.
Причины ишемической болезни сердца и инсульта
Здоровые кровеносные сосуды гибкие, но с возрастом и нездоровым образом жизни они могут утолщаться и становиться жесткими, что может ограничивать кровоток по телу. Этот процесс известен как атеросклероз и обычно называется «затвердением артерий».
Атеросклероз — это форма артериосклероза, при которой происходит накопление жировых веществ и клеточных отходов (бляшек). Они могут частично или полностью заблокировать кровеносные сосуды, или бляшка может разорваться и вызвать образование тромба, который также блокирует кровоток.Атеросклероз может возникнуть в любом месте тела. Например, когда это происходит в сосудах, ведущих к вашим рукам и ногам, это может вызвать заболевание периферических сосудов (PVD).
Когда процесс атеросклероза возникает в артериях, снабжающих кровью сердечную мышцу (ишемическая болезнь сердца или ИБС), это может вызвать стенокардию или сердечный приступ.
Когда этот процесс происходит в артериях, снабжающих кровью головной мозг, артерии сужаются с образованием бляшек, и может образовываться тромб, блокирующий кровоснабжение головного мозга (тромботический инсульт).В других случаях сгусток крови может перемещаться из других частей тела (например, из сердца) и застревать в суженных артериях (эмболический инсульт).
Тромботический инсульт и эмболический инсульт являются причинами наиболее распространенного типа инсульта — ишемического инсульта. Геморрагический инсульт, который встречается реже, возникает при разрыве кровеносного сосуда в головном мозге и кровотечении.
Хотя закупорка кровеносных сосудов может вызвать как ишемическую болезнь сердца, так и некоторые виды инсульта, инсульт — это не то же самое, что болезнь сердца.
Снижение риска ишемической болезни сердца и инсульта
Вы можете снизить риск сердечно-сосудистых заболеваний, от которых умирает почти треть австралийцев, сделав выбор в пользу здорового образа жизни, например:
- Избегайте курения или курения — курение является основным фактор риска, поскольку никотин напрямую сужает ваши кровеносные сосуды.
- Ешьте здоровую пищу — особенно избегайте полуфабрикатов.
- Делайте упражнения и больше двигайтесь — поговорите со своим врачом о упражнениях, которые подходят вам.
- Поддерживайте здоровый вес — упражнения и здоровое питание помогут сделать это проще.
- Управляйте стрессом — попробуйте расслабление мышц, дыхательные техники или визуализацию.
Посетите врача, чтобы обсудить выбор образа жизни, который снизит риск сердечно-сосудистых заболеваний. Вы также можете попросить совета о регулярных осмотрах для выявления ранних признаков заболеваний, таких как:
- депрессия
- диабет
- высокое кровяное давление
- высокий уровень холестерина.
Куда обратиться за помощью
- Ваш врач
- В экстренных случаях всегда звоните по системе «тройной ноль» (000)
- Отделение неотложной помощи ближайшей больницы
- ДЕТСКАЯ МЕДСЕСТРА Тел. 1300 60 60 24 — для получения медицинской информации и консультаций (круглосуточно, 7 дней)
- Скорая помощь Святого Иоанна, Австралия (Виктория) Тел. 1300 360 455
- StrokeLine Тел. 1800 787 653 — для получения информации о лечении, профилактике и восстановлении после инсульта
- enableme — The Stroke Foundation — Получите информацию, советы и методы, которые помогут вам в восстановлении после инсульта.
Ишемия миокарда и ишемический инсульт
Ишемия — это состояние, при котором живая ткань не получает кислород и питательные вещества, обычно из-за препятствия кровотоку к этой ткани. Ткань, подверженная ишемии, называется ишемической и обычно функционирует ненормально. Если ишемия сохраняется достаточно долго, пораженная ткань погибает. Это называется инфарктом — термин, который большинство людей распознают в таких словосочетаниях, как инфаркт миокарда (сердечный приступ) или инфаркт головного мозга (инсульт).
Мартин Барро / Getty ImagesВысокое кровяное давление — фактор риска
Существуют разные типы ишемии, и тип, который вы испытываете, зависит от пораженной ткани. Атеросклероз — затвердение артерий — частая причина ишемии, а гипертония значительно увеличивает риск атеросклероза. Люди с высоким кровяным давлением подвержены большему риску развития определенных видов ишемии, чем население в целом, включая ишемию миокарда, которая влияет на ваше сердце, и ишемический инсульт, который влияет на ваш мозг.
Ишемия миокарда
Если вы страдаете ишемией миокарда, также называемой ишемией сердца, ваше сердце не получает достаточно кислорода. Обычно причиной является частичная или полная закупорка коронарных артерий, что приводит к повреждению сердечной мышцы. У вас может случиться сердечный приступ, если вы испытаете внезапную и серьезную закупорку.
Общие симптомы ишемии миокарда включают:
- Боль в шее, челюсти, плече или руке
- Повышенное сердцебиение, называемое тахикардией
- Тошнота и рвота
- Длительная и сильная боль в груди
Помимо высокого кровяного давления, есть и другие распространенные состояния здоровья, которые повышают вероятность развития ишемии миокарда, включая высокий уровень холестерина, диабет и ожирение.
Ишемический инсульт
Когда закупоренная артерия вызывает недостаток кислорода в мозгу, что приводит к внезапной смерти ткани, у вас ишемический инсульт. Последствия инсульта варьируются от умеренных до тяжелых и зависят от пораженной части мозга.
Немедленная медицинская помощь настолько важна для сохранения тканей мозга, что существует акроним, который помогает пожилым людям и их опекунам легко запоминать симптомы. Если у человека проявляется какой-либо из следующих симптомов в результате неудачного выполнения любого из следующих простых тестов, позвоните в службу 9-1-1.
Как распознать инсульт
Чтобы определить, есть ли у кого-то инсульт, действуйте F.A.S.T.
- Лицевая. Человек пытается улыбнуться, но одна сторона опускается.
- Оружие. Когда человек поднимает обе руки, одна смещается вниз.
- Выступление . Если вы попросите их повторить простое предложение, они ответят невнятно или не смогут ответить.
- Время. Время имеет решающее значение, и важно как можно скорее добраться до больницы.
Факторы риска инсульта
Пожилые люди подвержены большему риску инсульта, чем население в целом. Тем, у кого высокое кровяное давление, следует быть еще более осторожными. Это заболевание является причиной более чем половины всех инсультов, а вероятность инсульта у пациентов с гипертонией до 10 раз выше.
Пол: Когда вы становитесь старше, инсульт одинаково часто встречается у обоих полов. Однако от инсульта умирает больше мужчин старшего возраста, чем женщин.
Образ жизни: Эти виды поведения увеличивают ваш риск, и вы можете устранить их, взяв на себя обязательство вести более здоровый образ жизни:
- соблюдение диеты с высоким содержанием жира или натрия
- Регулярное злоупотребление алкоголем или запой
- Выкуривание пачки в день удваивает риск инсульта
- Недостаточное упражнение
Количество лейкоцитов, частота ишемической болезни сердца и ишемического инсульта, а также смертность от сердечно-сосудистых заболеваний среди афроамериканских и белых мужчин и женщин: исследование риска атеросклероза в сообществах | Американский журнал эпидемиологии
Аннотация
Авторы исследовали связь между количеством лейкоцитов (WBC) и заболеваемостью ишемической болезнью сердца, ишемическим инсультом и смертностью от сердечно-сосудистых заболеваний у 13 555 афроамериканских и белых мужчин и женщин в рамках исследования риска атеросклероза в сообществах (ARIC).Кровь брали при базовом обследовании ARIC, начиная с 1987–1989 гг. В среднем за 8 лет наблюдения (до декабря 1996 г.) было зарегистрировано 488 случаев ишемической болезни сердца, 220 случаев инсульта и 258 случаев смерти от сердечно-сосудистых заболеваний. После корректировки на возраст, пол, полевой центр ARIC и множественные факторы риска была обнаружена прямая связь между количеством лейкоцитов и заболеваемостью ишемической болезнью сердца ( p <0,001 для тенденции) и инсультом ( p для тенденции <0.001) и смертность от сердечно-сосудистых заболеваний ( p для тенденции <0,001) у афроамериканцев. У афроамериканцев с наивысшим квартилем по количеству лейкоцитов (≥7000 клеток / мм 3 ) был в 1,9 раза выше риск возникновения ишемической болезни сердца (95% доверительный интервал (ДИ): 1,19, 3,09), в 1,9 раза больше риск возникновения заболевания. ишемический инсульт (95% ДИ: 1,03, 3,34) и в 2,3 раза выше риск смертности от сердечно-сосудистых заболеваний (95% ДИ: 1,38, 3,72) по сравнению с их аналогами в самом низком квартиле количества лейкоцитов (<4800 клеток / мм 3 ) .Эти ассоциации были похожи у белых и у никогда не куривших. Повышенное количество лейкоцитов напрямую связано с увеличением заболеваемости ишемической болезнью сердца и ишемическим инсультом, а также смертностью от сердечно-сосудистых заболеваний у афроамериканцев и белых мужчин и женщин.
Повышенное количество лейкоцитов (лейкоцитов) является фактором риска атеросклеротического заболевания сосудов. Считается, что происходящие из лейкоцитов макрофаги и другие фагоциты способствуют повреждению сосудов и прогрессированию атеросклероза (1, 2).Несколько проспективных исследований показали положительную и независимую связь между количеством лейкоцитов и заболеваемостью или смертностью от ишемической болезни сердца (3–11). Однако мало что известно об этой ассоциации у афроамериканцев.
Количество лейкоцитов связано с несколькими факторами риска сердечно-сосудистых заболеваний (12–14). Количество лейкоцитов у курильщиков выше, чем у некурящих (12–14). Некоторые исследователи сообщили, что повышенное количество лейкоцитов связано с повышенным риском смертности от ишемической болезни сердца как у курильщиков, так и у некурящих (9, 10), в то время как другие исследования не обнаружили связи среди никогда не куривших (7).Количество лейкоцитов обратно пропорционально физической активности, холестерину липопротеинов высокой плотности и доходу семьи (12–14). Исследования постоянно сообщают о более низком количестве лейкоцитов у афроамериканцев, чем у белых, хотя причина неясна. Проведено мало исследований связи между количеством лейкоцитов и заболеваемостью или смертностью от сердечно-сосудистых заболеваний у афроамериканцев (7). Поэтому мы исследовали связь между количеством лейкоцитов и заболеваемостью ишемической болезнью сердца и ишемическим инсультом, а также между количеством лейкоцитов и смертностью от сердечно-сосудистых заболеваний у афроамериканцев и белых мужчин и женщин в рамках исследования риска атеросклероза в сообществах (ARIC).
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемая популяция
Исследование ARIC — это популяционное когортное исследование, разработанное для изучения этиологии атеросклероза у лиц с двумя расами. Исследуемая популяция включает 15 792 мужчины и женщины в возрасте от 45 до 64 лет. Участники были набраны в 1987–1989 годах из четырех общин США: графства Форсайт, Северная Каролина; Джексон, Миссисипи; Округ Вашингтон, штат Мэриленд; и северо-западные пригороды Миннеаполиса, штат Миннесота.Доля ответов в этих сообществах составила 66 процентов, 46 процентов, 65 процентов и 67 процентов соответственно. Все участники из Джексона и 12 процентов участников из округа Форсайт были афроамериканцами, тогда как 99 процентов участников из двух других сообществ были белыми. Полный дизайн исследования, стратегия выборки и используемые методы исследования были описаны ранее (15).
Базовое обследование включало домашнее собеседование и клиническое обследование.Домашнее интервью оценивало привычки участников в отношении здоровья, демографические характеристики и истории болезни. Клиническое обследование включало физикальное обследование, измерение артериального давления, анализы крови, сбор антропометрических данных, электрокардиограмму в 12 отведениях и ультразвуковое исследование в B-режиме. Подробная информация о процедурах обследования опубликована в других источниках (6, 13, 15, 16).
Все участники дали свое информированное согласие на клиническое обследование, и им было предложено голодать в течение предыдущих 12 часов.Образцы сыворотки, плазмы и цельной крови брали из антекубитальной вены (15, 16). Количество лейкоцитов определяли с помощью автоматических счетчиков частиц в течение 24 часов после венепункции в гематологических лабораториях местной больницы. Коэффициент надежности измерения количества лейкоцитов был выше 0,96 (13). Уровни общего холестерина в плазме и холестерина липопротеинов высокой плотности измеряли ферментативным методом. Кровяное давление в положении сидя измеряли после 5-минутного отдыха с помощью сфигмоманометра с произвольным нулевым значением.Сахарный диабет определялся как уровень глюкозы натощак ≥126 мг / дл, уровень глюкозы без питания ≥200 мг / дл, использование гипогликемических средств или наличие в анамнезе диагностированного врачом сахарного диабета. Вес и рост измеряли с помощью вертикальной металлической линейки и калиброванной шкалы. Обхват талии измеряли на уровне пупка стальной или стекловолоконной рулеткой. Курение сигарет, потребление алкоголя, семейный доход и уровень образования оценивались с помощью стандартизированных анкет.Статус курения субъектов был классифицирован как никогда не курил, курил ранее или курил в настоящее время. Статус потребления алкоголя классифицировался как непьющий, употреблял ранее или употреблял алкоголь в настоящее время. Годовой семейный доход классифицировался как низкий (<25 000 долларов США), средний (25 000 - <50 000 долларов США) или высокий (≥ 50 000 долларов США). Образовательный уровень классифицировался по количеству лет обучения: меньше, чем средняя школа, окончание средней школы, окончание колледжа или больше. Физическая активность в спорте оценивалась с помощью адаптации Baecke et al.(17) опросник по физической активности с оценкой от 1 (низкий) до 5 (высокий) и классифицировался как низкий (<2), умеренный (2– <4) или высокий (≥4).
Установление заболеваемости или смертности
За всеми участниками наблюдали от исходного обследования до даты заболеваемости / смерти или потери для последующего наблюдения или до 31 декабря 1996 г. С участниками ARIC ежегодно связывались по телефону для идентификации всех госпитализаций и смертей, а также списков выписок. из местных больниц были просканированы на предмет событий.Для пациентов, которые были госпитализированы с потенциальным инфарктом миокарда, обученные абстракторы записали имеющиеся признаки и симптомы и сделали фотокопии до трех электрокардиограмм в 12 отведениях для кодирования Миннесоты (18). Для оценки потенциального инсульта абстрагенты записали соответствующие признаки и симптомы, а также сделали фотокопии нейровизуализации и других диагностических отчетов. Смертельные случаи выявлялись на основании свидетельств о смерти, а потенциальные внебольничные летальные события ишемической болезни сердца исследовались путем опроса одного или нескольких ближайших родственников и заполнения анкеты врачом пациента.Все события ишемической болезни сердца были подтверждены комитетом врачей с использованием стандартизованных критериев (19). Инсульты были подтверждены комбинацией компьютеризированного алгоритма и обзора врача (20).
Мы определили событие ишемической болезни сердца как определенный или вероятный госпитализированный инфаркт миокарда или определенную фатальную ишемическую болезнь сердца. Нестабильная стенокардия или коронарная реваскуляризация не были включены из-за опасений по поводу этнических различий в диагностике и использовании процедур.Ишемический инсульт Событие было определено как определенный или вероятный госпитализированный эмболический или тромботический инсульт. Преходящие ишемические атаки и небольшое количество недокументированных смертельных инсультов были исключены. Смерть от сердечно-сосудистых заболеваний было основано только на свидетельстве о смерти и включало любую первопричину смерти (коды 390–459) в соответствии с кодировкой департаментов здравоохранения штата в соответствии с Международной классификацией болезней , девятая редакция.
Статистический анализ
Мы включили 13 555 мужчин и женщин в возрасте 45–64 лет, которые участвовали в базовом обследовании ARIC с 1987 по 1989 год.Исключались пациенты с ишемической болезнью сердца, инсультом или раком в анамнезе на исходном уровне; те, у кого количество лейкоцитов> 15000 клеток / мм 3 или <2000 клеток / мм 3 ; и те, у которых отсутствуют базовые значения количества лейкоцитов или другие ковариатные значения. Регрессия пропорциональных рисков использовалась для изучения общей связи между количеством лейкоцитов и заболеваемостью ишемической болезнью сердца и инсультом, а также между количеством лейкоцитов и смертностью от сердечно-сосудистых заболеваний (21). Расовые модели были использованы для изучения этой ассоциации отдельно у афроамериканцев и белых.Мы также исследовали связь между количеством лейкоцитов и заболеваемостью или смертностью от курения. Количество лейкоцитов было сгруппировано в квартили (<4,8, 4,8– <5,8, 5,8– <7,0 и ≥7,0 × 1000 клеток / мм 3 ). Относительные риски и 95-процентные доверительные интервалы для заболеваемости или смертности были оценены после корректировки на возраст, пол и полевой центр ARIC и после дополнительной корректировки на семейный доход, образование, курение сигарет, физическую активность, потребление алкоголя, обхват талии, холестерин липопротеинов высокой плотности. и уровень общего холестерина, диабет, систолическое артериальное давление и прием гипотензивных препаратов.Самый низкий квартиль лейкоцитов (<4800 клеток / мм 3 ) был эталонной категорией.
Инспекция графиков эмпирических кумулятивных опасностей показала, что допущение о пропорциональных опасностях было оправданным. Тенденции по количеству лейкоцитов были проверены путем обработки категорий количества лейкоцитов как порядкового номера. Кроме того, мы проверили различия в количестве лейкоцитов между расовыми и половыми группами с помощью двухфакторного дисперсионного анализа. Мы также исследовали взаимосвязь между дифференциальным количеством лейкоцитов и заболеваемостью ишемической болезнью сердца, инсультом и смертностью от сердечно-сосудистых заболеваний.Все статистические процедуры выполнялись с использованием программного обеспечения системы статистического анализа (SAS Institute, Inc., Кэри, Северная Каролина).
РЕЗУЛЬТАТЫ
В течение в среднем 8 лет наблюдения мы выявили 488 случаев ишемической болезни сердца, 220 случаев ишемического инсульта и 258 случаев смерти, закодированных как вызванные сердечно-сосудистыми заболеваниями. Как показано в таблице 1, у белых мужчин количество лейкоцитов было выше, чем у белых женщин ( p <0,001), но у афроамериканских мужчин количество лейкоцитов было таким же, как у афроамериканок ( p = 0.15). И у белых мужчин, и у белых женщин было больше лейкоцитов, чем у афроамериканских мужчин и женщин, соответственно ( p <0,001). Большинство других факторов риска различались в зависимости от пола и расы в ожидаемых направлениях и, как ранее сообщалось исследователями ARIC (13).
ТАБЛИЦА 1.Исходное количество лейкоцитов и возраст участников исследования риска атеросклероза в сообществах (ARIC) по расе и полу, 1987–1989 гг.
| Переменная . | Черные мужчины ( n = 1373) . | Белые люди ( n = 4590) . | Черные женщины ( n = 2248) . | Белые женщины ( n = 5344) . | Все испытуемые ( n = 13 555) . | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Среднее . | SD * . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | ||||||||||
| Количество лейкоцитов (× 1000 клеток / мм 3 ) | 5,5 | 1,9 | 6,4 | 1,8 | 5,6 | 1,8 | 6,1 | 1,8 | 11,8 | ||||||||||
| Возраст (лет) | 53,5 | 5,9 | 54,4 | 5,7 | 53,2 | 5,7 | 53,8 | 5,7 | 39035 9030 9030 9030 903 Переменная . | Черные мужчины ( n = 1373) . | Белые люди ( n = 4590) . | Черные женщины ( n = 2248) . | Белые женщины ( n = 5344) . | Все испытуемые ( n = 13 555) . | |||||
| Среднее . | SD * . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | ||||||||||
| Количество лейкоцитов (× 1000 клеток / мм 3 ) | 5,5 | 1,9 | 6,4 | 1,8 | 5,6 | 1,8 | 6,16,1 | ||||||||||||
| Возраст (лет) | 53,5 | 5,9 | 54,4 | 5,7 | 53,2 | 5,7 | 53,8 | 5.7 | 53,9 | 5,7 | |||||||||
Исходное количество лейкоцитов и возраст участников исследования риска атеросклероза в сообществах (ARIC), в разбивке по расе и полу, 1987–1989 гг.
| Переменная . | Черные мужчины ( n = 1373) . | Белые люди ( n = 4590) . | Черные женщины ( n = 2248) . | Белые женщины ( n = 5344) . | Все испытуемые ( n = 13 555) . | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Среднее . | SD * . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | |
| Количество лейкоцитов (× 1000 клеток / мм 3 ) | 5,5 | 1,9 | 6,4 | 1,8 | 5,6 | 1,8 | 6,16,1 | |||
| Возраст (лет) | 53,5 | 5,9 | 54,4 | 5,7 | 53,2 | 5,7 | 53,8 | 5.7 | 53,9 | 5,7 |
| Переменная . | Черные мужчины ( n = 1373) . | Белые люди ( n = 4590) . | Черные женщины ( n = 2248) . | Белые женщины ( n = 5344) . | Все испытуемые ( n = 13 555) . | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Среднее . | SD * . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | Среднее . | SD . | |
| Количество лейкоцитов (× 1000 клеток / мм 3 ) | 5.5 | 1,9 | 6,4 | 1,8 | 5,6 | 1,8 | 6,1 | 1,8 | 6,1 | 1,8 |
| Возраст (лет) | 53,5 | 39036 5,9 53,2 | 5,7 | 53,8 | 5,7 | 53,9 | 5,7 | |||
В целом наблюдалась прямая связь количества лейкоцитов с заболеваемостью ишемической болезнью сердца ( p для тенденции <0.001) и инсульта ( p для тенденции <0,001) и со смертностью от сердечно-сосудистых заболеваний ( p для тенденции <0,001) после корректировки на возраст, пол, расу и полевой центр ARIC. Связи сохранялись после дополнительной поправки на другие факторы риска (рисунок 1). У лиц с наивысшим квартилем по количеству лейкоцитов (≥7000 клеток / мм 3 ) риск возникновения ишемической болезни сердца был в 1,8 раза выше (95-процентный доверительный интервал (ДИ): 1,32, 2,43; p <0,001), 2.В 0 раз выше риск инсульта (95-процентный ДИ: 1,29, 2,99; p = 0,002) и в 2,3 раза выше риск смертности от сердечно-сосудистых заболеваний (95-процентный ДИ: 1,58, 3,44; p <0,001), как и у отдельных лиц. в категории с наименьшим количеством лейкоцитов.
РИСУНОК 1.
Относительный риск (ОР) ишемической болезни сердца (ИБС), заболеваемость и смертность от ишемического инсульта от сердечно-сосудистых заболеваний (ССЗ) по квартилям количества лейкоцитов (WBC) (самый высокий квартиль vs.самый низкий) среди участников исследования риска атеросклероза в сообществах (ARIC), 1987–1996 гг. Данные были скорректированы с учетом возраста (один год), пола, расы, полевого центра ARIC, дохода семьи, образования, курения сигарет, потребления алкоголя, физической активности, обхвата талии, уровня холестерина липопротеинов высокой плотности и общего холестерина, сахарного диабета, систолического артериального давления. , и использование гипотензивных препаратов. Бары, 95% доверительный интервал.
РИСУНОК 1.
Относительный риск (ОР) ишемической болезни сердца (ИБС) и заболеваемости ишемическим инсультом, а также смертность от сердечно-сосудистых заболеваний (ССЗ) по квартилям количества лейкоцитов (WBC) (наивысший квартиль vs.самый низкий) среди участников исследования риска атеросклероза в сообществах (ARIC), 1987–1996 гг. Данные были скорректированы с учетом возраста (один год), пола, расы, полевого центра ARIC, дохода семьи, образования, курения сигарет, потребления алкоголя, физической активности, обхвата талии, уровня холестерина липопротеинов высокой плотности и общего холестерина, сахарного диабета, систолического артериального давления. , и использование гипотензивных препаратов. Бары, 95% доверительный интервал.
Хотя не было значительного взаимодействия количества лейкоцитов с расой ( p = 0.37) или пола ( p = 0,77), мы были заинтересованы в изучении расы-специфической связи между количеством лейкоцитов и сердечно-сосудистыми заболеваниями. Таблица 2 показывает, что существует прямая связь между количеством лейкоцитов и заболеваемостью ишемической болезнью сердца как у афроамериканцев ( p для тенденции <0,001), так и у белых ( p для тенденции <0,001) после поправки на возраст, пол и ARIC. полевой центр. После дополнительной корректировки ковариат относительный риск для людей с наивысшим квартилем по количеству лейкоцитов по сравнению с самым низким составил 1.9 среди афроамериканцев (95-процентный ДИ: 1,19, 3,09) и 1,7 среди белых (95-процентный ДИ: 1,13, 2,53. Заболеваемость инсультом продемонстрировала тенденции, аналогичные таковым для заболеваемости ишемической болезнью сердца. Повышенное количество лейкоцитов было положительно связано с частотой инсульта после поправка на возраст, пол и полевой центр ARIC. Относительный риск для самого высокого квартиля количества лейкоцитов по сравнению с самым низким составлял 3,0 (95-процентный ДИ: 1,73, 5,23) у афроамериканцев и 2,7 (95-процентный ДИ: 1,55, 4,83) у афроамериканцев. Белые: эта связь сохранилась, но была ослаблена после дальнейшей корректировки на другие факторы риска.
ТАБЛИЦА 2.Относительный риск ИБС и ишемического инсульта в соответствии с квартилем количества лейкоцитов у афроамериканцев и белых: исследование риска атеросклероза в сообществах (ARIC), 1987–1996 гг.
| Заболевание и раса . | Кол-во дел . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4.8 * . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | ||||||||||||||||||
| RR † . | 95% ДИ † . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||||||||||
| Инцидентная ишемическая болезнь сердца | ||||||||||||||||||||||
| 9036 9036 9036 9036 9036 903 903 903 903 903 903 9036 | ||||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,29 | 0,84, 1,98 | 1,85 | 1,24, 2,77 | 3,25 | 2,24, 4,73 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9031,61 | 1,25 | 0,83, 1,88 | 1,69 | 1,13, 2,53 | 0,001 | ||||||||||||||||
| Черные ( n = 3,621) | 141 | 3 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,60 | 0,99, 2,58 | 1,73 | 1,06, 2,84 | 2,66 | 1,69, 4,19 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9032,20 | 1,45 | 0,87, 2,39 | 1,91 | 1,19, 3,09 | 0,009 | ||||||||||||||||
| Инцидент ишемического инсульта | 9036 ( n = 9,934) | 125 | ||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1 | 01,33 | 0,71, 2,51 | 1,17 | 0,61, 2,26 | 2,74 | 1,55, 4,83 | <0,001 | ||||||||||||||
| Многомерный скорректированный относительный риск§ | 9032,27 | 0,91 | 0,47, 1,75 | 1,86 | 1,01, 3,44 | 0,04 | ||||||||||||||||
| Черные ( n = 3,621) | 9566 | 903 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,34 | 0,72, 2,49 | 2,16 | 1,20, 3,87 | 3,01 | 1,73, 5,23 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9032,15 | 1,65 | 0,91, 3,00 | 1,86 | 1,03, 3,34 | 0,02 | ||||||||||||||||
| Заболевание и раса . | Кол-во дел . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4,8 * . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | ||||||||||||||||||
| RR † . | 95% ДИ † . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||||||||||
| Инцидентная ишемическая болезнь сердца | ||||||||||||||||||||||
| 9036 9036 9036 9036 9036 903 903 903 903 903 903 9036 | ||||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,29 | 0,84, 1,98 | 1,85 | 1,24, 2,77 | 3,25 | 2,24, 4,73 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9031,61 | 1,25 | 0,83, 1,88 | 1,69 | 1,13, 2,53 | 0,001 | ||||||||||||||||
| Черные ( n = 3,621) | 141 | 3 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,60 | 0,99, 2,58 | 1,73 | 1,06, 2,84 | 2,66 | 1,69, 4,19 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9032,20 | 1,45 | 0,87, 2,39 | 1,91 | 1,19, 3,09 | 0,009 | ||||||||||||||||
| Инцидент ишемического инсульта | 9036 ( n = 9,934) | 125 | ||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1 | 01,33 | 0,71, 2,51 | 1,17 | 0,61, 2,26 | 2,74 | 1,55, 4,83 | <0,001 | ||||||||||||||
| Многомерный скорректированный относительный риск§ | 9032,27 | 0,91 | 0,47, 1,75 | 1,86 | 1,01, 3,44 | 0,04 | ||||||||||||||||
| Черные ( n = 3,621) | 9566 | 903 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,34 | 0,72, 2,49 | 2,16 | 1,20, 3,87 | 3,01 | 1,73, 5,23 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9031,16 2,15 | 1,65 | 0,91, 3,00 | 1,86 | 1,03, 3,34 | 0,02 | ||||||||||||||||
Относительный риск ИБС и ишемического инсульта в соответствии с квартилем количества лейкоцитов у афроамериканцев и Белые: Исследование риска атеросклероза в сообществах (ARIC), 1987–1996 гг.
| Болезнь и раса . | Кол-во дел . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4,8 * . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | ||||||||||||||||||
| RR † . | 95% ДИ † . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||||||||||
| Инцидентная ишемическая болезнь сердца | ||||||||||||||||||||||
| 9036 9036 9036 9036 9036 903 903 903 903 903 903 9036 | ||||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,29 | 0,84, 1,98 | 1,85 | 1,24, 2,77 | 3,25 | 2,24, 4,73 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9031,61 | 1,25 | 0,83, 1,88 | 1,69 | 1,13, 2,53 | 0,001 | ||||||||||||||||
| Черные ( n = 3,621) | 141 | 3 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,60 | 0,99, 2,58 | 1,73 | 1,06, 2,84 | 2,66 | 1,69, 4,19 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9032,20 | 1,45 | 0,87, 2,39 | 1,91 | 1,19, 3,09 | 0,009 | ||||||||||||||||
| Инцидент ишемического инсульта | 9036 ( n = 9,934) | 125 | ||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1 | 01,33 | 0,71, 2,51 | 1,17 | 0,61, 2,26 | 2,74 | 1,55, 4,83 | <0,001 | ||||||||||||||
| Многомерный скорректированный относительный риск§ | 9032,27 | 0,91 | 0,47, 1,75 | 1,86 | 1,01, 3,44 | 0,04 | ||||||||||||||||
| Черные ( n = 3,621) | 9566 | 903 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,34 | 0,72, 2,49 | 2,16 | 1,20, 3,87 | 3,01 | 1,73, 5,23 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9032,15 | 1,65 | 0,91, 3,00 | 1,86 | 1,03, 3,34 | 0,02 | ||||||||||||||||
| Заболевание и раса . | Кол-во дел . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4,8 * . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | ||||||||||||||||||
| RR † . | 95% ДИ † . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||||||||||
| Инцидентная ишемическая болезнь сердца | ||||||||||||||||||||||
| 9036 9036 9036 9036 9036 903 903 903 903 903 903 9036 | ||||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,29 | 0,84, 1,98 | 1,85 | 1,24, 2,77 | 3,25 | 2,24, 4,73 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9031,61 | 1,25 | 0,83, 1,88 | 1,69 | 1,13, 2,53 | 0,001 | ||||||||||||||||
| Черные ( n = 3,621) | 141 | 3 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,60 | 0,99, 2,58 | 1,73 | 1,06, 2,84 | 2,66 | 1,69, 4,19 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9032,20 | 1,45 | 0,87, 2,39 | 1,91 | 1,19, 3,09 | 0,009 | ||||||||||||||||
| Инцидент ишемического инсульта | 9036 ( n = 9,934) | 125 | ||||||||||||||||||||
| Скорректированный относительный риск ‡ | 1 | 01,33 | 0,71, 2,51 | 1,17 | 0,61, 2,26 | 2,74 | 1,55, 4,83 | <0,001 | ||||||||||||||
| Многомерный скорректированный относительный риск§ | 9032,27 | 0,91 | 0,47, 1,75 | 1,86 | 1,01, 3,44 | 0,04 | ||||||||||||||||
| Черные ( n = 3,621) | 9566 | 903 | 9036 | |||||||||||||||||||
| Скорректированный относительный риск ‡ | 1.00 | 1,34 | 0,72, 2,49 | 2,16 | 1,20, 3,87 | 3,01 | 1,73, 5,23 | <0,001 | ||||||||||||||
| Многовариантный скорректированный относительный риск§ | 9031,16 2,15 | 1,65 | 0,91, 3,00 | 1,86 | 1,03, 3,34 | 0,02 | ||||||||||||||||
Рисунок 2 показывает, что смертность от сердечно-сосудистых заболеваний также увеличивалась с увеличением количества лейкоцитов как у афроамериканцев, так и у белых.После корректировки на многомерные факторы риска относительные риски смертности от сердечно-сосудистых заболеваний по категориям подсчета лейкоцитов составили 1,00 (референт), 1,15 (95-процентный ДИ: 0,67, 1,98), 1,61 (95-процентный ДИ: 0,95, 2,73) и 2,26 (95%). процентный ДИ: 1,38, 3,72) у афроамериканцев ( p для тенденции <0,001) и 1,00 (референт), 1,00 (95-процентный ДИ: 0,47, 2,10), 1,40 (95-процентный ДИ: 0,70, 2,80) и 2,22 ( 95-процентный ДИ: 1,13, 4,37) у белых ( p для тренда = 0,001).
РИСУНОК 2.
Относительный риск (ОР) смертности от сердечно-сосудистых заболеваний (ССЗ) по квартилям количества лейкоцитов (референт: самый низкий квартиль) для афроамериканцев и белых участников исследования риска атеросклероза в сообществах (ARIC), 1987–1996 гг. . Данные были скорректированы с учетом возраста (один год), пола, полевого центра ARIC, дохода семьи, образования, курения сигарет, потребления алкоголя, физической активности, обхвата талии, уровня холестерина липопротеинов высокой плотности и общего холестерина, сахарного диабета, систолического артериального давления и использование гипотензивных препаратов.Бары, 95% доверительный интервал.
РИСУНОК 2.
Относительный риск (ОР) смертности от сердечно-сосудистых заболеваний (ССЗ) по квартилям количества лейкоцитов (референт: самый низкий квартиль) для афроамериканцев и белых участников группы риска атеросклероза в сообществах (ARIC) Исследование, 1987–1996 гг. Данные были скорректированы с учетом возраста (один год), пола, полевого центра ARIC, дохода семьи, образования, курения сигарет, потребления алкоголя, физической активности, обхвата талии, уровня холестерина липопротеинов высокой плотности и общего холестерина, сахарного диабета, систолического артериального давления и использование гипотензивных препаратов.Бары, 95% доверительный интервал.
Мы также наблюдали положительную связь между количеством лейкоцитов и конечными точками сердечно-сосудистых заболеваний по категориям статуса курения (таблица 3). После корректировки на все факторы риска была обнаружена прямая связь между количеством лейкоцитов и смертностью от сердечно-сосудистых заболеваний среди нынешних курильщиков ( p для тенденции = 0,03) и среди людей, которые никогда не курили ( p для тенденции <0,001). Аналогичные закономерности наблюдались в отношении заболеваемости ишемической болезнью сердца и инсультом (таблица 3).Среди никогда не куривших полностью скорректированные относительные риски в самом высоком квартиле количества лейкоцитов (по сравнению с самым низким) составили 1,7 (95-процентный ДИ: 1,08, 2,79) для заболеваемости ишемической болезнью сердца и 1,6 (95-процентный ДИ: 0,85, 2,30) для ишемической болезни. заболеваемость инсультом.
ТАБЛИЦА 3.Многомерный относительный риск * заболеваемости ишемической болезнью сердца и ишемического инсульта, а также смертность от сердечно-сосудистых заболеваний в соответствии с квартилем количества лейкоцитов и исходным статусом курения у мужчин и женщин: риск атеросклероза в сообществах (ARIC) Исследование, 1987–1996 гг.
| Статус курения и болезнь . | Количество случаев заболевания или смерти . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4,8 † . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | |||||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | ||||||||||||
| Текущий курильщик ( n = 3,468) | 9036 903 903 9036 903 9036 9036 9036 9036 9036 903 | 0.44, 1,88 | 1,19 | 0,60, 2,33 | 1,44 | 0,76, 2,73 | 0,06 | ||||||||||
| Частота ишемического инсульта | 80 | 1,00 | 2,893 903 903 9036 9036 9036 5,28 | 3,15 | 1,07, 9,23 | 0,07 | |||||||||||
| Смертность от сердечно-сосудистых заболеваний | 97 | 1,00 | 1,14 | 0,44, 2,96 | 1.52 | 0,62, 3,70 | 2,03 | 0,88, 4,68 | 0,03 | ||||||||
| Бывший курильщик ( n = 4,282) | 903 9036 9036 9036 9036 9036 | ||||||||||||||||
| Заболеваемость ишемической болезнью сердца | 155 | 1,00 | 1,61 | 0,93, 2,78 | 1,57 | 0,90, 2,72 | 2,01 | 1.16, 3,47 | 0,02 | ||||||||
| Частота ишемического инсульта | 56 | 1,00 | 1,14 | 0,50, 2,65 | 1,23 | 0,53 0,53, 2,85 | 2,13 | 9035 9036 0,036 Смертность от сердечно-сосудистых заболеваний66 | 1,00 | 1,06 | 0,48, 2,33 | 1,16 | 0,53, 2,55 | 1,62 | 0,76, 3,45 | 0.17 | |
| Никогда не курите ( n = 5,805) | 9066 | 9066 | 0,62, 1,63 | 1,10 | 0,68, 1,78 | 1,73 | 1,08, 2,79 | 0,03 | |||||||||
| Частота ишемического инсульта | 84 | 1.00 | 0,90 | 0,47, 1,70 | 1,27 | 0,69, 2,33 | 1,59 | 0,85, 2,30 | 0,10 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 95 1.00 903 9036 | 1,57 | 0,86, 2,85 | 2,69 | 1,52, 4,78 | <0,001 | |||||||||||
| Курение и заболевание . | Количество случаев заболевания или смерти . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4,8 † . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | |||||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | ||||||||||||
| Текущий курильщик ( n = 3,468) | 9036 903 903 9036 903 9036 9036 9036 9036 9036 903 | 0.44, 1,88 | 1,19 | 0,60, 2,33 | 1,44 | 0,76, 2,73 | 0,06 | ||||||||||
| Частота ишемического инсульта | 80 | 1,00 | 2,893 903 903 9036 9036 9036 5,28 | 3,15 | 1,07, 9,23 | 0,07 | |||||||||||
| Смертность от сердечно-сосудистых заболеваний | 97 | 1,00 | 1,14 | 0,44, 2,96 | 1.52 | 0,62, 3,70 | 2,03 | 0,88, 4,68 | 0,03 | ||||||||
| Бывший курильщик ( n = 4,282) | 903 9036 9036 9036 9036 9036 | ||||||||||||||||
| Заболеваемость ишемической болезнью сердца | 155 | 1,00 | 1,61 | 0,93, 2,78 | 1,57 | 0,90, 2,72 | 2,01 | 1.16, 3,47 | 0,02 | ||||||||
| Частота ишемического инсульта | 56 | 1,00 | 1,14 | 0,50, 2,65 | 1,23 | 0,53 0,53, 2,85 | 2,13 | 9035 9036 0,036 Смертность от сердечно-сосудистых заболеваний66 | 1,00 | 1,06 | 0,48, 2,33 | 1,16 | 0,53, 2,55 | 1,62 | 0,76, 3,45 | 0.17 | |
| Никогда не курите ( n = 5,805) | 9066 | 9066 | 0,62, 1,63 | 1,10 | 0,68, 1,78 | 1,73 | 1,08, 2,79 | 0,03 | |||||||||
| Частота ишемического инсульта | 84 | 1.00 | 0,90 | 0,47, 1,70 | 1,27 | 0,69, 2,33 | 1,59 | 0,85, 2,30 | 0,10 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 95 1.00 903 9036 | 1,57 | 0,86, 2,85 | 2,69 | 1,52, 4,78 | <0,001 | |||||||||||
Многофакторный относительный риск * ишемической болезни сердца и заболеваемости ишемическим инсультом, а также смертность от сердечно-сосудистых заболеваний количества лейкоцитов и исходного статуса курения у мужчин и женщин: Исследование риска атеросклероза в сообществах (ARIC), 1987–1996 гг.
| Статус курения и болезнь . | Количество случаев заболевания или смерти . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4,8 † . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | |||||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | ||||||||||||
| Текущий курильщик ( n = 3,468) | 9036 903 903 9036 903 9036 9036 9036 9036 9036 903 | 0.44, 1,88 | 1,19 | 0,60, 2,33 | 1,44 | 0,76, 2,73 | 0,06 | ||||||||||
| Частота ишемического инсульта | 80 | 1,00 | 2,893 903 903 9036 9036 9036 5,28 | 3,15 | 1,07, 9,23 | 0,07 | |||||||||||
| Смертность от сердечно-сосудистых заболеваний | 97 | 1,00 | 1,14 | 0,44, 2,96 | 1.52 | 0,62, 3,70 | 2,03 | 0,88, 4,68 | 0,03 | ||||||||
| Бывший курильщик ( n = 4,282) | 903 9036 9036 9036 9036 9036 | ||||||||||||||||
| Заболеваемость ишемической болезнью сердца | 155 | 1,00 | 1,61 | 0,93, 2,78 | 1,57 | 0,90, 2,72 | 2,01 | 1.16, 3,47 | 0,02 | ||||||||
| Частота ишемического инсульта | 56 | 1,00 | 1,14 | 0,50, 2,65 | 1,23 | 0,53 0,53, 2,85 | 2,13 | 9035 9036 0,036 Смертность от сердечно-сосудистых заболеваний66 | 1,00 | 1,06 | 0,48, 2,33 | 1,16 | 0,53, 2,55 | 1,62 | 0,76, 3,45 | 0.17 | |
| Никогда не курите ( n = 5,805) | 9066 | 9066 | 0,62, 1,63 | 1,10 | 0,68, 1,78 | 1,73 | 1,08, 2,79 | 0,03 | |||||||||
| Частота ишемического инсульта | 84 | 1.00 | 0,90 | 0,47, 1,70 | 1,27 | 0,69, 2,33 | 1,59 | 0,85, 2,30 | 0,10 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 95 1.00 903 9036 | 1,57 | 0,86, 2,85 | 2,69 | 1,52, 4,78 | <0,001 | |||||||||||
| Курение и заболевание . | Количество случаев заболевания или смерти . | Квартиль количества лейкоцитов (× 1000 клеток / мм 3 ) . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <4,8 † . | 4,8– <5,8 . | 5,8– <7,0 . | ≥7,0 . | p для тренда . | |||||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | ||||||||||||
| Текущий курильщик ( n = 3,468) | 9036 903 903 9036 903 9036 9036 9036 9036 9036 903 | 0.44, 1,88 | 1,19 | 0,60, 2,33 | 1,44 | 0,76, 2,73 | 0,06 | ||||||||||
| Частота ишемического инсульта | 80 | 1,00 | 2,893 903 903 9036 9036 9036 5,28 | 3,15 | 1,07, 9,23 | 0,07 | |||||||||||
| Смертность от сердечно-сосудистых заболеваний | 97 | 1,00 | 1,14 | 0,44, 2,96 | 1.52 | 0,62, 3,70 | 2,03 | 0,88, 4,68 | 0,03 | ||||||||
| Бывший курильщик ( n = 4,282) | 903 9036 9036 9036 9036 9036 | ||||||||||||||||
| Заболеваемость ишемической болезнью сердца | 155 | 1,00 | 1,61 | 0,93, 2,78 | 1,57 | 0,90, 2,72 | 2,01 | 1.16, 3,47 | 0,02 | ||||||||
| Частота ишемического инсульта | 56 | 1,00 | 1,14 | 0,50, 2,65 | 1,23 | 0,53 0,53, 2,85 | 2,13 | 9035 9036 0,036 Смертность от сердечно-сосудистых заболеваний66 | 1,00 | 1,06 | 0,48, 2,33 | 1,16 | 0,53, 2,55 | 1,62 | 0,76, 3,45 | 0.17 | |
| Никогда не курите ( n = 5,805) | 9066 | 9066 | 0,62, 1,63 | 1,10 | 0,68, 1,78 | 1,73 | 1,08, 2,79 | 0,03 | |||||||||
| Частота ишемического инсульта | 84 | 1.00 | 0,90 | 0,47, 1,70 | 1,27 | 0,69, 2,33 | 1,59 | 0,85, 2,30 | 0,10 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 95 1.00 903 9036 | 1,57 | 0,86, 2,85 | 2,69 | 1,52, 4,78 | <0,001 | |||||||||||
Мы дополнительно исследовали связь между дифференциальным количеством лейкоцитов и заболеваемостью или смертностью.Как показано в таблице 4, связь между количеством лейкоцитов и конечными точками исследования была наиболее сильной для гранулоцитов, несколько более слабой для моноцитов и слабой и не независимой от других факторов риска для лимфоцитов.
ТАБЛИЦА 4.Многомерный относительный риск * заболеваемости ишемической болезнью сердца и ишемического инсульта, а также смертность от сердечно-сосудистых заболеваний, согласно дифференциальному количеству лейкоцитов у мужчин и женщин: Исследование риска атеросклероза в сообществах (ARIC), 1987–1996 гг.
| Тип клеток и заболевание . | Квартиль дифференциального количества лейкоцитов . | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 † . | 2 . | 3 . | 4 . | p для тренда . | ||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||
| Квартиль количества гранулоцитов (× 1000 клеток / мм 3 ) | ||||||||||||||
| <2,6 | 2,6– <3,4 | 13 ≥4,5 | ||||||||||||
| Гранулоциты | ||||||||||||||
| 1 9036 Заболеваемость ишемической болезнью сердца.00 | 1,07 | 0,79, 1,45 | 1,04 | 0,77, 1,39 | 1,45 | 1,10, 1,92 | 0,001 | |||||||
| Заболеваемость ишемическим инсультом 9066 | 1,003 1,003 | 9066 9066 | 1,003 | 0,85, 1,99 | 1,87 | 1,25, 2,79 | 0,006 | |||||||
| Смертность от сердечно-сосудистых заболеваний | 1,00 | 1,59 | 1,08, 2.35 | 1,37 | 0,91, 2,05 | 2,50 | 1,75, 3,58 | <0,001 | ||||||
| Квартиль количества моноцитов (× 1000 клеток / мм 3 ) | 9036 903 <0,24 0,24– <0,33 | 0,33– <0,44 | ≥0,44 | |||||||||||
| Моноциты | 6 | 903 | 903 9036 Заболеваемость сердечными заболеваниями | 1.00 | 0,81 | 0,60, 1,10 | 1,16 | 0,89, 1,51 | 1,25 | 0,97, 1,60 | 0,02 | |||
| Частота ишемического инсульта 9066 | 1,003 1,03 903 9036 9066 | 1,003 1,03 903 | 0,82, 1,87 | 1,68 | 1,17, 2,43 | 0,004 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 1,00 | 0,85 | 0,56, 1.27 | 0,98 | 0,67, 1,44 | 1,40 | 1,01, 1,96 | 0,04 | ||||||
| Квартиль количества лимфоцитов (× 1000 клеток / мм 3 ) | 9036 903 1,5 1,5– <1,9 | 1,9– <2,3 | ≥2,3 | |||||||||||
| Лимфоциты | 9066 9036 | 9036 9036 9036 9036 Заболеваемость | 1.00 | 0,86 | 0,65, 1,13 | 0,96 | 0,73, 1,26 | 0,99 | 0,76, 1,29 | 0,90 | ||||
| Заболеваемость ишемическим инсультом 9066 1,136 | 1,003 903 | 9066 9036 | 1,003 903 | 0,62, 1,48 | 1,33 | 0,90, 1,95 | 0,23 | |||||||
| Смертность от сердечно-сосудистых заболеваний | 1,00 | 1,60 | 1,10, 2.32 | 1,23 | 0,82, 1,83 | 1,39 | 0,96, 2,01 | 0,24 | ||||||
| Тип клеток и заболевание . | Квартиль дифференциального количества лейкоцитов . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 † . | 2 . | 3 . | 4 . | p для тренда . | ||||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||||
| Квартиль количества гранулоцитов (× 1000 клеток / мм 3 ) | ||||||||||||||||
| <2,6 | 2,6– <3,4 | 13.5 | ≥4,5 | |||||||||||||
| Гранулоциты | сердце | 9036 903 9036 903 | 1,04 | 0,77, 1,39 | 1,45 | 1,10, 1,92 | 0,001 | |||||||||
| Частота ишемического инсульта | 1.00 | 1,49 | 0,98, 2,26 | 1,30 | 0,85, 1,99 | 1,87 | 1,25, 2,79 | 0,006 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 1,536 1,03 | 0,91, 2,05 | 2,50 | 1,75, 3,58 | <0,001 | |||||||||||
| Квартиль количества моноцитов (× 1000 клеток / мм 3 ) | 0,24– <0,33 | 0,33– <0,44 | ≥0,44 | |||||||||||||
| Моноциты | 903 903 9036 9036 9036 9036 заболеваемость | 1,00 | 0,81 | 0,60, 1,10 | 1,16 | 0,89, 1,51 | 1,25 | 0,97, 1,60 | 0.02 | |||||||
| Заболеваемость ишемическим инсультом | 1,00 | 1,08 | 0,70, 1,66 | 1,23 | 0,82, 1,87 | 1,68 | 1,17, 2,43 | 0,003 | 9036 9036 Смертность от сердечно-сосудистых заболеваний | 0,85 | 0,56, 1,27 | 0,98 | 0,67, 1,44 | 1,40 | 1,01, 1,96 | 0,04 |
| 903 | ||||||||||||||||
| <1.5 | 1,5– <1,9 | 1,9– <2,3 | ≥2,3 | |||||||||||||
| Лимфоциты | 9066 9036 | 9036 9036 9036 9036 заболеваемость | 1,00 | 0,86 | 0,65, 1,13 | 0,96 | 0,73, 1,26 | 0,99 | 0,76, 1,29 | 0.90 | ||||||
| Частота ишемического инсульта | 1,00 | 1,14 | 0,76, 1,71 | 0,96 | 0,62, 1,48 | 1,33 | 0,90, 1,95 | 0,23 | 9036 9036 Смертность от сердечно-сосудистых заболеваний 1,60 | 1,10, 2,32 | 1,23 | 0,82, 1,83 | 1,39 | 0,96, 2,01 | 0,24 | |
Многомерный относительный риск * ишемической болезни сердца и заболеваемости ишемической болезнью сердца сердечно-сосудистые заболевания, согласно дифференциальному количеству лейкоцитов у мужчин и женщин: Исследование риска атеросклероза в сообществах (ARIC), 1987–1996 гг.
| Тип клеток и заболевание . | Квартиль дифференциального количества лейкоцитов . | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 † . | 2 . | 3 . | 4 . | p для тренда . | ||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||
| Квартиль количества гранулоцитов (× 1000 клеток / мм 3 ) | ||||||||||||||
| <2,6 | 2,6– <3,4 | 13 ≥4,5 | ||||||||||||
| Гранулоциты | ||||||||||||||
| 1 9036 Заболеваемость ишемической болезнью сердца.00 | 1,07 | 0,79, 1,45 | 1,04 | 0,77, 1,39 | 1,45 | 1,10, 1,92 | 0,001 | |||||||
| Заболеваемость ишемическим инсультом 9066 | 1,003 1,003 | 9066 9066 | 1,003 | 0,85, 1,99 | 1,87 | 1,25, 2,79 | 0,006 | |||||||
| Смертность от сердечно-сосудистых заболеваний | 1,00 | 1,59 | 1,08, 2.35 | 1,37 | 0,91, 2,05 | 2,50 | 1,75, 3,58 | <0,001 | ||||||
| Квартиль количества моноцитов (× 1000 клеток / мм 3 ) | 9036 903 <0,24 0,24– <0,33 | 0,33– <0,44 | ≥0,44 | |||||||||||
| Моноциты | 6 | 903 | 903 9036 Заболеваемость сердечными заболеваниями | 1.00 | 0,81 | 0,60, 1,10 | 1,16 | 0,89, 1,51 | 1,25 | 0,97, 1,60 | 0,02 | |||
| Частота ишемического инсульта 9066 | 1,003 1,03 903 9036 9066 | 1,003 1,03 903 | 0,82, 1,87 | 1,68 | 1,17, 2,43 | 0,004 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 1,00 | 0,85 | 0,56, 1.27 | 0,98 | 0,67, 1,44 | 1,40 | 1,01, 1,96 | 0,04 | ||||||
| Квартиль количества лимфоцитов (× 1000 клеток / мм 3 ) | 9036 903 1,5 1,5– <1,9 | 1,9– <2,3 | ≥2,3 | |||||||||||
| Лимфоциты | 9066 9036 | 9036 9036 9036 9036 Заболеваемость | 1.00 | 0,86 | 0,65, 1,13 | 0,96 | 0,73, 1,26 | 0,99 | 0,76, 1,29 | 0,90 | ||||
| Заболеваемость ишемическим инсультом 9066 1,136 | 1,003 903 | 9066 9036 | 1,003 903 | 0,62, 1,48 | 1,33 | 0,90, 1,95 | 0,23 | |||||||
| Смертность от сердечно-сосудистых заболеваний | 1,00 | 1,60 | 1,10, 2.32 | 1,23 | 0,82, 1,83 | 1,39 | 0,96, 2,01 | 0,24 | ||||||
| Тип клеток и заболевание . | Квартиль дифференциального количества лейкоцитов . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 † . | 2 . | 3 . | 4 . | p для тренда . | ||||||||||||
| RR ‡ . | 95% ДИ ‡ . | руб. . | 95% ДИ . | руб. . | 95% ДИ . | |||||||||||
| Квартиль количества гранулоцитов (× 1000 клеток / мм 3 ) | ||||||||||||||||
| <2,6 | 2,6– <3,4 | 13.5 | ≥4,5 | |||||||||||||
| Гранулоциты | сердце | 9036 903 9036 903 | 1,04 | 0,77, 1,39 | 1,45 | 1,10, 1,92 | 0,001 | |||||||||
| Частота ишемического инсульта | 1.00 | 1,49 | 0,98, 2,26 | 1,30 | 0,85, 1,99 | 1,87 | 1,25, 2,79 | 0,006 | ||||||||
| Смертность от сердечно-сосудистых заболеваний | 1,536 1,03 | 0,91, 2,05 | 2,50 | 1,75, 3,58 | <0,001 | |||||||||||
| Квартиль количества моноцитов (× 1000 клеток / мм 3 ) | 0,24– <0,33 | 0,33– <0,44 | ≥0,44 | |||||||||||||
| Моноциты | 903 903 9036 9036 9036 9036 заболеваемость | 1,00 | 0,81 | 0,60, 1,10 | 1,16 | 0,89, 1,51 | 1,25 | 0,97, 1,60 | 0.02 | |||||||
| Заболеваемость ишемическим инсультом | 1,00 | 1,08 | 0,70, 1,66 | 1,23 | 0,82, 1,87 | 1,68 | 1,17, 2,43 | 0,003 | 9036 9036 Смертность от сердечно-сосудистых заболеваний | 0,85 | 0,56, 1,27 | 0,98 | 0,67, 1,44 | 1,40 | 1,01, 1,96 | 0,04 |
| 903 | ||||||||||||||||
| <1.5 | 1,5– <1,9 | 1,9– <2,3 | ≥2,3 | |||||||||||||
| Лимфоциты | 9066 9036 | 9036 9036 9036 9036 заболеваемость | 1,00 | 0,86 | 0,65, 1,13 | 0,96 | 0,73, 1,26 | 0,99 | 0,76, 1,29 | 0.90 | ||||||
| Частота ишемического инсульта | 1,00 | 1,14 | 0,76, 1,71 | 0,96 | 0,62, 1,48 | 1,33 | 0,90, 1,95 | 0,23 | 9036 Смертность от сердечно-сосудистых заболеваний | 9036 9036 1,60 | 1,10, 2,32 | 1,23 | 0,82, 1,83 | 1,39 | 0,96, 2,01 | 0,24 |
ОБСУЖДЕНИЕ
Хотя повышенное количество лейкоцитов считается маркером риска сердечно-сосудистых заболеваний и смертности (3–11), исследования этой связи у афроамериканцев проводились мало.Нашим основным открытием было то, что повышенное количество лейкоцитов напрямую связано с риском ишемической болезни сердца, а также с заболеваемостью инсультом и смертностью от сердечно-сосудистых заболеваний у афроамериканцев. Заболеваемость ишемической болезнью сердца была в 1,9 раза выше у афроамериканцев с количеством лейкоцитов ≥7000 клеток / мм 3 , чем у людей с количеством клеток <4800 клеток / мм 3 , после поправки на несколько факторов риска. Подобная ассоциация была у белых. Этот результат согласуется с результатами последующего эпидемиологического исследования NHANES I (7), в котором афроамериканцы с количеством лейкоцитов> 7000 клеток / мм 3 имели вдвое большую заболеваемость ишемической болезнью сердца, чем те, у которых количество лейкоцитов <5500 клеток. / мм 3 .Мы также наблюдали положительную связь между количеством лейкоцитов и частотой ишемического инсульта у афроамериканцев, и, насколько нам известно, это первый проспективный отчет о такой связи. Это исследование также показало прямую связь количества лейкоцитов со смертностью от сердечно-сосудистых заболеваний у афроамериканцев с относительным риском 2,3 для наивысшего квартиля количества лейкоцитов после поправки на несколько факторов риска. Этот результат несколько отличается от результатов последующего эпидемиологического исследования NHANES I, которое показало лишь слабую связь между количеством лейкоцитов и смертностью от сердечно-сосудистых заболеваний у афроамериканцев после поправки на несколько факторов риска (7).
В нашем исследовании зависимость доза-ответ между количеством лейкоцитов и смертностью от сердечно-сосудистых заболеваний сохранялась с поправкой или стратификацией для курения сигарет и без них. Хотя курение сигарет увеличивает количество лейкоцитов и пул фагоцитов (1), исследования не всегда наблюдали положительную связь между количеством лейкоцитов и смертностью от ишемической болезни сердца как у курильщиков, так и у некурящих (3, 7, 9, 10). Наше открытие сильных ассоциаций среди никогда не куривших предполагает, что более высокое количество лейкоцитов является фактором риска сердечно-сосудистых заболеваний независимо от курения.
Вероятно, что повышенное количество лейкоцитов может усилить атерогенез. Считается, что гранулоциты и моноциты участвуют в патогенезе атеросклероза. Макрофаги, происходящие из моноцитов, продуцируют оксиданты, которые могут вызывать повреждение эндотелиальных клеток и последующее образование тромба (2). Активированные лейкоциты также отражают воспалительную активность атеросклероза, которая способствует повреждению сосудов и ишемии тканей (1).
В некоторых исследованиях сообщается, что количество лейкоцитов связано с несколькими факторами риска сердечно-сосудистых заболеваний.Эти результаты включают положительные ассоциации с массой тела, систолическим артериальным давлением, курением сигарет, уровнем глюкозы натощак и уровнем инсулина натощак, а также отрицательные ассоциации с уровнем холестерина липопротеинов высокой плотности, семейным доходом, потреблением алкоголя и физической активностью или физической подготовкой (12–14 ). Наши данные показывают, что, хотя у афроамериканцев менее благоприятный профиль факторов риска сердечно-сосудистых заболеваний, у них меньше лейкоцитов, чем у белых (таблица 1). У афроамериканцев более низкое количество нейтрофилов и больше лимфоцитов, чем у белых (22).Необходимы дальнейшие исследования, чтобы определить, связаны ли различия в образе жизни с изменчивостью лейкоцитов в разных расовых и половых группах.
Сильной стороной этого исследования является то, что афроамериканцы были набраны из двух общин США; наше исследование представляет собой крупнейшее когортное исследование количества лейкоцитов и сердечно-сосудистых заболеваний среди афроамериканцев, которое когда-либо проводилось. Самым большим недостатком нашего исследования является то, что большинство афроамериканцев были из одного сообщества и что у нас не было измерений С-реактивного белка, специфического маркера воспаления, который также связан с сердечно-сосудистыми заболеваниями (23, 24).Независимая роль количества лейкоцитов по сравнению с С-реактивным белком в прогнозировании сердечно-сосудистых заболеваний должна быть уточнена, и, насколько нам известно, С-реактивный белок не изучался у афроамериканцев.
В заключение мы обнаружили, что повышенное количество лейкоцитов является фактором риска ишемической болезни сердца, заболеваемости ишемическим инсультом и смертности от сердечно-сосудистых заболеваний у афроамериканцев. Несмотря на более низкое количество лейкоцитов среди афроамериканцев, наши данные свидетельствуют о том, что воспаление играет аналогичную роль в атеросклеротическом сердечно-сосудистом заболевании у афроамериканцев и белых.
Исследование риска атеросклероза в сообществах (ARIC) было поддержано контрактами Национального института сердца, легких и крови NO1-HC-55015, NO1-HC-55016, NO1-HC-55018, NO1-HC-55019, NO1-HC -55020, NO1-HC-55021 и NO1-HC-55022. Доктор Чонг До Ли был поддержан грантом HL07779-06 Национального института здоровья на обучение.
Авторы благодарят сотрудников ARIC Study за их важный вклад.
ССЫЛКИ
1.Ernst E, Hammerschmidt DE, Bagge U, et al.Лейкоциты и риск ишемических заболеваний.
JAMA
1987
;257
:2318
–24.2.Fuster V, Lewis A. Механизмы, приводящие к инфаркту миокарда — выводы из исследований биологии сосудов.
Тираж
1994
;90
:2126
–46.3.Каннель В.Б., Андерсон К., Уилсон П.В. Количество лейкоцитов и сердечно-сосудистые заболевания: выводы из исследования Framingham.
JAMA
1992
;267
:1253
–6.4.Залокар Дж. Б., Ричард Дж. Л., Клод Дж. Р.. Подсчет лейкоцитов, курение и инфаркт миокарда.
N Engl J Med
1981
;304
:465
–8,5.Prentice RL, Szatrowski TP, Fujikura T, et al. Подсчет лейкоцитов и ишемическая болезнь сердца в когорте японцев.
Am J Epidemiol
1982
;116
:496
–509,6.Фолсом А.Р., Ву К.К., Розамонд В.Д. и др. Проспективное исследование гемостатических факторов и заболеваемости ишемической болезнью сердца: исследование риска атеросклероза в сообществах (ARIC).
Тираж
1997
;96
:1102
–8.7.Gillum RF, Ingram DD, Makuc DM. Количество лейкоцитов, ишемическая болезнь сердца и смерть: последующее эпидемиологическое исследование NHANES I.
Am Heart J
1993
;125
:855
–63,8.Фридман Г.Д., Клацкий А.Л., Зигелауб А.Б. Количество лейкоцитов как предиктор инфаркта миокарда.
N Engl J Med
1974
;290
:1275
–8.9.Grimm RH, Neaton JD, Ludwig W. Прогностическое значение количества лейкоцитов в отношении коронарной, онкологической и общей смертности.
JAMA
1985
;254
:1932
–7.10.Вейенберг М.П., Фескенс Э.Дж., Кромхаут Д. Количество лейкоцитов и риск ишемической болезни сердца и общей смертности у пожилых мужчин.
Артериосклер Тромб Васк Биол
1996
;16
:499
–503.11.De Labry LO, Campion EW, Glynn RJ, et al.Количество лейкоцитов как предиктор смертности: результаты исследования нормативного старения за 18 лет.
J Clin Epidemiol
1990
;43
:153
–7.12.Хансен Л.К., Гримм Р.Х., Нитон Дж. Д.. Связь количества лейкоцитов с другими факторами риска сердечно-сосудистых заболеваний.
Int J Epidemiol
1990
;19
:881
–8,13.Nieto FJ, Szklo M, Folsom AR, et al. Количество лейкоцитов коррелирует у взрослых среднего возраста: исследование риска атеросклероза в сообществах (ARIC).
Am J Epidemiol
1992
;136
:525
–37,14.Friedman GD, Tekawa I, Grimm RH, et al. Подсчет лейкоцитов: коррелирует и взаимосвязь с факторами риска коронарных артерий. Исследование CARDIA.
Int J Epidemiol
1990
;19
:889
–93,15.Исследователи ARIC. Исследование риска атеросклероза в сообществах (ARIC): дизайн и цели.
Am J Epidemiol
1989
;129
:687
–702.16.Papp AC, Hatzakis H, Bracey A, et al. Исследование гемостаза ARIC. I. Разработка системы сбора и обработки крови, подходящей для многоцентровых гемостатических исследований.
Thromb Haemost
1989
;61
:15
–19.17.Baecke JA, Burema J, Frijters JE. Краткая анкета для измерения привычной физической активности в эпидемиологических исследованиях.
Am J Clin Nutr
1982
;36
:936
–42.18.Prineas RJ, Crow RS, Blackburn H. Руководство по электрокардиографическим данным Миннесотского кодекса: стандарты и процедуры измерения и классификации. Литтлтон, Массачусетс: John Wright-PSG, Inc., 1982.
19.White AD, Folsom AR, Chambless LE и др. Общественный надзор за ишемической болезнью сердца в исследовании риска атеросклероза в сообществах (ARIC): методы и начальный двухлетний опыт.
J Clin Epidemiol
1996
;49
:223
–33.20.Розамонд В.Д., Фолсом А.Р., Чамблесс Л.Е. и др. Заболеваемость инсультом и выживаемость среди взрослых среднего возраста: 9-летнее наблюдение когорты риска атеросклероза в сообществах (ARIC).
Ход
1999
;30
:736
–43.21.Cox DR. Регрессионные модели и таблицы дожития (с обсуждением).
J R Stat Soc B
1972
;34
:187
–220.22.McGrath CR, Hitchcock DC, Van Assendelft OW. Общее количество лейкоцитов у людей в возрасте от 1 до 74 лет с дифференциальным количеством лейкоцитов у взрослых в возрасте от 25 до 74 лет.(Статистика естественного движения населения и здоровья, серия 11, № 220). Хяттсвилл, Мэриленд: Национальный центр статистики здравоохранения, 1982.
23.Ридкер П.М., Кушман М., Стампфер М.Дж. и др. Воспаление, аспирин и риск сердечно-сосудистых заболеваний у практически здоровых мужчин.
N Engl J Med
1997
;336
:973
–9,24.Ридкер П.М., Беринг Дж. Э., Ши Дж. И др. Проспективное исследование С-реактивного белка и риска сердечно-сосудистых событий в будущем среди практически здоровых женщин.
Тираж
1998
;98
:731
–3.Профилактика сердечных заболеваний и инсульта
Сердечно-сосудистые заболевания (ССЗ) относится к нескольким типам заболеваний, поражающих сердце и кровеносные сосуды. Сердечно-сосудистые заболевания включают ишемическую болезнь сердца (ИБС), инсульт, сердечную недостаточность и другие состояния, поражающие сердце и кровеносные сосуды.
Болезнь сердца — это термин, обозначающий несколько типов сердечных заболеваний, в том числе ИБС, сердечные клапаны и застойную сердечную недостаточность.Самый распространенный вид сердечных заболеваний — это ИБС. ИБС возникает, когда накапливается вещество, называемое бляшками, которое сужает артерии в сердце. Сердечный приступ возникает, когда артерия полностью блокируется, что приводит к недостаточному притоку крови к сердцу. Болезни сердца — основная причина смерти как мужчин, так и женщин в Соединенных Штатах и в штате Нью-Йорк. Чтобы узнать больше о сердечных заболеваниях и о том, что вы можете сделать, чтобы снизить риск, посетите Центры по контролю и профилактике заболеваний (CDC).
Инсульт , также называемый мозговым приступом, возникает, когда кровоснабжение мозга блокируется или кровеносный сосуд в мозге лопается.Инсульт является четвертой и пятой по значимости причиной смерти в штате Нью-Йорк и США, соответственно, и причиной значительной инвалидности. Чтобы узнать больше об инсульте и о том, что вы можете сделать, чтобы снизить риск инсульта, посетите Американскую ассоциацию по инсульту. Чтобы узнать, что делает штат Нью-Йорк для предотвращения инсультов и улучшения ухода за перенесшими инсульт жителями Нью-Йорка, посетите Программу улучшения качества регистрации инсультов Коверделла штата Нью-Йорк.
Болезни сердца в США
- Ежегодно в США от болезней сердца умирает около 655 000 человек — это 1 из каждых 4 смертей.
- Ишемическая болезнь сердца (ИБС) — наиболее распространенный вид сердечных заболеваний, от которого ежегодно умирает около 366 000 человек.
- Ежегодно около 805 000 американцев страдают сердечным приступом. Из них 605 000 — это первый сердечный приступ, а 200 000 — у людей, которые уже перенесли сердечный приступ.
- Чтобы узнать больше о сердечных заболеваниях и их влиянии в Соединенных Штатах, посетите CDC’s Heart Disease Facts.
Сердечно-сосудистые заболевания в штате Нью-Йорк
- На сердечно-сосудистые заболевания приходилось 35% всех смертей в штате в 2018 году (BRFSS 2018).
- По оценкам, 7,8% взрослых в штате Нью-Йорк сообщили, что в 2018 году у них был сердечный приступ, стенокардия / ишемическая болезнь сердца или инсульт.
- Каждый пятый (20%) житель Нью-Йорка в возрасте 65 лет и старше сообщил, что в 2018 году у него был какой-либо тип ССЗ.
- Чтобы получить дополнительные данные о сердечных заболеваниях и инсульте в штате Нью-Йорк, посетите страницу «Данные и статистика сердечно-сосудистых заболеваний».
Статистика инсульта в США
- Ежегодно более 795 000 человек в США страдают инсультом.
- Инсульт убивает почти 147 810 американцев каждый год — это 1 из каждых 20 смертей.
Статистика инсульта в штате Нью-Йорк
Ишемическая болезнь сердца CAD — ишемическая болезнь сердца
Ишемическая болезнь сердца, также называемая ишемической болезнью сердца, возникает, когда основные кровеносные сосуды сердца сужаются и становятся жесткими. Это может вызвать сердечные приступы и стенокардию. Прочтите о его симптомах, причинах и лечении.
Ишемическая болезнь сердца (ИБС) — наиболее распространенный вид сердечных заболеваний.Более 170 000 человек в Новой Зеландии болеют этим заболеванием, и это основная причина сердечных приступов и стенокардии.
Иногда можно услышать ишемическую болезнь сердца, называемую другими названиями, например, ишемическая болезнь сердца (ИБС) или ишемическая болезнь сердца (ИБС). Иногда это просто болезнь сердца. Это просто разные термины для одного и того же состояния.
Что такое ишемическая болезнь сердца?
Коронарные артерии — это кровеносные сосуды, по которым насыщенная кислородом кровь поступает в сердечную мышцу, чтобы поддерживать ее работу.
Ишемическая болезнь сердца возникает, когда в этих артериях накапливается жировой материал (бляшка).
Эти полосы жировой ткани заставляют артерии сужаться и становиться жесткими. Клинический термин для этого — атеросклероз .
По мере сужения артерий крови становится труднее достичь сердечной мышцы. Иногда это вызывает боль или дискомфорт, называемые стенокардией.
Если кусок налета треснет, это может вызвать образование тромба. Это останавливает попадание крови в часть сердечной мышцы.Это сердечный приступ (или инфаркт миокарда).
Узнайте о том, как работает сердцеИшемическая болезнь сердца — это то же самое, что и сердечно-сосудистые заболевания?
Ишемическая болезнь сердца — это разновидность сердечно-сосудистых заболеваний (ССЗ).
Сердечно-сосудистые заболевания — это любое заболевание или состояние, затрагивающее сердце и / или кровеносные сосуды.
Он включает в себя множество различных состояний, таких как:
- ишемическая болезнь сердца
- инсульт
- проблемы с сердечным клапаном
- сердечная недостаточность
- кардиомиопатия
- врожденные пороки сердца.
Симптомы ишемической болезни сердца
Вы можете не знать, что у вас ИБС, потому что она не всегда вызывает симптомы. Сужение артерий может вызвать боль и дискомфорт. Часто это происходит, когда ваше сердце работает усерднее, например, когда вы поднимаетесь на холм или поднимаетесь по лестнице. Симптомы могут включать:
- необычная одышка, например, в состоянии покоя или при очень легкой физической активности
- дискомфорт, тяжесть или стеснение в груди, которые могут распространяться на спину, плечи, шею или челюсть.Другие люди описывают это как тупую боль
- дискомфорт в руке, шее или челюсти без дискомфорта в груди.
Дискомфорт может варьироваться от легкого или тупого до сильного. Иногда люди обнаруживают, что у них ишемическая болезнь сердца, только когда она вызывает сердечный приступ.
Каковы признаки сердечного приступа?Причины и факторы риска
Существует ряд факторов, повышающих вероятность развития ишемической болезни сердца. Эти вещи называются факторами риска.
Некоторые факторы риска вы не можете контролировать (неконтролируемые факторы риска), но другие вы можете контролировать с помощью изменения образа жизни и приема лекарств (контролируемые факторы риска).
Контролируемые факторы риска включают:
- курение — курение повреждает слизистую оболочку ваших артерий, увеличивая скопление жировых отложений, которые сужают артерию. Это также увеличивает вероятность свертывания крови.
- холестерин — высокий уровень холестерина увеличивает скорость накопления жировых отложений в артериях.
- кровяное давление — со временем высокое кровяное давление может повредить ваши артерии.
- диабет — диабет увеличивает риск ишемической болезни сердца и повышает вероятность сердечного приступа или инсульта. Хотя вы, возможно, не сможете предотвратить свой диабет, контроль вашего состояния может помочь вам снизить риск сердечного приступа и инсульта.
- упражнения — всего 30 минут умеренной активности в день могут снизить риск ИБС.
- вес — здоровый вес помогает снизить риск ишемической болезни сердца.
- диета — здоровая для сердца диета обеспечивает ваш организм наилучшими питательными веществами, а также помогает вам поддерживать здоровый вес.
- стресс / тревога — длительный стресс может увеличить риск сердечного приступа и инсульта. Узнайте, как справляться со стрессом.
- потребление алкоголя — чрезмерное употребление алкоголя или запой может увеличить риск сердечных заболеваний.
К неконтролируемым факторам риска относятся:
- возраст — ваш риск ИБС увеличивается с возрастом
- пол — мужчины с большей вероятностью заболеют ИБС в более раннем возрасте, чем женщины.Однако риск женщин увеличивается после прекращения менструации
- этническая принадлежность — люди из определенных этнических групп, такие как маори, пасифика и выходцы из стран Южной Азии, подвержены более высокому риску сердечных заболеваний
- история психического здоровья — люди с тяжелым психическим заболеванием подвержены более высокому риску сердечных заболеваний, чем население в целом
- семейный анамнез — вы подвергаетесь большему риску сердечных заболеваний, если у близкого родственника было диагностировано сердечное заболевание в возрасте до 50 лет.
Каков мой личный риск развития ишемической болезни сердца?
Важно, чтобы вы знали свой собственный уровень риска и в каком возрасте вам следует пройти проверку сердца.
Как мне узнать свой риск?Осложнения
Ишемическая болезнь сердца может привести к ряду других сердечных заболеваний, в том числе:
Если вам поставили диагноз ИБС, спросите своего врача, как вы можете снизить риск развития этих осложнений.
Как диагностируется ИБС?
Врачи диагностируют ваше состояние с помощью ряда тестов.Они будут зависеть от:
- насколько высок ваш риск
- ваших симптомов
- любых осложнений, которые у вас были, например, сердечного приступа.
Общие тесты включают:
Лечение
Ишемическую болезнь сердца нельзя вылечить, но есть способы предотвратить ее ухудшение. Ваше лечение будет зависеть от ваших факторов риска и возможных осложнений, например сердечного приступа. Обычно это включает одно или несколько из следующих действий:
- изменения образа жизни
- лекарства
- хирургические процедуры.
Изменения образа жизни
Предлагаемые изменения образа жизни могут включать:
- бросить курить
- больше двигаться
- сделать выбор в пользу здорового питания и питья
- похудеть
- снизить уровень стресса.
Вы можете найти советы о способах достижения этих целей в разделе управления рисками на нашем веб-сайте.
Лекарства
Ваш врач может предложить одно или несколько лекарств в зависимости от:
- ваших симптомов
- вашего риска сердечных приступов в будущем
- любых осложнений, которые у вас были, например сердечного приступа или сердечной недостаточности.
Эти лекарства могут включать:
Процедуры
Если у вас стенокардия или если у вас уже был сердечный приступ, ваш врач может предложить одну из следующих процедур.
Ангиопластика и стенты
Ангиопластика — это процедура, при которой используется специальный баллон для расширения узкой или закупоренной артерии и восстановления кровотока к сердцу. Во время процедуры врач обычно вводит небольшую сетчатую трубку, называемую стентом, в артерию, чтобы она оставалась открытой. Узнайте больше на нашей странице ангиопластики.
Операция по шунтированию коронарной артерии (АКШ)
Операция по шунтированию улучшает приток крови к сердцу для лечения стенокардии. Во время операции кардиолог берет кровеносный сосуд из другой части вашего тела (обычно из ноги или руки) и использует его, чтобы прокладывать новый путь для кровотока через заблокированную артерию. Узнайте больше на нашей странице АКШ.
Хорошо жить с ишемической болезнью сердца
Ишемическую болезнь нельзя вылечить, но с ней можно прожить долгую и полноценную жизнь.Вы также можете многое сделать, чтобы контролировать свое состояние и снизить риск сердечных приступов в будущем.
Если вам только что поставили диагноз, это нормально, если вы испугаетесь или расстроитесь. Важно получить как можно больше поддержки — физически и эмоционально.
Посещение кардиологической реабилитации — отличный способ узнать больше о своем состоянии. Вы узнаете, как можно помочь себе, и познакомитесь с людьми, которые пережили подобный опыт.
Вы также можете получить зеленый рецепт.Это бесплатная государственная программа, которая помогает людям советами по физическим упражнениям и питанию. Программа включает бесплатные консультации с обученным наставником и возможность участвовать в местных программах мероприятий.
Общение с другими людьми
Иногда полезно услышать мнение других людей, страдающих ишемической болезнью сердца. Вы можете прочитать личные истории людей, которые поделились своим опытом в рамках нашей программы Journeys . Вы найдете множество историй о людях, перенесших сердечные приступы, стенокардию или живущих с такими факторами риска, как высокий уровень холестерина и высокое кровяное давление.
Вы также можете присоединиться к группе кардиологической поддержки в вашем районе. Найдите их в нашем сердечном справочнике. Heart Foundation также проводит регулярные мероприятия по ряду связанных с сердцем тем.
Как снизить риск сердечных приступов в будущем?
Вы можете многое сделать, чтобы снизить риск сердечных приступов в будущем. Внесение изменений в образ жизни, описанных выше, и продолжение приема лекарств в соответствии с предписаниями — это две важные вещи, которые вы можете сделать, чтобы снизить риск сердечного приступа или другого сердечного приступа.
Узнайте, когда вы должны пройти обследование сердца и диабета у врача или медсестры.
Вы также найдете много информации об управлении рисками на веб-сайте и о благополучии после сердечного приступа.
Узнайте больше о сердечных приступах Подпишитесь на нашу рассылку о сердечной помощиВопросы здоровья женщин — Факторы риска ишемической болезни сердца
Поговорите со своим лечащим врачом о вашем личном риске сердечных заболеваний и о том, что вы можете сделать, чтобы снизить этот риск.Ниже приведены факторы риска ишемической болезни сердца:
Курение
Выкуривание всего четырех сигарет в день повышает вероятность сердечных заболеваний в семь раз. Если вы курите, лучшее, что вы можете сделать для своего сердца, — это бросить курить.
Высокое кровяное давление
Высокое кровяное давление увеличивает риск сердечного приступа в три раза и вдвое увеличивает риск инсульта. Высокое кровяное давление очень распространено: 40 процентов женщин старше 65 лет имеют высокое кровяное давление.Вы должны стремиться к показаниям артериального давления 135/85 или ниже.
Высокий холестерин
Повышенный уровень «плохого» холестерина ЛПНП (в отличие от «хорошего» холестерина ЛПВП) сужает коронарные артерии и способствует развитию сердечных заболеваний. Чтобы узнать, какой у вас уровень холестерина, попросите своего врача сделать анализ крови. Физическая активность, отказ от курения, ограничение употребления алкоголя и употребление здоровой пищи — все это важно для поддержания здорового уровня холестерина.
Диабет
Люди с диабетом, как правило, имеют другие факторы риска сердечных заболеваний, включая высокое кровяное давление и уровень холестерина в крови, а также ожирение. Женщины с диабетом в семь раз чаще других женщин страдают сердечным приступом и подвергаются большему риску, чем мужчины с диабетом.
Отсутствие физической активности
Отсутствие физической активности способствует низкому уровню ЛПВП или «хорошего холестерина», избыточному весу, высокому кровяному давлению и стрессу. Регулярные упражнения укрепляют сердце и позволяют ему более эффективно перекачивать кровь.Рекомендуется выполнять какие-либо аэробные упражнения (например, ходьба, бег трусцой или езда на велосипеде) в течение как минимум 30 минут большую часть дней в неделю.
Размер талии
Люди с избыточным весом более склонны к сердечному приступу, особенно если вес приходится на талию и верхнюю часть тела (по сравнению с лишним весом вокруг бедер).
Если вы женщина и ваша талия превышает 31,5 дюйма (80 см), вы подвержены повышенному риску развития сердечных заболеваний, высокого кровяного давления и диабета.
Идеальный ИМТ (индекс массы тела) составляет от 18,5 до 24,9. Если вы хотите рассчитать свой ИМТ, нажмите здесь. (Обратите внимание, что это руководство не распространяется на детей, беременных женщин, кормящих женщин и спортсменов. Оно также может быть неподходящим для людей с мускулистым телосложением и пожилых людей. Также обратите внимание, что ИМТ не учитывает, где находится жир у человека. )
Психосоциальные проблемы
Стресс, депрессия, социальная изоляция и отсутствие социальной поддержки связаны с более высокими показателями сердечно-сосудистых заболеваний.Стресс влияет на тело, заставляет сердце работать тяжелее и может усугубить высокое кровяное давление. Депрессия может повлиять на выздоровление человека и исход сердечного приступа. У каждого в жизни есть стресс, но научиться справляться с ним полезно для здоровья сердца.
Семейный анамнез
Женщина подвергается большему риску сердечных заболеваний, если один из ее кровных родственников по мужской линии (ее отец или брат) имел болезнь сердца в возрасте 55 лет или меньше, или если кровная родственница (ее мать или сестра) имела порок сердца в возрасте 65 лет и младше.
Бедность
Низкий доход связан с более высоким уровнем ишемической болезни сердца и инсульта, а также с более высоким уровнем смертности после сердечного приступа. Люди, живущие в бедности, чаще подвержены другим факторам риска, таким как высокое кровяное давление, диабет и хронический стресс; и менее вероятно, что у них будет время на физические упражнения или доступ к лекарствам и медицинскому обслуживанию, в которых они могут нуждаться.
Менопауза
Во время менопаузы уровень эстрогена у женщины снижается, в то время как ее кровяное давление и уровень холестерина и других жиров в крови повышаются.После менопаузы риск сердечных заболеваний у женщины выше, чем до менопаузы. Примерно через 10 лет после менопаузы женщины начинают превосходить мужчин по риску сердечно-сосудистых заболеваний.
Три четверти взрослого населения Канады имеют по крайней мере один из трех основных изменяемых факторов риска сердечно-сосудистых заболеваний:
- Курение
- Высокое кровяное давление (высокое кровяное давление по-прежнему считается фактором риска, даже если под контролем лекарств)
- Холестерин повышенный
