Ишемический инсульт неврология: Лечение ишемического инсульта в Екатеринбурге
Неврологическое отделение для больных с ОНМК — ПККБ1
Местонахождение: г. Владивосток, ул. Алеутская 57, корпус «А» (хирургический), 5-й этаж
Режим работы: круглосуточно
Беседа родственников пациентов с лечащим врачом: понедельник-пятница с 14:00 до 15:00
Посещение пациентов: понедельник-воскресенье с 14:00 до 18:00
8 (423) 242-00-28
врач-невролог
По телефону отделения 8 (423) 242-00-28 производится запись на платный консультативный прием к врачу-неврологу по вопросам первичной и вторичной профилактики инсульта.
ОБ ОТДЕЛЕНИИ
Неврологическое отделение для больных с острыми нарушениями мозгового кровообращения начало работу в феврале 2016 года. Отделение рассчитано на 30 коек круглосуточного пребывания больных, которые госпитализируются в экстренном порядке бригадами скорой медицинской помощи из различных районов города Владивостока, а также из других лечебных учреждений Приморского края, для оказания специализированной медицинской помощи, проведения сложных диагностических мероприятий и оказания высокотехнологической медицинской помощи в хирургических отделениях Регионального сосудистого центра (нейрохирургическом, сосудистом, отделении рентгенхирургических методов диагностики и лечения, отделении хирургического лечения сложных нарушений ритма и ЭКС). Основными направлениями работы отделения являются: оказание экстренной медицинской помощи больным с острыми нарушениями мозгового кровообращения, выявление факторов риска и мероприятия по профилактике повторного инсульта (вторичная профилактика), ранняя реабилитация.
Отделение расположено на 5 этаже, имеет в своём составе 5 палат вместимостью от 3 до 6 пациентов, 2 палаты повышенной комфортности (одноместные). Отделение оснащено современным реабилитационным оборудованием.
В отделении работает высокопрофессиональный коллектив врачей, медсестер, инструкторов, младших медсестер, которых отличает доброжелательное, чуткое отношение к пациентам, профессионализм, стремление к новым знаниям и умениям.
Дополнительные платные услуги, которые могут быть предоставлены в отделении:
- Консультации заведующего отделением, врача-невролога, врача ЛФК, логопеда.
- Лечение больного в условиях улучшенного содержания: в одноместных палатах (палата №2, 3).
- Индивидуальный уход за больным (пост): врачебный, медсестринский, санитарский.
Прейскурант цен на платные услуги смотрите на сайте.
ВАЖНО ЗНАТЬ КАЖДОМУ
ИНСУЛЬТ – это заболевание, при котором происходит повреждение головного мозга человека вследствие нарушения кровоснабжения.
Есть два вида инсульта:
УДАР поможет распознать инсульт вовремя!
Самой частой причиной позднего обращения пациентов с инсультами в лечебные учреждения является непонимание того, что с ними случился именно инсульт. Отсутствие элементарных знаний приводит к тому, что люди теряют драгоценное время, и это приводит к стойкой инвалидизации в последующем.
Однако есть эффективный способ для определения первых симптомов инсульта. Это диагностика УДАР.
Если вы вдруг заметили, что кому-то рядом стало плохо, вспомните это слово и произведите действия:
У–улыбка — попроси человека улыбнуться;
Д–движение – вытянуть и удерживать руки перед собой;
А–артикуляция — назвать себя, имя и фамилию;
Р–решение — если у человека есть три симптома: перекошенная улыбка, не поднимается рука, нарушена речь и он не может назвать свое имя – прими решение, звони 03 или 103 с мобильного.
Диагностика инсульта УДАР
Тест УДАР позволяет правильно распознать инсульт в 90% случаев. Для этого не нужны медицинские знания. Определить может даже ребенок!
Для этого не нужны медицинские знания. Определить может даже ребенок!
Диагностика инсульта У.Д.А.Р. Учат дети.
Если пациент доставлен вовремя и нет противопоказаний для проведения тромболитической терапии, то есть шанс спасти человека от неминуемой инвалидизации. Вот несколько историй наших пациентов, которые приехали вовремя:
Инсульт. Им повезло. Реальные истории пациентов
О ЛЕЧЕНИИ БОЛЬНЫХ С ИНСУЛЬТАМИ
Все пациенты с симптомами инсульта госпитализируются машинами «скорой медицинской помощи» в специализированные лечебные учреждения (первичные сосудистые отделения), согласно маршрутизации. В наш стационар доставляются пациенты с Фрунзенского района, части Ленинского и Первомайского районов г. Владивостока, а также из других ЛПУ Приморского края.
При поступлении всем пациентам производится КТ (компьютерная томография) головного мозга. Поскольку только этот метод может достоверно определить имеется ли кровоизлияние в головной мозг или нет.
В диагностической комнате приемного отделения всех пациентов осматривают врачи (невролог, терапевт, реаниматолог, нейрохирург), производится ЭКГ, забор крови.
Задачи отделения:
— проведение реабилитационных мероприятий:
ВАЖНО ЗНАТЬ ПРИ ВЫПИСКЕ
— Важно соблюдать все назначения врача, указанные в выписном эпикризе. Эти назначения позволят предупредить повторный инсульт, вероятность которого без должного лечения составляет 25% в течение года. При соблюдении назначений по вторичной профилактике риск повторного инсульта снижается до 2.4%.
— Обязательно встаньте на учет в поликлинике по месту жительства! Вы должны получать лечение под контролем лечащего врача! Отсутствие должного контроля может привести к повторному инсульту! Ведите дневник артериального давления, уровня глюкозы крови (для страдающих сахарным диабетом)!
— Реабилитация пациента после перенесенного инсульта процесс длительный, требующий больших усилий со стороны родственников. Потому что именно на их плечи упадут основные заботы по восстановлению функций заболевшего после выписки. В реабилитации очень важен принцип непрерывности, поэтому важно, чтобы родственники активно участвовали в процессе восстановления функций, обучались методикам, понимали принципы, подходы и могли продолжить занятия по месту жительства.
Потому что именно на их плечи упадут основные заботы по восстановлению функций заболевшего после выписки. В реабилитации очень важен принцип непрерывности, поэтому важно, чтобы родственники активно участвовали в процессе восстановления функций, обучались методикам, понимали принципы, подходы и могли продолжить занятия по месту жительства.
ОСНОВНЫЕ ПРИЧИНЫ ИНСУЛЬТА
Важно знать, что из всех причин можно выделить четыре основные, которые неизбежно ведут к инсульту!
БИТ неврологии / Отделения / РКБСМП
БИТ неврологии развернута одна палата на 6 коек. Блок интенсивной терапии оснащен прикроватными мониторами для круглосуточного мониторирования, централизованная подача кислорода, аппараты ИВЛ, ЭКГ, электроотсос . Отделение принимает пациентов с тяжелыми геморрагическими и ишемическими инсультами, проводим тромболизис
Оказание высокоэффективной неврологической помощи пациентам с ишемическим инсультом в ГБУ РКБ- ЦСЭМП.
Одним из наиболее распространенных цереброваскулярных заболеваний, которое приводит к инвалидности и смерти, является ишемический инсульт.
Ишемический инсульт – острое нарушение мозгового кровообращения с повреждением ткани мозга и его функций вследствие недостаточности или прекращения поступления крови к определенному участку мозга. Ишемический инсульт составляет 85% всех инсультов.
Новые технологии лечения ишемического инсульта (ИИ) включают применение высокоэффективных методов реперфузии вещества головного мозга в первые часы заболевания, направленных на восстановление кровотока в пораженном сосуде, что позволяет предотвращать развитие необратимого повреждения вещества головного мозга, либо уменьшать его объем, т.е. минимизировать степень выраженности остаточного неврологического дефицита. Внутривенный (системный) тромболизис с использованием рекомбинантного тканевого активатора плазминогена служит наиболее эффективным методом терапии ИИ в первые 4,5 часа от начала развития симптоматики.
Суть метода состоит в том, что в первые часы от начала развития ишемического инсульта пациенту вводится тромболитик – лекарственный препарат, растворяющий тромб внутри пораженного сосуда.
Это приводит к быстрому восстановлению кровотока в бассейне закупоренного сосуда и регрессу неврологических симптомов: речевых расстройств, гемипареза (расстройств движений на противоположной от очага инсульта стороне тела) и др.
Проблема, с которой мы столкнулись при использовании упомянутой терапии, — запоздалое поступление больных. От момента заболевания до введения препарата в вену должно пройти не более 4,5 часов. За это время необходимо успеть доставить больного в стационар и провести надлежащее обследование.
На сегодняшний день в РКБ ЦСЭМП организована круглосуточная работа лучевой диагностической аппаратуры ( снимки МРТ, КТ) позволяющей визуализировать патологический процесс для проведения срочного дифференцированного лечения и тромболитической терапии.
МРТ головного мозга пациентки 59лет : до тромболизиса, через 2часа от начала заболевания.
После тромболизиса, через 24 часа проведено контрольное МРТ:
В 2015г проведена ТЛТ четырем пациентам. Получен результат с улучшением в трех случаях тромболизис прошел успешно, один случай прошел с геморрагической трансформацией. За 10 месяцев 2015 г госпитализировано с ишемическим инсультом 478 пациентов. Из них, ТЛТ не проведена по следующим противопоказаниям:
- Госпитализация пациентов позже 4-х часов составила 350сл.-77%
- С повторными инсультами – 29 пац – 28%
- С сахарным диабетом – 24 пац-22.6%
- С эпилепсией –6 сл.- 5.1%
- В анамнезе ЖКК-8 сл.
 — 8.2%
— 8.2% - С тяжелым инсультом по шкале NIHS по 25 баллов – 11 сл.-16%
- С малым инсультом, меньше 4 баллов – 10 сл.-1%
- С перенесенным инфарктом миокарда – 7сл -7.2%
В марте 2016 г проведен тромболизис пациенту с ишемическим инсультом в бассейне правой СМА с левосторонним глубоким гемипарезом. АКШ в 2014г. Пациент доставлен в терапевтическое окно 3 часа с момента инсульта, была проведена ТЛТ после 24часов клиника инсульта прошла полностью. Пациент выписан с полным регрессом неврологической симптоматики.
Инсульт (острое нарушение мозгового кровообращения) | Неврология
Острое нарушение мозгового кровообращения
Что же такое инсульт? Это внезапное и быстрое нарушение кровообращения мозга вследствие закупорки ( ишемический инсульт), либо разрыва (геморрагический инсульт) сосудов головного мозга. Вследствие этого нарушается циркуляции крови и возникает недостаток кислорода. Это приводит к повреждению, а потом и отмиранию нервных клеток. В зависимости от локализации поражения наступает паралич, потеря речи, нарушение равновесия. Самое опасное, когда поражается ствол мозга, где сосредоточены центры, отвечающие дыхание, регуляцию кровообращения и тп.
Инсульт имеет предвестники: головные боли, головокружение, слабость. Позднее могут присоединиться тошнота и рвота.
Если вы предполагаете, что у человека случился инсульт, попросите его сделать эти простые действия:
-
улыбнуться. При инсульте улыбка будет кривая;
-
сказать простое предложение. Человек будет говорить медленно и запинаться;
-
поднять руки. Одна рука будет ниже;
-
высунуть язык.
 Он западет на одну сторону
Он западет на одну сторону
Если вы заподозрили инсульт у себя или других, немедленно обратитесь к доктору. Золотым стандартом медицины является правило – кто грамотно диагностирует, тот правильно лечит. Раннее выявление заболевания позволяет вовремя начать лечение. Медицинское оборудование Медико-хирургиче
⚕ Геморрагический и ишемический инсульт ⏩ 【Лечение】
Локальные и системные факторы риска – морфологические и атеросклеротические изменения магистральных артерий головы (МАГ), атеросклеротические поражения массовых артерий и сосудов дуги аорты, поражение сердца вследствие тромбэкстракции инфарктов мозга, фибромышечная дисплазия, разрывы стенок МАГ и мозговых артерий. А также, воспаление стенок артерий, нарушения в шейном отделе позвоночника, патологии центрального и церебрального движения крови по сосудам, болезнь Вакеза, нарушения гемостаза, некоторые формы лейкозов, угнетение газотранспортной функции крови и др.
Кроме того, возникновению инсульта способствуют разного рода поражения сердца – фибрилляция предсердий, нарушения сердечного ритма, инфаркт миокарда, постинфарктные аневризмы, сопровождающиеся тромбообразованием, ревматизм сердца, идиопатические кардиомиопатии, эндокардиты, миокардиопатии и др.
Геморрагия в мозг возникает при разрыве сосуда или выходе форменных элементов крови через стенки капилляров и мелких вен в окружающие ткани.
Причины кровоизлияния в мозг при геморрагическом инсульте:
- травмы головы;
- резкое повышение АД;
- вторичная геморрагия в стволе головного мозга;
- новообразования мозга, артерииты, коагулопатии.
В развитии геморрагического инсульта большую роль играют некоторые гены (ген ренин-ангиотензивной системы, гены системы гомеостаза и др. ).
).
При нарушении мозгового кровообращения в организме пациента очень быстро развиваются патобиохимические изменения, приводящие к необратимому повреждению нервной ткани мозга вследствие омертвения участка мозга и запрограммированной гибели клеток.
Кровоизлияние в головной мозг приводит к гибели нервной ткани на поврежденных участках. Гематома сдавливает ткани мозга, в результате чего резко повышается внутричерепное давление. Интенсивность неприродных изменений прямо пропорциональна размерам геморрагии. Отек головного мозга возникает уже через несколько минут после развития локальной ишемии в результате повреждения клеточной мембраны и накопления в клетке жидкости.
Отек мозга вызывает повышение внутричерепного давления, что в свою очередь, ведет к геморрагической трансформации инфаркта и смещению отделов мозга.
Если летального исхода не наступает, отек мозга постепенно спадает на протяжении одной-двух недель, некротическая ткань мозга подвергается резорбции или разжижению. В последующем на месте инфаркта формируется рубец из соединительной ткани и/ или кистообразная полость.
Дефиниция ишемического инсульта и транзиторной ишемической атаки
Ишемическим инсультом является эпизод неврологической дисфункции, вызванной фокальным инфарктом головного мозга, спинного мозга или сетчатки глаза.
Выделяют следующие периоды инсульта (Гусев Е. И. Скворцова В. И. 2001):
- Острейший период — от дебюта заболевания до 3 суток;
- Острый период – от 3 до 21 суток;
- Ранний восстановительный период – от 21 суток до 6 месяцев;
- Поздний восстановительный период – от 6 месяцев до 2 лет.
Критериями транзиторной ишемической атаки являются:
- Кратковременный эпизод неврологического дефицита, вызванный очаговой ишемией головного мозга, спинного мозга или сетчатки глаза с клиническими симптомами, длящимися ≤24 часов.

- Отсутствие признаков острого инфаркта ЦНС по данным нейровизуализации.
Симптомокомплекс ТИА
Каротидный бассейн
A. Двигательное расстройство (то есть, слабость или паралич одной или обеих конечностей на одной стороне).
B. Нарушения чувствительности (то есть, потеря чувствительности или парестезия одной или обеих конечностей на одной стороне).
C. Потеря зрения одного глаза (частичная или полная).
D. Гомонимная гемианопсия.
E. Комбинация вышеперечисленного.
F. Чувствительные или двигательные симптомы обычно появляются одновременно без эффекта «распространения».
Вертебрально-базилярный бассейн
A. Двигательные расстройства (в одной или более конечностей в любых комбинациях, иногда с переходом с одной стороны на другую или с квадриплегией).
B. Чувствительные расстройства (в одной или более конечностей в любых комбинациях, часто включая одну или обе стороны лица, рта, языка).
C. Нарушение зрения (полная или частичная потеря зрения обоих гомонимных полей; может наступать билатеральная гомонимная гемианопсия).
D. Гомонимная гемианопсия.
E. Неустойчивая походка или постуральные нарушения (атаксия, потеря равновесия, неустойчивость, не связанные с головокружением).
F. Диплопия, дисфагия, дизартрия, головокружение (с тошнотой или рвотой или без них) в виде моносимптомов не соответствуют диагнозу ТИА, за исключением сочетания с любыми вышеперечисленными симптомами.
G. Симптомы могут быть односторонними.
Проявлениями ТИА нельзя считать следующие транзиторные неврологические симптомы: измененное сознание или синкопы; головокружение; расстройство зрения (»серая пелена») с нарушением сознания; амнезия или замешательство в виде моносимптомов; тоническая и/или клоническая двигательная активность; очаговые симптомы, связанные с мигренью; мерцающие скотомы; недержание мочи или кала; диплопия, дисфагия, или дизартрия, проявляющиеся в виде моносимптомов.
Клинические состояния, имитирующие ишемический инсульт (»маски» инсульта)
| Нозология | Симптомы и коморбидные состояния |
|---|---|
| Психогенные расстройства | Отсутствие симптомов объективного поражения ЦНС |
| Эпилепсия | Наличие судорожных приступов в анамнезе, эпилептическая активность по данным ЭЭГ, постиктальный парез |
| Гипогликемия | Сахарный диабет в анамнезе, низкий уровень глюкозы в плазме крови, количественные расстройства сознания |
| Мигрень с аурой (осложненная мигрень) | Наличие в анамнезе подобных событий, аура, предшествующая возникновению неврологического дефицита, головная боль |
| Гипертензивная энцефалопатия | Головная боль, делириозное расстройство сознания, значимая артериальная гипертензия, кровоизлияния в коре, отек головного мозга, судороги |
| Энцефалопатия Вернике | Злоупотребление алкоголем в анамнезе, атаксия, офтальмоплегия, дезориентация в пространстве и времени |
| Абсцесс ЦНС | Наркотическая зависимость в анамнезе, эндокардит, наличие у пациента лихорадки после проведения операции по имплантации устройств |
| Опухоль ЦНС | Постепенное прогрессирование симптомов, данные о наличии малигнизации опухолевого процесса, судорожный синдром в дебюте заболевания |
| Токсическое воздействие препаратов | Прием препаратов лития, фенитоина, карбамазепина |
| Конверсионное расстройство | Несоответствие между объективной клинической картиной и предъявляемыми жалобами |
Диагностика ТИА
Высокие технологии в неврологии: Тромболитическая терапия при ишемическом инсульте
Высокие технологии в неврологии: Тромболитическая терапия при ишемическом инсульте
Максимов Радислав Серафимовиччлен Научно-Медицинского Общества неврологов Чувашской Республики, член Российского Общества врачей восстановительной медицины, заведующий первичного сосудистого отделения МУЗ «Городская клиническая больница №1»
Острое нарушение мозгового кровообращения (ОНМК, инсульт) – это острое грозное заболевание головного мозга, обусловленное разрывом или закупоркой сосуда.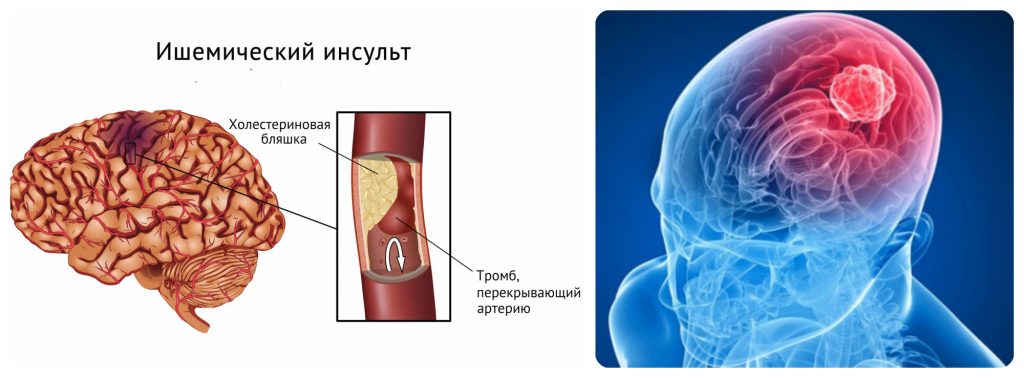 В зависимости от этого возникает кровоизлияние в головной мозг или инфаркт мозга. Во всём мире инсульт переносят до 6 миллионов человек в год. В нашей стране эта катастрофа настигает 450тысяч человек в год, т.е. каждые полторы минуты у кого-то случается инсульт. Заболевание занимает одно из первых мест по причине смертности и первое место по причине инвалидности.
В зависимости от этого возникает кровоизлияние в головной мозг или инфаркт мозга. Во всём мире инсульт переносят до 6 миллионов человек в год. В нашей стране эта катастрофа настигает 450тысяч человек в год, т.е. каждые полторы минуты у кого-то случается инсульт. Заболевание занимает одно из первых мест по причине смертности и первое место по причине инвалидности.
Фармакологическая составляющая лечения ишемического инсульта предусматривает выполнение двух главных задач – реперфузии и цитонейропротекции. Одним из современных и эффективных методов реперфузии при ишемическом инсульте является тромболитическая терапия. В США тромболизис при инсульте применяется в течение 10 лет, в России — широкое распространение получилс внедрением программы борьбы с инсультом в 2007г. Применение тромболитической терапии даёт возможность стать свидетелем поистине драматического улучшения состояния пациента, когда буквально «на игле» исчезают грубейшие неврологические нарушения. У больных, получивших тромболитическую терапию, возможность благоприятного исхода с минимальными неврологическими нарушениями или их полным отсутствием через 3 месяца увеличивается на 30-50%. Для проведения тромболизиса в неврологии разрешён тканевой активатор плазминогена (альтеплаза). Альтеплаза стимулирует переход связанного с фибрином плазминогена в активный плазмин, действует непосредственно на фибриновый сгусток и способствует его растворению. Препарат доказал свою эффективность при незначительном риске развития осложнений. Однако, при несоблюдении протокола процедуры тромболизиса, риск развития осложнений значительно превышает возможную пользу. Основными осложнениями тромболитической терапии при инсульте являются кровоизлияния в головной мозг, симптомная (клининчески-выраженная) геморрагическая трансформация ишемического инфаркта мозга и отёк Квинке, значительно ухудшающие течение инсульта. Частота этих осложнений достигает в среднем 5-6%.
Для выполнения тромболитической терапии важно соблюдение ряда условий, одним из которых является временной критерий. Процедура тромболизиса должна проводиться не позднее 3 часов от начала инсульта, т. е. в так называемый период «терапевтического окна».
Процедура тромболизиса должна проводиться не позднее 3 часов от начала инсульта, т. е. в так называемый период «терапевтического окна».
Первичное сосудистое отделение для лечения ОНМК открыто 1 марта 2010г. Пациентов, поступивших в первые 3 часа («терапевтическое окно») оказалось 24,3%. Системную тромболитическую терапию получили 6 пациентов (4 мужчины и 2 женщины), что составило 1,5% от общего количества лиц с ишемическим инсультом, и 6,3% из лиц, доставленных в первые 3 часа от начала заболевания. Целевым показателем для проведения тромболитической терапии от числа лиц с ишемическим инсультом считается 2,5%. Средний возраст больных, получивших тромболизис – 63,6лет. Работающие составили 40%.
Оценка эффективности лечения проводилась по шкале инсульта Национального института здоровья США (NIHSS) и шестибальной шкале оценки нарушения жизнедеятельности Рэнкина.
Ишемический инсульт подтверждался данными магнитно-резонансной томографии. Средний показатель по шкале NIHSS при поступлении в больницу составил 11 баллов, а по шкале Рэнкина – 3,6 балла.
Эффективность лечения составила 100%, однако в 1 случае эффект расценивался как малозначительный. Все пациенты, получившие альтеплазу, выписаны в удовлетворительном состоянии. Один пациент из шести (16%) выписан с тяжёлым гемипарезом (по шкале Рэнкина 3 балла). Клинически значимых осложнений тромболитической терапии у нас в отделении не наблюдалось. Бессимптомная геморрагическая трансформация возникла у одного больного, однако это осложнение никак не повлияло на течение реабилитационного процесса и течение восстановительного периода после инсульта. На фоне лечения симптоматика инсульта уменьшилась в среднем на 5,1 балла по шкале NIHSS, и 1,83 балла по шкале Рэнкина.
Ишемический инсульт по механизму парадоксальной эмболии » Медвестник
Одним из возможных механизмов ИИ у молодых пациентов является парадоксальная эмболия (ПЭ) — миграция тромба (реже воздуха или жира) из венозной системы через открытое овальное окно, дефект межпредсердной перегородки или легочные артериовенозные мальформации с последующей эмболией в ветви дуги аорты, что клинически проявляется транзиторной ишемической атакой (ТИА) или ишемическим инсультом [3].
Открытое овальное окно (ООО) наиболее часто встречается в популяции (около 25%) и расценивается как доминирующий путь реализации ПЭ [4]. Среди лиц, перенесших криптогенный инсульт, вероятность выявления ООО в 3 раза выше, чем среди пациентов с установленной причиной инсульта [5].
ООО — форма межпредсердной коммуникации, анатомически представляющая «зондовое» отверстие, расположенное в центральной части межпредсердной перегородки (МПП), которое образуется из налагающихся частей первичной и вторичной перегородок. ООО — рудимент нормального кровообращения эмбриона, в норме оно должно закрываться к первому году жизни ребенка, однако остается не заращённым у ¼ населения.
Морфологическая вариабельность касается как размеров, так и формы овального окна – от простого отверстия, прикрытого заслонкой, до длинного извилистого прохода [6]. Строение ООО определяет степень шунтирующего кровотока, проходящего через отверстие, который может варьировать от малого до значительного. Сочетание ООО с гипермобильностью и аневризмой МПП способствует открытию овального окна при каждом сердечном цикле и усилению шунтирующего кровотока, особенно при повышении давления в полости правого предсердия (маневр Вальсальвы), тем самым повышая вероятность развития парадоксальной эмболии.
Другим способом осуществления ПЭ являются дефекты межпредсердной перегородки (ДМПП). Наиболее распространенными из них, являются ДМПП типа ostium secundum (дефекты вторичной перегородки), расположенные в средней части МПП в области овальной ямки. Как правило риск ПЭ связан с небольшими, гемодинамически незначимыми ДМПП, которые не приводят к перегрузке правых отделов сердца и легочной гипертензии и обнаруживаются во взрослом возрасте при ультразвуковом исследовании сердца в процессе выяснения причины инсульта. По данным Hoffman с коллегами, частота развития инсульта у пациентов с ДМПП составляет 4% среди лиц с врождёнными пороками сердца [7].
Редким путем реализации ПЭ, являются легочные артериовенозные мальформации (ЛАВМ) — патологические коммуникации между легочными артериями и венами в обход капиллярного русла, минуя процесс фильтрации и оксигенации крови. Частота встречаемости ЛАВМ в популяции составляет 0,03%. Синонимами данного названия в литературе являются: легочные артериовенозные фистулы/аневризмы. Большинство ЛАВМ являются врожденными и в подавляющем числе случаев (47-90%) ассоциированы с наследственной геморрагической телеангиэктазией (болезнью Рандю — Ослера – Вебера) [8].
Частота встречаемости ЛАВМ в популяции составляет 0,03%. Синонимами данного названия в литературе являются: легочные артериовенозные фистулы/аневризмы. Большинство ЛАВМ являются врожденными и в подавляющем числе случаев (47-90%) ассоциированы с наследственной геморрагической телеангиэктазией (болезнью Рандю — Ослера – Вебера) [8].
Механизм парадоксальной эмболии
Основными источниками тромбозов являются вены нижних конечностей, чаще глубокие вены голеней, и вены малого таза. Реже возникает тромбоз in situ в туннеле овального окна или в области аневризмы межпредсердной перегородки, а также в результате предсердных нарушений ритма сердца.
Факторами, способствующими тромбообразованию являются:
- Недавняя иммобилизация (длительное путешествие или перелет, иммобилизация вследствие болезни).
- Наличие генетических маркеров тромбофилии – гомо- или гетерозиготные мутации в гене II и V факторов (Лейденовская мутация), в гене фибриногена.
- Антифосфолипидный синдром.
- Недостаточность показателей противосвертывающей системы и фибринолиза – дефицит протеина С, S, антитромбина III.
- Повышение 8 фактора в сочетании с повышением активности фактора фон Виллебранда.
- Прием оральных контрацептивов у женщин, естественные протромботические состояния (беременность, ранний послеродовый период) [9].
Течение НМК
К особенностям нарушений мозгового кровообращения относится молодой возраст пациентов, у которых отсутствует сопутствующая патология со стороны сердечно-сосудистой системы. При анализе причины инсульта важно учитывать особенности развития заболевания. Для ПЭ характерным является острое развитие симптоматики в дневные часы или сразу после пробуждения, во время или после длительной поездки (перелета). В анамнезе возможно указание на недавно перенесенный тромбоз вен ног или тромбоэмболию легочной артерии (ТЭЛА), наличие мигрени с аурой, или синдрома апноэ во сне.
Маневр Вальсальвы характеризуется форсированным выдохом при закрытом надгортаннике, когда происходит моментальное повышение давления в правых отделах сердца и усиление шунтирующего кровотока. Наличие маневра Вальсальвы в дебюте развития симптомов инсульта повышает вероятность ПЭ, поэтому при сборе анамнеза необходимо обращать внимание на такие факторы, как подъем тяжести, натуживание при дефекации, кашель, чихание, смех и рвота.
Шкала RoPE
В помощь клиницистам в оценке взаимосвязи перенесенного криптогенного инсульта с выявленным открытым овальным окном была создана шкала Риска парадоксальной эмболии (Risk of Paradoxal Embolizm — RoPE). Шкала проста в использовании — по одному баллу начисляется за отсутствие факторов сосудистого риска, один балл за наличие ИИ корковой локализации по результатам нейровизуализации и один балл если настоящий инсульт или транзиторная ишемическая атака, являются впервые возникшими. Чем моложе пациент, тем большее количество баллов ему присваивается. Высокий суммарный балл, набранный по шкале, говорит о высокой вероятности взаимосвязи ООО с криптогенным инсультом [10].
Нейровизуализация
При нейровизуализации головного мозга характерным является обнаружение корковых или корково-подкорковых инфарктов малых или средних размеров. Особенно подозрительны в отношении ПЭ инфаркты, расположенные в пределах разных сосудистых бассейнов – каротидных и/или вертебрально-базилярном. Наряду с «острыми» очагами ишемии возможно наличие «немых» инфарктов мозга.
Ультразвуковая диагностика
Ультразвуковые методы являются основными для выявления межпредсердных коммуникаций и оценки шунтирующего кровотока. Для визуализации структурных аномалий строения сердца используются трансторакальная (ТТ-ЭхоКГ) и чреспищеводная (ЧП-ЭхоКГ) эхокардиография. ЧП-ЭхоКГ является более чувствительным методом, так как позволяет детально визуализировать область овальной ямки и обнаруживать в ней даже небольшие дефекты [11]. Для идентификации шунтирующего кровотока наиболее информативным методом является контрастная транскраниальная допплерография (ТКДС) с эмболодетекцией. Показано, что при наличии шунта справа налево, связанного с ООО, она обладает чувствительностью 70–100% и специфичностью более 95% [12].
Для идентификации шунтирующего кровотока наиболее информативным методом является контрастная транскраниальная допплерография (ТКДС) с эмболодетекцией. Показано, что при наличии шунта справа налево, связанного с ООО, она обладает чувствительностью 70–100% и специфичностью более 95% [12].
Методика проводится по принятому в мире стандартизированному протоколу: двумя УЗ-датчиками, установленными на головном шлеме, мониторируется кровоток по обеим средним мозговым артериям. Далее пациенту в локтевую вену вводится контрастное вещество, которое представляет собой взболтанную смесь 9 мл 0,9% физиологического раствора и 1 мл воздуха. Осуществляется наблюдение за появлением микроэмболических сигналов в спектре кровотока в покое и при выполнении пробы Вальсальвы. Проведение пробы — обязательный компонент исследования, ведущий к резкому кратковременному повышению давления в правом предсердии и забросу пузырьков контраста в левое, что важно для функционирования как плохо визуализируемых малых, так и значимых лево-правых шунтирующих сбросов. После подсчета микроэмболов определяется степень шунтирующего кровотока. Значимым для парадоксальной эмболии является наличие шунта среднего (>20 микроэмболических сигналов (МЭС)) или большого («занавес» из МЭС, где единичный сигнал не может быть распознан в спектре) размера [11].
Лечение
В 2019 году представлены Европейские рекомендации по ведению пациентов с открытым овальным окном [13]. Для вторичной профилактики пациентам с криптогенным ишемическим инсультом и ООО в зависимости от клинической ситуации рекомендовано использовать медикаментозную терапию антиагрегантами или антикоагулянтами и/или эндоваскулярное закрытие дефекта с помощью специального устройства — окклюдера.
Данные рандомизированных контролируемых исследований последних лет позволяют констатировать, что закрытие ООО эффективно снижает риск рецидивирующего инсульта для определенной категории пациентов с криптогенным инсультом. Так, эндоваскулярное закрытие ООО показано пациентам моложе 60 лет, у которых ООО ассоциировано с аневризмой или гипермобильностью МПП, а также шунтом большого или среднего размера.
Так, эндоваскулярное закрытие ООО показано пациентам моложе 60 лет, у которых ООО ассоциировано с аневризмой или гипермобильностью МПП, а также шунтом большого или среднего размера.
После чрескожного закрытия овального окна рекомендован прием двойной антиагрегантной терапии (ацетилсалициловая кислота 75 мг/день + клопидогрел 75 мг/день) в течение трех месяцев, с дальнейшим переходом на длительную терапию аспирином (75 мг/день). Пациентам с криптогенным инсультом и ООО, возраст которых старше 60 лет рекомендована вторичная профилактика инсульта с помощью антиагрегантов. Антикоагулянты показаны большинству пациентов, у которых развитие НМК ассоциировано с острым тромбозом глубоких вен, ТЭЛА или состоянием гиперкоагуляции [13].
Список литературы
- Добрынина Л.А., Калашникова Л.А., Павлова Л.Н. Ишемический инсульт в молодом возрасте. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(3): 4-8.
- Adams H.P., Bendixen B.H., Kappelle L.J. et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke; 24(1): 35–41.doi:10.1161/01.str.24.1.35
- Fu Q., Guo X., Mo D., Chen B. Young Paradoxical Stroke Treated Successfully with Mechanical Thrombectomy Using Solitaire and Transcatheter Closure of Patent Foramen Oval. Int Heart J. 2017;58(5):812-815. https://doi:10.1536/ihj.16-461
- Homma S., Messé S., Rundek T. et al. Patent foramen ovale. Nature Reviews Disease Primers. 2016;2(1). https://doi:10.1038/nrdp.2015.86
- Homma S., Sacco R. Patent Foramen Ovale and Stroke. Circulation. 2005;112(7):1063-1072. doi:10.1161/circulationaha.104.524371
- Davison P., Clift P.F., Steeds R.P. The role of echocardiography in diagnosis, monitoring closure and post-procedural assessment of patent foramen ovale. J. Echocardiogr.
 2010; 11 (10): 27—34. doi:10.1093/ejechocard/jeq120
2010; 11 (10): 27—34. doi:10.1093/ejechocard/jeq120 - Hoffman J.I.E. Atrial Septal Defect (Secundum). The Natural and Unnatural History of Congenital Heart Disease, 131–156. doi:10.1002/9781444314045.ch24
- Contegiacomo A, del Ciello A, Rella R et al. Pulmonary arteriovenous malformations: what the interventional radiologist needs to know. Radiol Med. 2019;124(10):973-988. doi:10.1007/s11547-019-01051-7
- Кулеш А.А., Шестаков В.В. Открытое овальное окно и ишемический инсульт. Неврология, нейропсихиатрия, психосоматика. 2019;11(2):4–11.doi:14412/2074-2711-2019-2-4-11
- Kent D.M., Ruthazer R., Weimar Ch. et al. An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. Neurology. 2013;81:619-25. doi: 1212/WNL.0b013e3182a08d59
- Чечёткин А.О. Методические аспекты диагностики открытого овального окна с помощью контрастной транскраниальной допплерографии (обзор литературы). Ультразвуковая и функциональная диагностика. 2007;1:102-118.
- Sloan M.A., Alexandrov A.V., Tegeler C.Y. et al. Assessment: transcranial Doppler ultrasonography: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. 2004;6:1468–1481. doi: 1212/wnl.62.9.1468
- European position paper on the management of patients with patent foramen ovale. General approach and left circulation thromboembolism. EuroIntervention 2019;14:1389-1402. doi: 4244/EIJ-D-18-00622
Ишемический инсульт | Неврология и нейрохирургия
Обзор
Обзор и факты об ишемическом инсульте
Ишемический инсульт — это наиболее распространенный тип инсульта, возникающий при закупорке кровеносного сосуда, снабжающего кровью головной мозг. Когда кровеносный сосуд (или артерия) заблокирован, клетки мозга перестают работать и могут погибнуть. Причина закупорки — образование жировых отложений (липидов) в стенке сосуда, в результате чего возникает состояние, называемое атеросклерозом.
Существует два типа препятствий, которые могут привести к ишемическому инсульту:
- Церебральный тромбоз: тромб образуется в больных или поврежденных церебральных артериях.Тромботические инсульты могут быть либо большим сосудом (закупорка находится в большой артерии в головном мозге, чаще всего сонной или средней церебральной), либо мелким сосудом (закупорка находится в меньшей артерии в головном мозге).
- Церебральная эмболия: тромб образуется не в головном мозге, а в другом месте, чаще всего в сердце или артериях шеи или верхней части грудной клетки. Когда эти сгустки крови застревают в кровотоке, они ограничивают приток крови к мозгу.
Почему выбирают Loyola для лечения ишемического инсульта?
Специалисты по инсульту Loyola Medicine получили признание на национальном уровне за свой успех в лечении пациентов с инсультом.Отделение неврологии и нейрохирургии в Медицинском центре Университета Лойола вошло в национальный рейтинг лучших больниц US News & World Report на 2020-2021 годы.
Центр лечения инсульта Лойолы был отмечен Американской ассоциацией по инсульту своей наградой Get with the Guidelines® — Stroke Gold Plus Quality Achievement Award в течение девяти лет подряд за нашу приверженность и успех в обеспечении более высоких стандартов лечения инсульта. Лойола также является единственным академическим медицинским центром в районе Чикаго, аккредитованным Международной комиссией по аккредитации реабилитационных центров CARF (Комиссия по аккредитации реабилитационных учреждений) в качестве специализированной программы по инсульту.Медицинский центр Университета Лойола сертифицирован Объединенной комиссией как комплексный центр лечения инсульта.
Риски
Причины и факторы риска ишемического инсульта
Ишемический инсульт вызывается сужением артерий головы или шеи. Это сужение может быть вызвано атеросклерозом (образование бляшек внутри артерии). Это состояние вызвано высоким уровнем холестерина, высоким кровяным давлением и курением.
Другие причины включают:
- Сгустки крови в сердце в результате фибрилляции предсердий (нерегулярное сердцебиение), сердечного приступа или аномалий сердечных клапанов
- Травма сосудов шеи
- Нарушения свертывания крови
- Внутривенное применение
Факторы риска
- Возраст: большинству людей с ишемическим инсультом 60 лет и старше
- Пол: женщины более подвержены ишемическому инсульту, чем мужчины
- Раса: афроамериканцы более вероятны, чем другие расы
- Высокое кровяное давление
- Болезнь сердца
- Курение
- Диабет
Симптомы
Симптомы и признаки ишемического инсульта
Очень важно действовать при первых признаках инсульта.Немедленно позвоните в службу 911, если у вас или у вашего близкого появятся признаки инсульта или мини-инсульта.
Когда вы и ваши близкие узнаете признаки инсульта, вы сможете получить медицинскую помощь раньше. В компании Loyola мы говорим: «Время равняется мозгу». чем дольше вы осознаете необходимость медицинской помощи, тем больше клеток мозга вы можете потерять.
Основные признаки и симптомы инсульта включают:
- Замешательство, головокружение или неустойчивость, быстро развивающиеся
- Затруднения при разговоре или понимании говорящего
- Внезапная слабость или онемение лица, руки или ноги, особенно одной стороны тела
- Неожиданная, внезапная и сильная головная боль или головная боль типа «грома»
- Быстрая потеря зрения, особенно на один глаз
Не игнорируйте свои симптомы, даже если они длятся всего 5–10 минут.Если у вас был только один из этих симптомов, вам необходимо немедленно пройти обследование.
Диагноз
Как диагностируется ишемический инсульт?
Ваш сертифицированный невролог быстро проведет физическое и неврологическое обследование и задаст вам несколько вопросов о ваших симптомах, проверив ваш:
- Весы
- Тираж
- Понимание
- Координация
- Сила мышц
- Мышечный тонус
- Рефлексы
- Чувство зрения и осязание
- Выступление
Ваш врач может назначить некоторые из следующих анализов:
Если вы перенесли инсульт в больнице, отличной от Лойолы, наших экспертов могут попросить проконсультироваться по вашему случаю, используя наши средства телемедицины для лечения инсульта. Используя дистанционно управляемые роботизированные системы, специалисты по инсульту Лойолы могут помочь пациентам в других больницах или даже в другом городе, проконсультировавшись с врачами пациента через Интернет. С помощью телемедицины наши неврологи могут напрямую общаться с пациентом или его семьей. Эта технология позволяет нашим врачам предлагать пациентам квалифицированную медицинскую помощь и специализированные консультации в любое время и в любом месте. Узнайте больше об инструментах телемедицины при инсульте.
Используя дистанционно управляемые роботизированные системы, специалисты по инсульту Лойолы могут помочь пациентам в других больницах или даже в другом городе, проконсультировавшись с врачами пациента через Интернет. С помощью телемедицины наши неврологи могут напрямую общаться с пациентом или его семьей. Эта технология позволяет нашим врачам предлагать пациентам квалифицированную медицинскую помощь и специализированные консультации в любое время и в любом месте. Узнайте больше об инструментах телемедицины при инсульте.
Лечение
Лечение и уход при ишемическом инсульте
Немедленно позвоните в службу 911, если у вас или вашего близкого появятся какие-либо признаки инсульта или мини-инсульта.
Услуги экспертов Loyola охватывают все аспекты лечения пациентов с инсультом и их семей, включая неотложное лечение инсульта. Поскольку первые три часа после инсульта критически важны, бригада неотложной помощи Лойолы умеет немедленно определять лучший курс лечения с помощью различных тестов и диагностических процедур. Лойола оказывает круглосуточную помощь при инсульте 365 дней в году.
Сразу после инсульта или мини-инсульта вы можете ожидать:
- Если у вас заблокирована артерия, ваш врач порекомендует вам сделать операцию, называемую каротидной эндартерэктомией.
- Ваш врач Лойола, скорее всего, направит вас в больницу для наблюдения и проведения анализов.
- Вы также можете получать препараты для тромболитической терапии, такие как внутривенное введение tPA (активатор тканевого плазминогена), или препараты для разжижения крови, такие как аспирин или кумадин.
- Ваши врачи и медсестры обсудят с вами, как при необходимости изменить образ жизни.
- Вам будет предложено бросить курить, если вы курите.
Loyola также предлагает долгосрочные услуги по постоянному уходу после инсульта, в том числе:
- Лечение острого инсульта — если пациенты перенесли острый инсульт, они могут получить круглосуточное наблюдение и помощь в отделении острого инсульта Лойолы.
 Команда специалистов по лечению острого инсульта работает с нашими пациентами, чтобы выявлять возможные осложнения, отслеживать изменения в работе сердца и мозга, а также оценивать и лечить причину инсульта. Если пациент находится в критическом состоянии, помощь оказывается в ультрасовременном отделении нейрореанимации Лойолы.
Команда специалистов по лечению острого инсульта работает с нашими пациентами, чтобы выявлять возможные осложнения, отслеживать изменения в работе сердца и мозга, а также оценивать и лечить причину инсульта. Если пациент находится в критическом состоянии, помощь оказывается в ультрасовременном отделении нейрореанимации Лойолы. - Специализированная стационарная помощь при инсульте — Центр инсульта Лойола и отделение нейрореанимации укомплектованы сертифицированными неврологами, госпиталистами и медсестрами, которые работают круглосуточно, 365 дней в году, чтобы выявлять и реагировать на нюансы инсульта. Наше специализированное стационарное отделение клинической неврологии представляет собой отделение на 40 коек, в котором эта многопрофильная команда оценивает и определяет методы лечения и уход за пациентами с острым ишемическим и геморрагическим инсультом, заболеваниями сонных артерий и другими сложными цереброваскулярными заболеваниями.Наша цель — предоставить всем пациентам наилучший результат.
Инсульт Транзиторная ишемическая атака ТИА — Неврология — Хайленд Госпиталь
Инсульт и транзиторная ишемическая атака (ТИА)
Инсульт — неотложная медицинская помощь. Больница Хайленд — это инсультный центр штата Нью-Йорк, а неврология Хайленда является неотъемлемой частью медицинской группы, которая обеспечивает всестороннюю оценку и лечение инсульта. От отделения неотложной помощи до амбулаторного отделения наши пациенты проходят ультрасовременную оценку для лечения и профилактики инсульта.
Симптомы инсульта
В зависимости от пораженной области мозга существует множество возможных симптомов инсульта. По данным Американской ассоциации инсульта, некоторые общие симптомы включают:
- Внезапное онемение или слабость лица, руки или ноги, особенно одной стороны тела
- Внезапное замешательство, проблемы с речью или пониманием
- Внезапное ухудшение зрения одним или обоими глазами
- Внезапное нарушение ходьбы, головокружение, потеря равновесия или координации
- Внезапная сильная головная боль без установленной причины
Доступны методы лечения, но их необходимо проводить в течение нескольких часов после появления симптомов. Если вы считаете, что у кого-то из ваших знакомых инсульт, позвоните в службу 9-1-1 и немедленно доставьте его в больницу.
Если вы считаете, что у кого-то из ваших знакомых инсульт, позвоните в службу 9-1-1 и немедленно доставьте его в больницу.
Различные виды инсульта
Симптомы инсульта возникают из-за нарушения кровоснабжения головного мозга (или, реже, спинного мозга). Существует два основных вида инсульта: ишемический и геморрагический. Ишемический инсульт возникает, когда закупорка кровеносного сосуда не позволяет крови течь в часть мозга. Геморрагический инсульт возникает, когда кровеносный сосуд лопается или протекает и препятствует притоку крови к мозгу.
A транзиторная ишемическая атака (ТИА) — это временное прерывание кровотока в головном мозге. Симптомы ТИА идентичны симптомам инсульта, но по определению симптомы исчезают менее чем за 24 часа без постоянных неврологических проблем. К сожалению, диагноз ТИА можно поставить только задним числом. Все симптомы инсульта являются неотложными, и их необходимо незамедлительно обследовать в отделении неотложной помощи.
Ишемический инсульт
Ишемический инсульт — наиболее частая форма инсульта.Кровоток прерывается из-за закупорки одной из артерий, по которой кровь поступает в мозг. Ишемические инсульты обычно безболезненны. Есть много разных симптомов, но во всех случаях нервные клетки начинают страдать немедленно и умирают в течение нескольких минут, если кровоток не восстановится. Доступны новые мощные лекарства для растворения тромбов, но их необходимо вводить в течение трех часов с момента появления симптомов. Тем не менее, даже когда пациенты не подходят для приема таких сильнодействующих лекарств, доступно лечение, позволяющее минимизировать ущерб и оптимизировать выздоровление.
Геморрагический инсульт
Геморрагический инсульт возникает, когда кровеносный сосуд в головном мозге лопается или протекает. Это предотвращает приток крови к мозгу и вызывает гибель нервных клеток. В отличие от ишемического инсульта, пациенты с геморрагическим инсультом часто испытывают головную боль и даже могут потерять сознание. Лечение включает в себя лекарства для снижения давления в головном мозге, контроля высокого кровяного давления и улучшения кровотока. В некоторых случаях показано хирургическое вмешательство. Становятся доступными новые методы лечения геморрагического инсульта, которые должны улучшить диапазон возможных методов лечения.Получите дополнительную информацию о новых методах лечения от Stroke Association.
Лечение включает в себя лекарства для снижения давления в головном мозге, контроля высокого кровяного давления и улучшения кровотока. В некоторых случаях показано хирургическое вмешательство. Становятся доступными новые методы лечения геморрагического инсульта, которые должны улучшить диапазон возможных методов лечения.Получите дополнительную информацию о новых методах лечения от Stroke Association.
Причины инсульта
Многие из тех же состояний, которые вызывают сердечные приступы, также способствуют инсульту, и все они могут быть изменены с помощью лечения и изменения образа жизни. Эти условия включают:
- Высокое артериальное давление
- Высокий холестерин
- Плохо контролируемый диабет
- Плохое питание
- Ожирение
- Курение
К другим факторам риска относятся сужение основных артерий, по которым кровь идет в мозг, и некоторые нарушения сердечного ритма (особенно фибрилляция предсердий).
Оценка инсульта
Первичная оценка инсульта проводится сразу после прибытия техников скорой медицинской помощи. Эти специалисты обучены распознавать ранние симптомы инсульта в полевых условиях и предупреждать персонал скорой помощи больниц о приближении потенциальной жертвы инсульта.
Как только пациент поступает в отделение неотложной помощи, его быстро осматривает и оценивает группа профессионалов, включая врачей скорой медицинской помощи, практикующих медсестер, медсестер, фельдшеров, неврологов и нейрорадиологов.В зависимости от состояния пациента можно проконсультироваться со специалистами нейрохирургии или интенсивной терапии. Выполняется быстрый сбор анамнеза и обследование, а также срочный анализ крови и биохимический анализ крови. Также обычно выполняется компьютерная томография (компьютерная томография или компьютерная томография). На основе всей этой информации принимается решение о том, как лучше всего лечить пациента, чтобы остановить или обратить вспять повреждение от инсульта и минимизировать любые остаточные проблемы.
Хотя каждый случай индивидуален, большинство пациентов поступают в больницу для дальнейшего обследования, включая магнитно-резонансную томографию (МРТ), мониторинг сердца, другие сердечные тесты, а также оценку сужения или закупорки основных кровеносных сосудов, идущих к мозгу.Большинство пациентов также проходят обследование у специалистов в области физиотерапии, трудотерапии, патологии речи и реабилитационной медицины.
Лечение инсульта
Когда случается удар, время — это мозг. Исследование, опубликованное доктором Джеффри Савером из Центра инсульта Калифорнийского университета в Лос-Анджелесе, показало, что за каждую минуту без кровотока мозг типичного пациента, перенесшего инсульт, теряет 1 900 000 нервных клеток, 14 000 000 000 соединений между нервными клетками, 7.5 миль нервных волокон, и каждый час без лечения мозг пациента, перенесшего инсульт, стареет на 3,6 года (J. L. Saver. Время — это мозг — количественно. Stroke 2006, том 37, страницы 263-266).
Лечение ишемического инсульта включает в себя сильнодействующие препараты, разрушающие сгустки крови, но их необходимо вводить в течение трех часов после появления симптомов. Другие методы физического удаления тромбов изучаются (дополнительную информацию см. В Национальных институтах здравоохранения).Однако у всех пациентов лечение в специализированных центрах по инсульту может минимизировать ущерб и улучшить исход инсульта, независимо от того, как долго сохраняются симптомы.
Лечение геморрагического инсульта направлено на стабилизацию состояния пациента, остановку кровотечения в головном мозге, контроль давления в головном мозге и предотвращение повторного кровотечения. Опять же, все пациенты получают пользу от квалифицированного лечения, доступного в назначенных центрах инсульта. В некоторых случаях хирургическое удаление крови может спасти жизнь.
Предотвращение инсульта
Важной частью оценки инсульта является определение того, почему у пациента вообще был инсульт.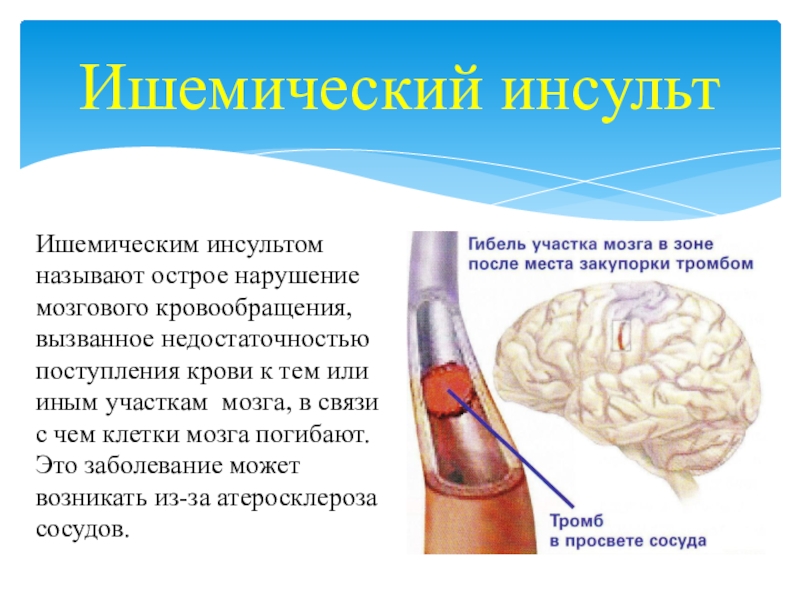 Как только это станет известно, дальнейшее лечение направлено на предотвращение новых инсультов в будущем. Возможные методы лечения включают использование антитромбоцитарных средств (таких как аспирин), лекарств, снижающих уровень холестерина, лекарств от кровяного давления, а иногда и препаратов, разжижающих кровь, чтобы снизить риск повторного инсульта. Наши неврологи по инсульту в Highland Neurology работают с пациентом и другими поставщиками медицинских услуг после выписки, чтобы способствовать реабилитации и минимизировать риск инсульта в будущем.
Как только это станет известно, дальнейшее лечение направлено на предотвращение новых инсультов в будущем. Возможные методы лечения включают использование антитромбоцитарных средств (таких как аспирин), лекарств, снижающих уровень холестерина, лекарств от кровяного давления, а иногда и препаратов, разжижающих кровь, чтобы снизить риск повторного инсульта. Наши неврологи по инсульту в Highland Neurology работают с пациентом и другими поставщиками медицинских услуг после выписки, чтобы способствовать реабилитации и минимизировать риск инсульта в будущем.
Полезные ресурсы
Publicaciones en Español
Неврологическое ухудшение в острой фазе ишемического инсульта | Цереброваскулярные заболевания | JAMA Neurology
Фон Хотя возможности для интенсивного наблюдения за пациентами с инсультом все еще ограничены, пациенты с риском раннего неврологического ухудшения плохо определены.
Объектив Выявить пациентов с риском неврологического ухудшения.
Дизайн Первоначальную когорту оценивали с помощью шкалы инсульта Национального института здоровья (NIH-SS) при поступлении в больницу и снова через 48-72 часа.
Настройка Одиннадцать неврологических отделений с отделениями острого инсульта.
Пациенты В общей сложности 1964 пациента поступили последовательно в течение 4 часов после появления симптомов острой церебральной ишемии.
Основные показатели результатов Основные причины и возможные предикторы неврологического ухудшения.
Результаты В общей сложности 256 пациентов (13,0%) имели повышение на 1 балл или более по шкале NIH-SS через 48–72 часа. Ухудшение неврологии было связано с прогрессирующим инсультом у 33,6% пациентов, повышением внутричерепного давления у 27,3%, рецидивирующей церебральной ишемией у 11,3% и вторичным паренхиматозным кровоизлиянием у 10,5%. Многофакторный логистический регрессионный анализ выявил окклюзию внутренней сонной артерии, окклюзию медиальной мозговой артерии (M1), территориальный инфаркт, инфаркт ствола мозга и сахарный диабет в качестве независимых предикторов неврологического ухудшения по шкале NIH-SS.Ухудшение основных неврологических функций (сознания, взгляда, двигательной функции рук или ног и речи) произошло у 223 пациентов (11,4%), а ухудшение на 4 балла и более по общему баллу NIH-SS произошло у 148 пациентов (7,5%). .
Многофакторный логистический регрессионный анализ выявил окклюзию внутренней сонной артерии, окклюзию медиальной мозговой артерии (M1), территориальный инфаркт, инфаркт ствола мозга и сахарный диабет в качестве независимых предикторов неврологического ухудшения по шкале NIH-SS.Ухудшение основных неврологических функций (сознания, взгляда, двигательной функции рук или ног и речи) произошло у 223 пациентов (11,4%), а ухудшение на 4 балла и более по общему баллу NIH-SS произошло у 148 пациентов (7,5%). .
Заключение Помимо исходной тяжести инсульта и сопутствующих состояний, ультразвуковое исследование и визуализация могут предоставить ценную информацию о риске ухудшения симптомов инсульта в острой фазе и, таким образом, могут выявить пациентов, которым будет наиболее полезен интенсивный мониторинг.
Неврологическое ухудшение после острого ишемического инсульта — частое наблюдение в повседневной клинической практике и в различных предыдущих исследованиях. 1 -13 Поскольку мало что можно сделать для изменения течения инсульта до госпитализации, большинство исследований было сосредоточено на неврологическом ухудшении, происходящем после госпитализации. Чем позже пациент поступает в больницу после появления симптомов ишемии, тем больше вероятность того, что вторичное ухудшение произойдет до базовой оценки и, таким образом, будет упущено.Однако некоторые исследования основывали свое определение неврологического ухудшения на очень короткой задержке от начала ишемических симптомов до госпитализации. Эти исследования основаны либо на небольших, либо на тщательно отобранных когортах пациентов. 7 , 13 Поэтому мы сосредоточили наше исследование на неврологическом ухудшении, которое оценивалось через 48-72 часа после поступления у пациентов, поступивших в течение 4 часов после появления симптомов, включая пациентов с ишемическим инсультом и транзиторными ишемическими атаками.
В исследовании приняли участие одиннадцать неврологических отделений (Немецкое сотрудничество по изучению инсульта). Набор пациентов начался 1 июля 2000 г. и закончился 15 марта 2002 г. Подробности сбора и обработки данных были описаны в предыдущих публикациях. 14 , 15 Все пациенты получали лечение в соответствии с лучшими современными знаниями клинической практики. Визуализирующие исследования были выполнены для исключения пациентов с первичным кровотечением и другими причинами, кроме церебральной ишемии. Пациенты или их ближайшие родственники были проинформированы об участии в исследовании, и было получено информированное письменное согласие на передачу личных данных в координационный центр.Исследование было одобрено этическим комитетом Эссенского университета, а аспекты безопасности данных были одобрены ответственным представителем государства по защите данных. Тяжесть инсульта оценивалась с использованием шкалы инсульта Национального института здоровья (NIH-SS) при поступлении в больницу и через 48–72 часа спустя. 16 Исследователей обучили применению NIH-SS с помощью видеозаписей и других клинических исследований. Ухудшение инсульта определялось как увеличение общего балла NIH-SS на 1 балл или более с момента поступления в больницу до 48–72 часов спустя.Согласно международно признанному определению, мы также исследовали ухудшение в течение 48–72 часов после поступления в один из следующих пунктов NIH-SS: уровень сознания, взгляд, двигательная функция рук и ног и речь. 1 Наконец, мы также исследовали ухудшение на 4 балла или более по шкале NIH-SS в течение 48–72 часов после поступления в больницу. Основные причины неврологического ухудшения были определены в предыдущих публикациях. 17 Кроме того, мы определили прогрессирующий инсульт как прогрессирующее ухудшение неврологического дефицита без признаков повышения внутричерепного давления, рецидивирующей ишемии головного мозга или вторичного паренхиматозного кровотечения.Центральное последующее наблюдение проводилось посредством телефонного интервью в координационном центре или в самой лечебной больнице, если пациент не соглашался на передачу личных данных.
Набор пациентов начался 1 июля 2000 г. и закончился 15 марта 2002 г. Подробности сбора и обработки данных были описаны в предыдущих публикациях. 14 , 15 Все пациенты получали лечение в соответствии с лучшими современными знаниями клинической практики. Визуализирующие исследования были выполнены для исключения пациентов с первичным кровотечением и другими причинами, кроме церебральной ишемии. Пациенты или их ближайшие родственники были проинформированы об участии в исследовании, и было получено информированное письменное согласие на передачу личных данных в координационный центр.Исследование было одобрено этическим комитетом Эссенского университета, а аспекты безопасности данных были одобрены ответственным представителем государства по защите данных. Тяжесть инсульта оценивалась с использованием шкалы инсульта Национального института здоровья (NIH-SS) при поступлении в больницу и через 48–72 часа спустя. 16 Исследователей обучили применению NIH-SS с помощью видеозаписей и других клинических исследований. Ухудшение инсульта определялось как увеличение общего балла NIH-SS на 1 балл или более с момента поступления в больницу до 48–72 часов спустя.Согласно международно признанному определению, мы также исследовали ухудшение в течение 48–72 часов после поступления в один из следующих пунктов NIH-SS: уровень сознания, взгляд, двигательная функция рук и ног и речь. 1 Наконец, мы также исследовали ухудшение на 4 балла или более по шкале NIH-SS в течение 48–72 часов после поступления в больницу. Основные причины неврологического ухудшения были определены в предыдущих публикациях. 17 Кроме того, мы определили прогрессирующий инсульт как прогрессирующее ухудшение неврологического дефицита без признаков повышения внутричерепного давления, рецидивирующей ишемии головного мозга или вторичного паренхиматозного кровотечения.Центральное последующее наблюдение проводилось посредством телефонного интервью в координационном центре или в самой лечебной больнице, если пациент не соглашался на передачу личных данных. Исход пациента оценивался с использованием индекса Бартеля в течение 85–120 дней после события или путем подтверждения смерти в течение 120 дней после первоначального инсульта. В противном случае последующие данные о функциональном состоянии считались пропущенными для анализа. В это исследование были включены только пациенты с острыми симптомами церебральной ишемии, которые были госпитализированы в течение 4 часов с момента начала заболевания и не были интубированы или находились в коме при поступлении.Схема включения пациентов представлена на рисунке.
Исход пациента оценивался с использованием индекса Бартеля в течение 85–120 дней после события или путем подтверждения смерти в течение 120 дней после первоначального инсульта. В противном случае последующие данные о функциональном состоянии считались пропущенными для анализа. В это исследование были включены только пациенты с острыми симптомами церебральной ишемии, которые были госпитализированы в течение 4 часов с момента начала заболевания и не были интубированы или находились в коме при поступлении.Схема включения пациентов представлена на рисунке.
Статистический анализ выполняли с использованием программного обеспечения (SPSS версии 10.0; SPSS Inc, Чикаго, Иллинойс). Если одна переменная не была доступна для всех пациентов, сообщалось только о достоверных случаях. Если для какой-либо переменной отсутствовало более 1% наблюдений, также указывалось количество допустимых наблюдений. Для лучшей идентификации пациентов с риском неврологического ухудшения мы разработали 3 модели логистической регрессии и включили все статистически значимые переменные из описательного анализа, которые можно было оценить в первые часы после поступления в больницу.Количество событий на переменную было больше 20. Тем не менее, мы включили только те переменные, в результате которых получилось P <0,01. Любая переменная с P > 0,05 была исключена пошагово. В окончательной модели представлены коэффициенты регрессии со стандартными ошибками, отношениями шансов и 95% доверительными интервалами.
Из 1964 пациентов, включенных в это исследование, 846 (43,1%) составляли женщины. Средний возраст пациентов составлял 67,6 года (средний возраст 70 лет; возрастные квартили 61 и 77 лет).Согласно модифицированной классификации TOAST (испытание ORG 10172 в лечении острого инсульта), 18 причина церебральной ишемии была классифицирована как атеросклеротическая болезнь или поражение крупных сосудов у 335 пациентов (17,1%), кардиоэмболическая у 599 пациентов (30,5%), лакунарная болезнь или поражение мелких сосудов у 291 пациента (14,8%), «другое» у 106 пациентов (5,4%) и неустановленное у 633 пациентов (32,2%). В общей сложности 354 пациента (18,0%) были классифицированы как пациенты с преходящей ишемической атакой с полным восстановлением симптомов в течение 24 часов.Семьдесят три пациента (3,7%) также участвовали в клинических исследованиях, ни в одном из которых не было обнаружено ухудшения неврологического статуса. Неврологическое ухудшение по общему баллу NIH-SS через 48–72 часа наблюдалось у 256 пациентов (13,0%). Ухудшение сознания через 48-72 часа наблюдалось у 127 пациентов (6,5%), а 43 пациента (2,2%) были интубированы. Подтверждение смерти или контрольное интервью в течение 120 дней после госпитализации было получено у 1522 пациентов (77,5%). Из этих пациентов 167 (11.0%) умерли, 563 (37,0%) функционально не восстановились, а 792 (52,0%) полностью выздоровели с индексом Бартеля 95 или выше.
В общей сложности 354 пациента (18,0%) были классифицированы как пациенты с преходящей ишемической атакой с полным восстановлением симптомов в течение 24 часов.Семьдесят три пациента (3,7%) также участвовали в клинических исследованиях, ни в одном из которых не было обнаружено ухудшения неврологического статуса. Неврологическое ухудшение по общему баллу NIH-SS через 48–72 часа наблюдалось у 256 пациентов (13,0%). Ухудшение сознания через 48-72 часа наблюдалось у 127 пациентов (6,5%), а 43 пациента (2,2%) были интубированы. Подтверждение смерти или контрольное интервью в течение 120 дней после госпитализации было получено у 1522 пациентов (77,5%). Из этих пациентов 167 (11.0%) умерли, 563 (37,0%) функционально не восстановились, а 792 (52,0%) полностью выздоровели с индексом Бартеля 95 или выше.
Пациенты с неврологическим ухудшением имели худший неврологический статус по шкале NIH-SS при поступлении в больницу, чаще диагностировали сахарный диабет и больше территориальных инфарктов и инфарктов ствола головного мозга (все статистически значимо) (Таблица 1). Окклюзии внутренней сонной артерии (ВСА) и средней мозговой артерии (СМА) (M1) также статистически значимо чаще обнаруживались у пациентов с неврологическим ухудшением, тогда как классификация микроангиопатии по критериям TOAST встречалась реже.Дополнительные характеристики этих пациентов приведены в Таблице 1. Причины неврологического ухудшения были классифицированы как прогрессирующий инсульт у 33,6% пациентов, внутричерепное давление у 27,3%, рецидивирующая ишемия головного мозга у 11,3% и вторичное паренхиматозное кровотечение у 10,5%. Многофакторный логистический регрессионный анализ выявил окклюзию ВСА, инфаркт ствола мозга, окклюзию СМА (M1), территориальный инфаркт и сахарный диабет как независимые предикторы неврологического ухудшения через 48-72 часа с использованием NIH-SS (Таблица 2).При использовании порога 0,120 полученная модель имела чувствительность 68,0% и специфичность 66,6%.
Из 256 пациентов с ухудшением неврологического статуса 43 были интубированы через 48–72 часа после поступления в больницу. У остальных пациентов чаще всего наблюдалось ухудшение пареза руки (37,6%), пареза ног (35,1%), уровня сознания (28,6%), сенсорного дефицита (27,2%) и дизартрии (25,4%). Сорок четыре пациента (17,2%) с ухудшением неврологического статуса умерли до выписки из больницы. При первом наблюдении, через 85–120 дней после поступления в больницу, было обнаружено, что еще 23 пациента умерли, а 24 пациента не могли быть доступны для последующего наблюдения.
У остальных пациентов чаще всего наблюдалось ухудшение пареза руки (37,6%), пареза ног (35,1%), уровня сознания (28,6%), сенсорного дефицита (27,2%) и дизартрии (25,4%). Сорок четыре пациента (17,2%) с ухудшением неврологического статуса умерли до выписки из больницы. При первом наблюдении, через 85–120 дней после поступления в больницу, было обнаружено, что еще 23 пациента умерли, а 24 пациента не могли быть доступны для последующего наблюдения.
Пациенты с ухудшением любой ключевой неврологической функции (уровня сознания, взгляда, двигательной функции рук и ног и речи) через 48-72 часа после поступления в больницу включены в таблицу 1. Прогрессирующий инфаркт (31,8%) и повышение внутричерепного давления (18,8%). %) были наиболее частыми неврологическими причинами ухудшения состояния у этих пациентов. Окклюзия ВСА и СМА (M1), территориальный инфаркт и сахарный диабет были идентифицированы как независимые предикторы с использованием многомерного логистического регрессионного анализа (таблица 3).При использовании порога 0,115 полученная модель имела чувствительность 55,9% и специфичность 72,6%.
Характеристики пациентов с ухудшением на 4 балла или более по шкале NIH-SS до 48–72 часов после поступления в больницу представлены в таблице 1. Анализ многомерной логистической регрессии выявил окклюзию ВСА, территориальный инфаркт и окклюзию СМА (M1) как независимые предикторы. ухудшение на 4 балла и более по шкале NIH-SS в течение 48–72 часов после госпитализации (Таблица 4).При использовании порога 0,09 полученная модель имела чувствительность 68,9% и специфичность 68,4%.
Общая частота неврологического ухудшения после острой церебральной ишемии в 13,0% в этом исследовании кажется ниже, чем в предыдущих исследованиях. 1 -12 Одно из объяснений — это наше определение неврологического ухудшения, которое включало всех пациентов с сохраняющимся дефицитом при поступлении в больницу, чтобы обеспечить перспективную идентификацию пациентов из группы риска, и, таким образом, включало 18% пациентов с транзиторной ишемической атакой. Мы последовательно включали пациентов, поступивших в течение 4 часов после появления симптомов ишемии, что является очень жестким критерием включения по сравнению с предыдущими исследованиями. Стандартизированная переоценка через 48–72 часа после поступления в больницу охватывала острую фазу инсульта и, таким образом, включала 2 наиболее частые причины неврологического ухудшения: прогрессирующий инсульт и повышение внутричерепного давления. Однако мы не оценивали межэкспертную надежность между разными исследователями. Кроме того, ухудшение определенных дефицитов, таких как атаксия или дистальные двигательные функции, которые не включены в NIH-SS, или более преходящие дефициты могли остаться незамеченными согласно нашему определению неврологического ухудшения.С другой стороны, для более тяжелых инсультов ключевые неврологические функции или более высокий порог ухудшения общего балла NIH-SS могут быть более конкретными индикаторами неврологического ухудшения.
Мы последовательно включали пациентов, поступивших в течение 4 часов после появления симптомов ишемии, что является очень жестким критерием включения по сравнению с предыдущими исследованиями. Стандартизированная переоценка через 48–72 часа после поступления в больницу охватывала острую фазу инсульта и, таким образом, включала 2 наиболее частые причины неврологического ухудшения: прогрессирующий инсульт и повышение внутричерепного давления. Однако мы не оценивали межэкспертную надежность между разными исследователями. Кроме того, ухудшение определенных дефицитов, таких как атаксия или дистальные двигательные функции, которые не включены в NIH-SS, или более преходящие дефициты могли остаться незамеченными согласно нашему определению неврологического ухудшения.С другой стороны, для более тяжелых инсультов ключевые неврологические функции или более высокий порог ухудшения общего балла NIH-SS могут быть более конкретными индикаторами неврологического ухудшения.
Хотя для конкретных аспектов неврологического ухудшения были выявлены разные причины, при многомерном регрессионном анализе был выявлен последовательный набор независимых предикторов. Было показано, что окклюзия ВСА или СМА (M1) и территориальный инфаркт являются независимыми предикторами для всех определений неврологического ухудшения, тогда как сахарный диабет и инфаркт ствола мозга могут быть независимыми предикторами только для конкретных определений ухудшения.Другие исследования 8 -10 с различными определениями ухудшения также определили окклюзию ипсилатеральных церебральных артерий и степень инфаркта как предикторы неврологического ухудшения. В соответствии с предыдущими исследованиями, сахарный диабет 2 , 7 , 10 , 18 и рецидивная артериальная гипертензия 2 , 10 , 18 связаны с дальнейшим вторичным неврологическим ухудшением. Категории TOAST не были включены в анализ логистической регрессии, поскольку они редко известны в течение первых часов после острого инсульта. В отличие от недавней публикации Steinke and Ley, 3 микроангиопатия (болезнь мелких сосудов), однако, встречалась реже у пациентов со всеми типами неврологического ухудшения. Другое больничное исследование 8 из Лозаннского регистра инсультов также обнаружило снижение частоты заболеваний мелких сосудов у пациентов с неврологическим ухудшением во время или после госпитализации. Причинами этого несоответствия могло быть определение неврологического ухудшения и, в частности, задержка от начала ишемических симптомов до базовой неврологической оценки.Пациенты с заболеванием мелких сосудов часто имеют менее серьезные симптомы и чаще попадают в больницу с большей задержкой от начала их симптомов, к тому времени они, возможно, уже испытали частичное восстановление. Однако в этот момент они могут быть более восприимчивыми к неврологическому ухудшению из-за повторяющихся событий или курсов заикания. Недавнее исследование 19 обнаружило больший риск неблагоприятных долгосрочных исходов у пациентов с наибольшим улучшением в первый день после события.
В отличие от недавней публикации Steinke and Ley, 3 микроангиопатия (болезнь мелких сосудов), однако, встречалась реже у пациентов со всеми типами неврологического ухудшения. Другое больничное исследование 8 из Лозаннского регистра инсультов также обнаружило снижение частоты заболеваний мелких сосудов у пациентов с неврологическим ухудшением во время или после госпитализации. Причинами этого несоответствия могло быть определение неврологического ухудшения и, в частности, задержка от начала ишемических симптомов до базовой неврологической оценки.Пациенты с заболеванием мелких сосудов часто имеют менее серьезные симптомы и чаще попадают в больницу с большей задержкой от начала их симптомов, к тому времени они, возможно, уже испытали частичное восстановление. Однако в этот момент они могут быть более восприимчивыми к неврологическому ухудшению из-за повторяющихся событий или курсов заикания. Недавнее исследование 19 обнаружило больший риск неблагоприятных долгосрочных исходов у пациентов с наибольшим улучшением в первый день после события.
Для предотвращения или лечения различных причин неврологического ухудшения необходимы различные методы лечения. В настоящее время общепризнано, что ингибиторы агрегации тромбоцитов обеспечивают умеренную защиту от рецидивирующей ишемии головного мозга. Пока не существует эффективной терапии для предотвращения или лечения вторичного паренхиматозного кровоизлияния. Краниотомия и гипотермия, единственные, казалось бы, эффективные симптоматические методы лечения крупных инфарктов головного мозга с риском внутричерепного давления, по-прежнему ограничиваются отдельными пациентами и центрами инсульта. 20 , 21 Ни системный тромболизис 7 , ни какой-либо из более чем 50 нейропротективных препаратов, протестированных в клинических испытаниях за последние 10 лет, не снижают риск раннего неврологического ухудшения у пациентов. Остается неясным, может ли коррекция гипергликемии, гипертермии или чрезмерного артериального давления в острой фазе снизить риск неврологического ухудшения. Тем не менее, пациенты с риском неврологического ухудшения должны находиться под тщательным наблюдением в отделениях интенсивной терапии или отделениях острого инсульта.Перспективная идентификация этих пациентов может быть полезна для выделения ограниченных ресурсов для наблюдения или интенсивной терапии.
Тем не менее, пациенты с риском неврологического ухудшения должны находиться под тщательным наблюдением в отделениях интенсивной терапии или отделениях острого инсульта.Перспективная идентификация этих пациентов может быть полезна для выделения ограниченных ресурсов для наблюдения или интенсивной терапии.
Для корреспонденции: Кристиан Веймар, доктор медицины, кафедра неврологии, Университет Дуйсбург-Эссен, Hufelandstr. 55, 45122 Эссен, Германия ([email protected]).
Принята к публикации: 7 июня 2004 г.
Вклад авторов: Концепция и дизайн исследования : Веймар и Динер. Сбор данных : Веймар, Мик, Бухталь, Эренфельд и Шмид. Анализ и интерпретация данных : Веймар и Динер. Составление рукописи : Веймар, Бухталь и Шмид. Критический пересмотр рукописи для важного интеллектуального содержания : Мик, Эренфельд и Динер. Статистический анализ : Веймар и Динер. Получено финансирование : Weimar and Diener. Административная, техническая и материальная поддержка : Веймар, Бухталь и Эренфельд. Научное руководство : Diener.
Члены группы: Соавторы Немецкого сотрудничества по изучению инсульта: Krankenanstalten Gilead Bielefeld (C. Hagemeister, MD), Rheinische Kliniken Bonn (C. Kley, MD), Саарландский университет (P. Kostopoulos, MD), Университет Йены (V. Willig, MD), Магдебургский университет (M. Goertler, MD), Klinikum Minden (J. Glahn, MD), Städtisches Krankenhaus München Harlaching (K. Aulich, MD), Университет Ростока (A. Kloth, MD) ), Bürgerhospital Stuttgart (T.Мик, доктор медицины), Ульмский университет (М. Рипе, доктор медицины) и Эссенский университет (В. Зегарак, доктор медицины).
Финансирование / поддержка: Это исследование было поддержано Федеральным министерством образования и исследований Германии в рамках программы Competence Net Stroke и Deutsche Forschungsgemeinschaft (DI 327 / 8-1).
Благодарность: Мы благодарим Клауса Крайвинкеля, MD, MSc, и Питера Доммеса, PhD, за их усилия по централизованному сбору и управлению данными.
1.Биршель PEllul JBarer D Прогрессирующий ход: к международно согласованному определению. Cerebrovasc Dis 2004; 17242–252PubMedGoogle ScholarCrossref 2. Парикмахерская MWright FStott DJLanghorne P Предикторы раннего неврологического ухудшения после ишемического инсульта: исследование случай-контроль. Геронтология 2004; 50102-109PubMedGoogle ScholarCrossref 4.Tei Хучияма Сохара ККобаяши Мучияма YFukuzawa M Ухудшение ишемического инсульта по 4 клиническим категориям, классифицированным Проектом по инсульту Оксфордшира. Инсульт 2000; 312049-2054PubMedGoogle ScholarCrossref 6.DeGraba Т.Дж.Халленбек JMPettigrew К.Д.Дутка AJKelly BJ Прогрессирование острого инсульта: значение начального балла по шкале NIH Stroke Scale для стратификации пациентов в будущих исследованиях. Stroke 1999; 301208-1212PubMedGoogle ScholarCrossref 7.Давалос AToni DIweins FLesaffre EBastianello SCastillo J Неврологическое ухудшение при остром ишемическом инсульте: потенциальные предикторы и связанные факторы в Европейском совместном исследовании острого инсульта (ECASS) I. Stroke 1999; 302631-2636Google ScholarCrossref 8. Ямамото ХГогуславский Джван Мелле G Различные предикторы неврологического ухудшения при разных причинах инсульта. Arch Neurol 1998; 55481-486PubMedGoogle ScholarCrossref 9.Toni ДФьорелли MBastianello S и другие. Улучшение острого ишемического инсульта в течение первых 48 часов от начала: предсказуемость, исход и возможные механизмы: сравнение с ранним ухудшением инсульта. Stroke 1997; 2810-14PubMedGoogle ScholarCrossref 10.Davalos ACendra Этуэль JMartinez MGenis D Ухудшение ишемического инсульта: факторы риска и прогноз. Неврология 1990; 401865-1869PubMedGoogle ScholarCrossref 12.Mohr JPCaplan Л. Р. Мельски JW и другие. Гарвардский кооперативный регистр инсультов: перспективный регистр. Неврология 1978; 28754-762PubMedGoogle ScholarCrossref 13.Toni ДФьорелли MGentile M и другие.Прогрессирующий неврологический дефицит вследствие острого ишемического инсульта: исследование предсказуемости, патогенеза и прогноза. Arch Neurol 1995; 52670-675PubMedGoogle ScholarCrossref 14, Weimar CKönig ИРКрайвинкель Кзиглер ADiener Возраст HC и шкала инсульта Национального института здоровья в течение 6 часов после начала являются точными предикторами исхода после церебральной ишемии: разработка и внешняя проверка прогностических моделей. Stroke 2004; 35158-162PubMedGoogle ScholarCrossref 15.Немецкое сотрудничество по исследованию инсульта, Прогнозирование исхода после острого ишемического инсульта: внешняя проверка прогностических моделей. Неврология 2004; 62581-585PubMedGoogle ScholarCrossref 16.Lyden PBrott TTilley B и другие. Повышенная надежность шкалы инсульта NIH с помощью видео-тренинга: Исследовательская группа по инсульту NINDS TPA. Stroke 1994; 252220-2226PubMedGoogle ScholarCrossref 18. Йоргенсен HSNakayama HRaaschou HOOlsen TS Влияние артериального давления и диабета на прогрессирование инсульта. Lancet 1994; 344156-159PubMedGoogle ScholarCrossref 19.Johnston SCLeira ЭХансен MDAdams HP Jr Раннее выздоровление после церебральной ишемии — риск последующего неврологического ухудшения. Ann Neurol 2003; 54439-444PubMedGoogle ScholarCrossref 20.Schwab Шаке W Хирургическая декомпрессия у пациентов с инфарктом большой средней мозговой артерии эффективна. Stroke 2003; 342304-2305PubMedGoogle ScholarCrossref 21.Георгиадис DSchwarz SAschoff ASchwab S Гемикраниэктомия и умеренная гипотермия у пациентов с тяжелым ишемическим инсультом. Инсульт 2002; 331584-1588PubMedGoogle ScholarCrossrefСимптомы инсульта, профилактика и клиники
В иллюстрациях Infiniti Graphics (infinitigraphics.com)
Что такое инсульт?
Инсульт или атака головного мозга происходит, когда сгусток крови блокирует кровеносный сосуд или когда кровеносный сосуд лопается, прерывая приток крови к определенной области мозга.
Ишемический инсульт возникает при закупорке кровеносного сосуда. Это наиболее распространенный вид инсульта.
Геморрагический инсульт (кровотечение в мозг) возникает при разрыве кровеносных сосудов. Этот тип инсульта встречается реже.
Что происходит с мозгом при инсульте?
Мозгу для выживания нужен кислород в крови. Когда кровоток нарушается, клетки той части мозга, которая получала эту кровь, могут погибнуть. Эти клетки обычно умирают в течение нескольких минут или нескольких часов после начала инсульта.Когда клетки умирают, выделяются химические вещества, которые могут вызвать гибель еще большего числа клеток. Вот почему существует небольшое окно возможностей для лечения ишемического инсульта.
Самая важная вещь, которую следует помнить, заключается в том, что чем раньше пострадавший от инсульта попадет в отделение неотложной помощи, тем больше шансов, что он сможет получить лечение, которое остановит или уменьшит повреждение мозга от инсульта.
Когда клетки мозга умирают, теряются функции, которые находились под контролем умирающего мозга.К ним относятся такие функции, как язык, речь, движение и ощущения. Конкретные утраченные или затронутые способности зависят от того, где в головном мозге происходит инсульт, и от размера инсульта.
Например, человек, перенесший небольшой инсульт, может испытывать лишь незначительные последствия, такие как слабость руки или ноги. С другой стороны, человек с более сильным инсультом может остаться парализованным с одной стороны или потерять способность выражать и обрабатывать речь. Некоторые люди полностью выздоравливают после менее серьезных инсультов, в то время как другие люди гибнут в результате очень тяжелых инсультов.
Каковы факторы риска инсульта?
Факторы риска — это заболевания или образ жизни, которые могут увеличить вероятность инсульта.
Факторы риска могут быть изменяемыми (то, что мы можем изменить) или немодифицируемыми (то, что мы не можем изменить).
Немодифицируемые факторы риска включают возраст, расу и пол.
Гипертония (высокое кровяное давление) является наиболее важным изменяемым фактором риска обоих типов инсульта.
Другие важные факторы риска включают употребление табака, диабет, высокий уровень холестерина, недостаток физической активности, нездоровое питание, употребление наркотиков и избыточное потребление алкоголя.
Фибрилляция предсердий, нарушение сердечного ритма, вызывающее образование тромбов в сердце, является еще одним важным фактором риска инсульта, особенно среди лиц пожилого возраста.
Каковы наиболее распространенные симптомы инсульта?
- Внезапное онемение или слабость лица, руки или ноги, особенно одной стороны тела
- Внезапное замешательство, проблемы с речью или пониманием
- Внезапное ухудшение зрения одним или обоими глазами
- Внезапное нарушение ходьбы, головокружение, потеря равновесия или координации
- Внезапная сильная головная боль без известной причины
Другие важные, но менее распространенные симптомы инсульта
- Внезапная тошнота и рвота
- Кратковременная потеря сознания или период снижения сознания (обморок, спутанность сознания, судороги или кома)
Используйте FAST, чтобы запомнить предупреждающие знаки!
F — Лицевой; попросите человека улыбнуться.Одна сторона обвисает?
А — Оружие; попросите человека поднять обе руки. Одна рука опускается вниз?
S — Речь; попросите человека повторить простую фразу. Есть ли речь невнятная или странная?
T — Время; Если вы заметили какой-либо из этих признаков, немедленно звоните 9-1-1!
Позвоните 911, если вы заметили или у вас есть какие-либо из этих симптомов.
Лечение инсульта
Единственным лекарством от ишемического инсульта, одобренным FDA, является лекарство под названием tPA, что означает тканевой активатор плазминогена.
Эта процедура, «спасающая мозг», растворяет сгусток, вызвавший инсульт. Это лекарство можно вводить только внутривенно в течение 4,5 часов после начала инсульта. Чем раньше будет дано лекарство, тем больше шансов вовремя восстановить кислород в умирающем мозге, чтобы предотвратить дальнейшие повреждения.
В зависимости от типа геморрагического (кровоточащего) инсульта существуют различные варианты лечения, включая хирургическое вмешательство.
Профилактика инсульта
Инсульты можно предотвратить.Подсчитано, что до 80% инсультов можно предотвратить, устраняя изменяемые факторы риска. Когда у человека случается инсульт, увеличивается риск повторного инсульта. Когда человек лечится от инсульта, ему назначаются лекарства и даются рекомендации для предотвращения дальнейших инсультов.
Снижение риска
- Выявление и лечение повышенного артериального давления
- Выявление и лечение диабета
- Бросить курить
- Выявление и лечение повышенного холестерина
- Принимайте препараты, разжижающие кровь, по рекомендации врача
- Регулярно занимайтесь спортом (более 30 минут в большинство дней недели)
- Избегайте повышенного содержания натрия и лишних жиров в рационе, чтобы поддерживать здоровый вес и предотвратить развитие гипертонии и диабета
Транзиторная ишемическая атака (ТИА) — НЕ «мини-инсульт»
Транзиторная ишемическая атака (ТИА) возникает, когда происходит кратковременная потеря кровотока в определенной области мозга.Поскольку кровоток восстанавливается самостоятельно, симптомы инсульта проходят сами по себе через несколько минут или часов.
ТИА — это признак того, что может произойти инсульт, и поэтому он так же опасен, как и инсульт. Мы избегаем использования термина «мини-удар», потому что он сводит к минимуму важность TIA. В первые дни, недели и месяцы после ТИА существует высокий риск инсульта. При появлении признаков ТИА важно обратиться за медицинской помощью.
Признаки ТИА и факторы риска ТИА такие же, как и для инсульта.Инсульт можно предотвратить, если адекватно оценить факторы риска и управлять ими после ТИА.
Анджейл Шарриф, MD / MPH
Ведущий директор отдела профилактики инсульта
Клиника по обучению и профилактике инсульта
Брошюра о клинике STEP
Директор, TIA Clinic
Муначи Окпала, RN NP
Практикующая медсестра клиники инсульта
Организатор общественной работы
Наши клиники
Клиника по обучению и профилактике инсульта (STEP)
Клиника STEP была разработана для удовлетворения многочисленных потребностей пациентов и лиц, осуществляющих уход, после инсульта или ТИА.
Клиника применяет комплексный подход к постинсультному лечению, предоставляя обучение, скрининг и лечение факторов риска, а также оценку и лечение постинсультных осложнений. Мы также подключаем пациентов и лиц, осуществляющих уход, к нашим партнерским клиникам, общественным программам и общественным ресурсам, которые помогают удовлетворить потребности после инсульта.
Клиника транзиторной ишемической атаки (ТИА)
Клиника ТИА была разработана для ускорения оценки пациентов, перенесших ТИА низкого риска.Пациентам, которые проходят обследование в отделении неотложной помощи MH-TMC, предоставляется возможность пройти обследование в ускоренном порядке в амбулаторных условиях. Они связаны с практикующим специалистом по профилактике инсульта и записываются на прием в клинику в течение 48 часов после посещения отделения неотложной помощи. Как только они начинают лечение в клинике, они получают все ресурсы, предоставляемые пациентам клиники STEP.
Запись на прием
Прием в клинику: 832-325-7080
Факс клиники: 713-512-2239
Щелкните здесь, чтобы получить доступ к «Инсульту для лечащего врача»
Миф против реальности
| Миф | Реальность |
| Инсульт невозможно предотвратить | Инсульт в значительной степени можно предотвратить |
| Инсульт не поддается лечению | Инсульт требует неотложной помощи |
| Инсульт поражает только пожилых людей | Инсульт может случиться с каждым в любом возрасте |
| Инсульт случился с сердцем | Инсульт в головном мозге |
| выздоровление происходит только в течение нескольких месяцев после инсульта | Восстановление после инсульта продолжается в течение всей жизни |
Предполагаемые механизмы, клинические характеристики и лечение
Возникновение и распространение высококонтагиозного нового коронавирусного заболевания (COVID-19) вызвало величайшую проблему общественного здравоохранения прошлого века.Острый ишемический инсульт возник не только как первичное респираторное заболевание, но и как его осложнение. Хотя текущие данные показывают, что COVID-19 может вызывать ишемический инсульт, особенно при тяжелом заболевании, есть сходства в факторах риска тяжелого COVID-19, а также ишемического инсульта, что подчеркивает сложную взаимосвязь между этими двумя состояниями. Пандемия создала проблемы для оказания помощи при остром инсульте. Быстрая оценка и своевременные вмешательства, необходимые для достижения оптимальных результатов в лечении острого инсульта, осложнились COVID-19 из-за необходимости принятия мер по профилактике передачи заболевания.Целью данной статьи является изучение предполагаемых механизмов ишемического инсульта при COVID-19 и клинических характеристик пациентов с COVID-19, у которых развивается ишемический инсульт. Кроме того, мы обсуждаем проблемы, связанные с ведением острого ишемического инсульта в условиях COVID-19, и рассматриваем текущие рекомендации по лечению. Мы также выделили потенциальные области для будущих исследований.
1. Введение
Возникновение и распространение высококонтагиозного нового коронавирусного заболевания (COVID-19) в конце 2019 года вызвало величайшую проблему общественного здравоохранения за последнее столетие.С более чем 6000000 подтвержденных случаев и более 300000 смертей за первые пять месяцев COVID-19 зарекомендовал себя как самая серьезная вспышка инфекционного заболевания в новейшей истории. Хотя это заболевание считается первичным респираторным заболеванием, имеются данные о мультисистемном поражении, включая неврологические проявления [1]. Гипогевзия, аносмия, судороги и инсульт — вот некоторые из неврологических признаков заболевания, о которых сообщают [2]. Хотя точная взаимосвязь между инсультом и COVID-19 все еще выявляется, появляется все больше свидетельств того, что заболевание может вызвать ишемический инсульт или усугубить уже существующий инсульт [3].Факторы риска, такие как мужской пол, пожилой возраст и наличие сопутствующих заболеваний, таких как гипертония, диабет и сердечные заболевания, являются предикторами тяжелой формы COVID-19 [4]. Эти факторы также являются предрасполагающими к инсульту, что лежит в основе сложной взаимосвязи между этими двумя состояниями. Кроме того, нынешняя пандемия имеет прямые и косвенные последствия для лечения инсульта. Пациенты, перенесшие инсульт, подвержены повышенному риску тяжелого заболевания при заражении COVID-19 [5]. Кроме того, пациенты с COVID-19, у которых развивается инсульт, подвергаются более высокому риску отрицательного исхода по сравнению с пациентами с инсультом без COVID-19 [6].С другой стороны, нагрузка на доступные медицинские ресурсы, вызванная пандемией, может негативно повлиять на услуги по оказанию помощи при инсульте, тем самым ограничивая доступ пациентов, перенесших инсульт, к быстрому и своевременному вмешательству [3]. Таким образом, в этом обзоре исследуются предполагаемые механизмы ишемического инсульта при COVID-19 и клинические характеристики инсульта у пациентов с COVID-19. Кроме того, мы рассматриваем текущие рекомендации по ведению и проблемам ведения пациентов с острым ишемическим инсультом в условиях COVID-19.
2. Патогенез ишемического инсульта при COVID-19
Коронавирус 2 тяжелого острого респираторного синдрома (SARS-CoV-2) представляет собой оболочечный одноцепочечный вирус с положительной РНК семейства Coronaviridae, содержащий фосфолипидный бислой. капсула, содержащая спайковые белки [7]. SARS-CoV-2 получает доступ к организму благодаря взаимодействию его белка-шипа (S) и ангиотензин-превращающего фермента 2 (ACE2), обнаруженного во многих тканях, таких как легкие, почки, сердце и кишечник [7]. Хотя детали патогенеза ишемического инсульта при COVID-19 все еще возникают, имеющиеся данные свидетельствуют о предполагаемых механизмах.
2.1. Коагулопатия
Текущие данные показывают, что коагулопатия с повышенным риском тромбоэмболических осложнений встречается у пациентов с COVID-19. «Коагулопатия, вызванная сепсисом» (SIC) возникла как признак тяжелого заболевания COVID-19 [8]. SIC — это более ранняя фаза диссеминированной внутрисосудистой коагулопатии (DIC), характеризующаяся повышенным содержанием D-димера, удлиненным протромбиновым временем и низким количеством тромбоцитов, но, в отличие от DIC, гипофибриногенемия отсутствует [9]. Это следует за синдромом системного воспалительного ответа, вызванным иммунным ответом на вирус, приводящим к эндотелиальной дисфункции и тромбозу микроциркуляции [10].Кроме того, наблюдается чрезмерное подавление фибринолиза за счет увеличения выработки ингибитора активатора плазминогена-1, что увеличивает риск тромбоза [11]. В отличие от ДВС-синдрома кровотечения нет. Артериальный и венозный тромбоз все чаще встречается у пациентов с COVID-19 [12].
Кроме того, наличие антифосфолипидных (APL) антител уже давно связано с протромботическим состоянием. В исследовании 56 пациентов с подтвержденным COVID-19, у 14 пациентов был положительный результат на антикоагулянт волчанки, а у пяти были анти-кардиолипин или анти- β 2 -гликопротеин-1 I gM или I gG антитела [ 13].Антитела APL связаны с артериальным и венозным тромбозом [10]. Однако APL-антитела часто обнаруживаются у здоровых людей, а повышенные уровни отмечаются как при вирусных, так и при бактериальных инфекциях [14]. До сих пор неясно, способствует ли наличие APL-антител у пациентов с COVID-19 коагулопатии или увеличивает риск ишемического инсульта.
2.2. Эндотелиальная дисфункция
Эндотелиальная дисфункция предрасполагает к образованию артериальных и венозных тромбозов.Нормальный эндотелий сосудов содержит про- и антитромботические факторы, которые обычно находятся в состоянии равновесия, чтобы предотвратить кровотечение или образование сгустков. Одним из возможных механизмов эндотелиальной дисфункции у пациентов с COVID-19 является истощение рецепторов ACE2, которые обнаруживаются в эндотелиальных клетках сосудов [9]. Гомолог ACE2 и ACE1 является неотъемлемой частью ренин-ангиотензин-альдостероновой системы [9]. Эта система имеет классическое плечо и ось рецепторов ренин / ACE1 / ангиотензин II / ангиотензин II типа 1, которая играет физиологическую и патологическую роль в заболеваниях почек, кровеносных сосудов, сердца и мозга, а также ACE2 / ангиотензин (1-7) / Ось рецептора сборки митохондрий (MasR), который был идентифицирован как негативный регулятор ангиотензина II [15].Ренин продуцируется юкстагломерулярными клетками почек и превращает ангиотензиноген, продуцируемый печенью, в ангиотензин I. ACE1 расщепляет ангиотензин I до ангиотензина II. Ангиотензин II, действуя через свои рецепторы, обладает вазопрессорным, провоспалительным и прокоагулянтным действием [9]. Было показано, что ингибиторы рецепторов ангиотензина II обладают антигипертензивным, а также нейропротекторным действием [16]. ACE2 противодействует действию ACE1, превращая ангиотензин II в ангиотензин (1-7), сосудорасширяющую и противовоспалительную молекулу, и превращая ангиотензин I в ангиотензин (1-9), который далее превращается в ангиотензин (1-7) [ 17].Ангиотензин (1–7) опосредует свое действие через рецептор Mas. Связываясь с ACE2, SARS-CoV-2 индуцирует эндоцитоз рецептора, тем самым приводя к истощению «защитного» эндотелиального ACE2 и смещая баланс в пользу ACE1 и ангиотензина II, с усилением провоспалительной предрасположенности и повреждением эндотелия [9].
Еще одним возможным механизмом повреждения эндотелия у пациентов с COVID-19 является иммунная гиперреакция, известная как цитокиновый шторм [18]. Этот неконтролируемый и чрезмерный выброс цитокинов при COVID-19 был описан как основной фактор, вызывающий полиорганную дисфункцию [18].Повышенные уровни цитокинов, таких как IL1- β , IL-7, IL-8, IL-9, IL-10, гранулоцитарно-макрофагальный колониестимулирующий фактор (GMCSF), IFN-γ , хемоаттрактантный белок моноцитов (MCP1 ), а фактор некроза опухоли- α (TNF α ) был зарегистрирован при COVID-19 [19]. Воспалительные цитокины вызывают активацию эндотелия, повышенную экспрессию молекул адгезии эндотелиальных лейкоцитов (ELAM), таких как молекула межклеточной адгезии 1 (ICAM-1), E-селектин и молекула адгезии сосудистых клеток 1 (VCAM-1), которые взаимодействуют с рецепторами на поверхности лейкоцитов [ 20].Эффект цитокинов и лейкоцит-опосредованное повреждение может нарушить целостность эндотелиальных клеток. Подробности того, насколько этот процесс способствует ишемическому инсульту у пациентов с COVID-19, все еще появляются.
2.3. Кардиоэмболия
Сообщается, что повреждение сердца является одной из основных причин смерти при COVID-19 после респираторной дисфункции [21]. Было показано, что повышенные маркеры сердечного повреждения, такие как тропонин I&T и креатининкиназа-MB, у пациентов с COVID-19 коррелируют с тяжестью заболевания [21].Было высказано предположение, что прямое вирусно-опосредованное повреждение и эффект цитокинового шторма ответственны за повреждение сердца при COVID-19 [22]. Это проявляется острым миокардитом, перикардитом, аритмией, шоком и сердечной недостаточностью [22]. Дисфункция эндотелия сердца и аритмия повышают риск сердечной тромбоэмболии и инсульта. Роль этого в ишемическом инсульте при COVID-19 пока остается гипотетической.
2.4. Прямая вирусная инвазия в центральную нервную систему
Для SARS-CoV-2 были предложены два потенциальных канала инвазии в ЦНС: (1) гематогенное распространение в мозговой кровоток от системного распространения и (2) передача через обонятельный эпителий через решетчатую форму. пластинка к обонятельной луковице [2].Поскольку вирус присутствует в общем кровообращении, включая мозговое кровообращение, вялая церебральная микроциркуляция усиливает взаимодействие между вирусным шиповым белком и ACE2 на церебральных эндотелиальных клетках [23]. Размножение и высвобождение вируса из эндотелиальных клеток может привести к повреждению эндотелия и обеспечить доступ вируса к мозгу [23]. Кроме того, рецепторы ACE2 были обнаружены на нейронах и глиальных клетках, что делает их потенциальной мишенью для SARS-CoV-2 [24]. Хотя точный механизм транскрибирующей инвазии SARS-CoV-2 до конца не изучен, модель инфекции SARS-CoV-1 на грызунах, близкий «двоюродный брат» SARS-CoV-2, показывает присутствие вируса в областях мозг соединяется с обонятельной луковицей после трансназального воздействия, что связано с гибелью нейронов [24].Наличие аносмии, гипогевзии и других неврологических проявлений у пациентов с COVID-19 подтверждают теорию прямого воздействия вируса на мозг [23]. Однако точная роль, которую это играет в ишемическом инсульте, все еще выясняется.
2.5. Иммуноглобулинотерапия
Отсутствие эффективной вакцины или терапии от COVID-19 привело к испытаниям плазмы выздоравливающих для лечения тяжелобольных пациентов с COVID-19 [25]. Внутривенная терапия иммуноглобулинами (IVIg) использовалась как для постконтактной профилактики, так и для лечения вирусных инфекций [25].Однако терапия ВВИГ имеет потенциальные осложнения. Риск тромбоэмболии, связанной с внутривенным введением иммуноглобулинов, оценивается от 0,6 до 4,5% [26]. Считается, что такие события, как инсульт, инфаркт миокарда, тромбоэмболия легочной артерии и тромбоз глубоких вен, вызваны повышением вязкости крови, вызванным ИГВВ, и тем самым предрасполагают к застою, что является фактором риска тромбообразования [26]. В исследовании с участием 206 пациентов с тяжелым острым респираторным дистресс-синдромом (SARS) у пяти пациентов развились церебральные инфаркты крупных артерий, причем три из них возникли у пациентов, получавших терапию IVIg [27].Пациенты в критическом состоянии имеют повышенный риск тромбоза, поэтому применение ИГВВ у этих пациентов может еще больше ухудшить риск тромбоэмболических событий. В настоящее время имеется ограниченное количество данных, подтверждающих роль терапии ИГВВ при ишемическом инсульте у пациентов с COVID-19.
3. Клинические характеристики пациентов с COVID-19 и инсультом
Сообщалось о случаях инсульта у пациентов с COVID-19. В ретроспективном исследовании 3556 пациентов с COVID-19 в больничной системе Нью-Йорка 32 (0.9%) развился ишемический инсульт [6]. 65,6% (21/32) имели криптогенный инсульт, а 34,4% (11/32) соответствовали критериям эмболического инсульта с неустановленным источником. По сравнению с пациентами, перенесшими инсульт без COVID-19, пациенты с COVID-19 были старше (средний возраст 70 против 63 лет), имели более высокий балл по шкале Национального института здоровья (NIHSS) при поступлении (средний балл-19 против 8). , с повышенным пиковым уровнем D-димера (> 10 000 по сравнению с 525 нг / мл) и с большей вероятностью имели криптогенный инсульт (65.6% против 34,4%) и с более высоким риском стационарной смертности (63,6% против 9,3%). У 25 пациентов развился инсульт в течение 1-27 дней от начала заболевания, а у пяти ранее не было симптомов.
Аналогичным образом одноцентровое ретроспективное исследование с участием 221 пациента с COVID-19 показало, что у 11 (5%) развился острый ишемический инсульт, при этом у одного пациента развился тромбоз вен головного мозга, а у другого — кровоизлияние в мозг [28]. По сравнению с другими пациентами с COVID-19 без инсульта, те, у кого развился инсульт, были старше (средний возраст 72 против 52 лет) и имели более высокую частоту сопутствующих заболеваний, таких как гипертония, диабет, перенесенный инсульт в анамнезе, а также нарушение функции печени и почек.Заболевание крупных артерий, заболевание средних сосудов и кардиоэмболические события были зарегистрированы у пяти, трех и трех пациентов соответственно. D-димер был в 12 раз выше у тех, у кого развился инсульт. У пациентов развился инсульт в течение 1-29 дней после инфицирования (в среднем 10 дней).
Хотя инсульт чаще встречается у пожилых людей, у более молодых пациентов с инсультом сообщалось о COVID-19. В ранее упомянутом исследовании вероятность инсульта была выше у молодых мужчин с повышенным уровнем тропонина в сыворотке крови по сравнению с контрольной группой в прошлом [6].Точно так же Оксли и его коллеги сообщили о пяти случаях инсульта крупных сосудов у пациентов с COVID-19 моложе 50 лет [29]. Сосудистыми территориями, участвующими в визуализации в случаях, являются территория средней мозговой артерии (три), задняя мозговая артерия (одна) и внутренняя сонная артерия (одна) [29]. У троих из пяти пациентов наблюдаются симптомы COVID-19, у двух — бессимптомно. Аналогичным образом, в исследовании сообщалось о трех пациентах с COVID-19 с ишемическим инсультом крупных сосудов после субокклюзивного тяжелого стеноза общей сонной артерии с тромбозом, распространяющимся на проксимальную внутреннюю сонную артерию [30].Трем пациентам было 33, 55 и 77 лет. В другом исследовании сообщалось о случае 40-летнего пациента с COVID-19 с отрицательным результатом обследования на прокоагулянт, у которого развился ишемический инсульт крупных сосудов с поражением средней мозговой артерии [31]. Аналогичное сообщение об ишемическом инсульте крупных артерий было обнаружено у пяти из 206 пациентов с SARS в исследовании [27]. В этом исследовании четыре пациента были старше 50 лет (54–68), а пятому пациенту было 39 лет. Связь между ишемическим инсультом крупных артерий и COVID-19 у молодых пациентов до конца не изучена; однако у этих пациентов это может быть связано с гиперкоагуляцией.
В ретроспективном исследовании 214 пациентов с COVID-19 в Ухане, Китай, у 5,7% развился инсульт. Эти данные были получены у пациентов с тяжелым заболеванием [32]. Маркеры тяжелого заболевания при COVID-19 включают лимфопению, лейкоцитоз, гипоальбуминемию, а также повышенные уровни аланинтрансаминазы, С-реактивного белка, ферритина, лактатдегидрогеназы и D-димера [33]. В исследовании, в котором сообщалось о шести пациентах с COVID-19, у которых развился ишемический инсульт, у всех пациентов была окклюзия крупных сосудов с заметно повышенным содержанием D-димеров.Волчаночные антикоагулянты, а также С-реактивный белок и ферритин были повышены у пяти пациентов [34]. Аналогичным образом, в исследовании четырех пациентов с ишемическим инсультом, у трех был повышенный уровень D-димера, а у двух — повышенный уровень С-реактивного белка [35].
Исход инсульта у пациентов с COVID-19 может отражать тяжесть заболевания. Оценка инсульта Национального института здоровья (NIHSS) использовалась для прогнозирования исхода инсульта. Те, у кого больше баллов, рискуют получить плохие результаты. По сравнению с пациентами с инсультом, у которых не было COVID-19, пациенты с инсультом и COVID-19 имели более высокий балл по шкале NIHSS [6].В исследовании Oxley с коллегами все пять пациентов с инсультом крупных сосудов имели оценку 13–23, что свидетельствует о более высоком риске неблагоприятного исхода заболевания [29]. Аналогичным образом, в ретроспективном исследовании шести пациентов с COVID-19, перенесших инсульт, пятеро умерли, а у одного был стойкий тяжелый неврологический дефицит [36].
4. Проблемы лечения инсульта в условиях COVID-19
COVID-19 прямо или косвенно влияет на лечение инсульта. С момента вспышки болезни было введено множество мер для борьбы с бичом этой инфекции, такие как меры изоляции, приостановка плановых процедур и обычных амбулаторных клиник, а также перераспределение ресурсов здравоохранения [37].По данным Всемирной организации по инсульту (WSO), многие страны столкнулись с перегрузкой больниц, что привело к перераспределению неврологических и инсультных коек, а также отделений интенсивной терапии (ОИТ), предназначенных для лечения инсульта, для ухода за пациентами с COVID-19 [3 ]. Кроме того, во многих больницах произошло переключение врачей и медсестер, занимающихся инсультом, на лечение COVID-19 [38]. Следствием этого является снижение способности оказывать необходимую помощь пациентам с инсультом. Обсерваторическое исследование с участием 280 центров в Китае показывает, что количество госпитализаций по поводу инсульта снизилось на 40%, а количество случаев тромболизиса и тромбэктомии снизилось на 25% в феврале 2020 года по сравнению с февралем 2019 года [39].Такое сокращение случаев госпитализации после инсульта может быть связано с тем, что пациенты предпочитают оставаться дома из-за страха заразиться вирусом в больнице. Общий эффект от этого — отсроченное начало лечения, многие пациенты пропускают терапевтическое окно [3].
Кроме того, риск заражения COVID-19 увеличивается у медицинских работников, которые контактируют с инфицированными пациентами. Во всем мире были сообщения о заражении COVID-19 и смерти среди медицинских работников [38]. Это требует использования средств индивидуальной защиты, которых в некоторых странах часто не хватает.Инфекция среди членов бригады по оказанию помощи при инсульте, которых также не хватает из-за перераспределения, может привести к карантину или даже госпитализации, что еще больше истощит человеческие ресурсы, доступные для оказания помощи при инсульте.
5. Ведение острого ишемического инсульта при COVID-19
До нынешней глобальной пандемии были разработаны и повсеместно приняты медицинскими работниками, занимающимися лечением острого инсульта, руководства по лечению инсульта [40]. Одним из таких рекомендаций является руководство по ведению острого ишемического инсульта, разработанное Американской кардиологической ассоциацией / Американской ассоциацией инсульта (AHA / ASA) [40].В этом документе представлены рекомендации по догоспитальному ведению инсульта на основе надежных систем инсульта, экстренной оценки и лечения, а также по общей поддерживающей терапии (для получения дополнительной информации читатели отсылаются к руководству). Из-за того, что острый ишемический инсульт зависит от времени, в текущих рекомендациях по инсульту рекомендуется быстро оказывать неотложную помощь, избегая при этом ненужных затрат времени на лечение [41]. Во всех случаях с подозрением на инсульт следует незамедлительно сделать снимки головного мозга по прибытии в больницу, предпочтительно в течение 20 минут после прибытия в больницу [40].Пациенты с инсультом, которые соответствуют критериям, должны подвергаться быстрому вмешательству с тромболизисом с использованием рекомбинантного тканевого активатора плазминогена (альтеплаза) и / или механической тромбэктомии у пациентов с окклюзией крупных сосудов. Вмешательства следует проводить в кратчайшие сроки, чтобы ограничить повреждение головного мозга [41]. Этот процесс лечения острого инсульта осложнился с момента появления COVID-19. В ответ на проблемы, связанные с лечением острого инсульта, вызванные пандемией, различные согласованные исследования дали рекомендации по ведению инсульта при COVID-19 [3, 42, 43].Американская кардиологическая ассоциация / Американская ассоциация инсульта также выпустила временное руководство по ведению пациентов с инсультом у пациентов с COVID-19 [44]. Общая тема этих руководящих принципов кратко изложена ниже.
5.1. Первоначальная сортировка и оценка
Независимо от того, поступает ли новый пациент в отделение неотложной помощи (ED) или уже поступил в больницу, все пациенты с инсультом проходят первоначальную быструю оценку. В настоящее время этот рутинный процесс осложняется COVID-19, что требует учета инфекционного статуса пациента.Описаны три категории пациентов с инсультом, инфицированных COVID-19, которые следует быстро определить во время первоначальной оценки: (1) пациенты с известной инфекцией, которые обычно находятся на поздней стадии заболевания, (2) пациенты с подозрением на COVID-19. инфекция, основанная на симптомах заболевания в анамнезе, контактах с инфицированными людьми, проживании или поездках в районы высокого риска, и (3) тех, у кого нет симптомов, без контактов с инфицированными людьми или проживания в зонах высокого риска [42] .Пациентов, у которых есть подозрение или подтвержденная инфекция, следует немедленно отделить. По возможности, эта категоризация должна быть проведена службами неотложной медицинской помощи до прибытия в отделение неотложной помощи [41]. Однако многие пациенты с инсультом могут находиться в замешательстве, афазии или без сознания, что затрудняет попытки определить риск инфекции. Кроме того, бессимптомные люди могут быть распространителями болезней. Таким образом, безопасно поддерживать высокий индекс подозрительности у всех пациентов. Это обеспечит принятие необходимых защитных мер медицинским персоналом.Принимая во внимание неотложный характер оказания помощи при остром инсульте и временные рамки, необходимые для получения подтверждающего результата теста для пациентов с COVID-19, следует применять меры профилактики передачи заболевания, такие как использование средств индивидуальной защиты (СИЗ), мытье рук и меры социального дистанцирования. использовались во время этой первоначальной оценки [42]. Если возможно, следует рассмотреть возможность дистанционной оценки с использованием телемедицины (телестройка) [40, 45]. Это позволяет дистанционно оценивать радиологические изображения, а также проводить неврологическое обследование с помощью видео, тем самым ограничивая воздействие как на медицинских работников, так и на пациентов [41].По сравнению с обследованием у постели больного, телеструкция показала свою эффективность при оценке баллов по шкале NIHSS, а также при оценке соответствия критериям тромболизиса и тромбэктомии [45].
5.2. Учитывать дисфункцию органов
Результат лечения инсульта при COVID-19 может отражать тяжесть основного заболевания. Показано, что уровень смертности у пациентов с инсультом и COVID-19 выше, чем у пациентов без COVID-19 [29, 36]. Поэтому важно оценить предикторы повышенной внутрибольничной смертности.Эти факторы включают пожилой возраст, сердечно-сосудистые заболевания, острое повреждение почек, высокий показатель оценки последовательной органной недостаточности (SOFA), гипоальбуминемию и повышенные уровни трансаминазы, лактатдегидрогеназы, ферритина, D-димера и С-реактивного белка [33]. Оценка SOFA использовалась в качестве индекса тяжести тяжелого состояния у тяжелобольных, а также для прогнозирования риска смерти. Эта оценка органной дисфункции важна для определения прогноза заболевания при рассмотрении соответствующего плана лечения острого инсульта [42].
5.3. Нейроваскулярная визуализация
Рекомендации AHA / ASA рекомендуют экстренную визуализацию мозга, желательно в течение 20 минут после прибытия в отделение неотложной помощи. Пациентам с окклюзией крупных сосудов, которые соответствуют критериям тромбэктомии, требуется компьютерная томографическая ангиография (КТА) или КТ-исследования перфузии в зависимости от времени от начала заболевания до проявления [40]. В данном руководстве рекомендуется продолжить исследование контрастного вещества до определения уровня креатинина в сыворотке крови у пациента без почечной недостаточности в анамнезе [40].У пациентов с COVID-19 и инсультом высок риск острого повреждения почек. Контрастная нефропатия может спровоцировать острое повреждение почек, тем самым увеличивая смертность. Следует соблюдать осторожность при использовании контрастных исследований у пациентов с COVID-19, перенесших инсульт, и следует учитывать соотношение общего риска и пользы [42]. Кроме того, необходимо рассмотреть возможность проведения компьютерной томографии грудной клетки вместе с нейроваскулярной визуализацией, так как это даст представление о степени поражения легких [41]. Кроме того, там, где это возможно, должен быть отдельный кабинет радиологии, предназначенный для пациентов с подтвержденным или высоким риском COVID-19, с введенной адекватной процедурой дезактивации [41].
5.4. Тромболизис и механическая тромбэктомия
Текущие рекомендации рекомендуют начинать внутривенный тромболизис с помощью rt-PA в течение 3 часов от начала инсульта и в течение 3–4,5 часов у отдельных пациентов [40]. Дисфункция печени, проявляющаяся повышенным уровнем трансаминаз, а также коагулопатия, документированы как аномалии при COVID-19 [33]. Существует более высокий риск отрицательного исхода у пациентов с инсультом с повышенным уровнем D-димера, которым проводят внутривенный тромболизис [46]. Нарушение функции печени при COVID-19 может происходить с коагулопатией или без нее [42].У таких пациентов следует рассмотреть возможность оценки гемостатических характеристик с помощью таких тестов, как тромбоэластография, и определения уровня D-димера в сыворотке [42]. Хотя влияние дисфункции печени на метаболизм rt-PA у пациентов с COVID-19 на данный момент неясно, существует потенциальный риск лекарственной токсичности при нарушении метаболизма в печени. Об этом следует помнить командам по лечению инсульта.
В текущих рекомендациях признается преимущество механической тромбэктомии, выполненной в течение 6 часов после начала инсульта, у пациентов с окклюзией крупных сосудов, баллов по шкале NIHSS ≥6 и у которых нет обширной ишемии на компьютерной томографии [40].Кроме того, отобранные пациенты с инсультом в пределах 6–16 часов после последнего известного нормального состояния и пациенты в течение 6–24 часов, которым проводились КТ-исследования перфузии или МРТ, также считаются разумным выбором для тромбэктомии [40]. Специализированная помощь, необходимая для тромбэктомии, может потребовать межбольничного перевода, что может быть осложнено дополнительными логистическими проблемами из-за COVID-19 [42]. Стандартные протоколы предосторожности, такие как использование СИЗ, должны соблюдаться в ангиографических наборах во время механической тромбэктомии, чтобы снизить риск заражения среди медицинского персонала [41].Кроме того, следует применять процедуры дезактивации поверхностей и оборудования [42]. Если возможно, процедуру следует проводить в ангиографической установке с отрицательным давлением, оснащенной высокоэффективным воздушным фильтром для твердых частиц (HEPA) [46].
5.5. Поддерживающая терапия
До 38% пациентов с острым ишемическим инсультом подвергаются интубации по таким причинам, как затрудненное дыхание, снижение уровня сознания, судороги и высокий балл по шкале NIHSS [47]. Это может быть выше в настройках COVID-19.Эта процедура может привести к образованию аэрозолей, и поэтому ее следует выполнять в оптимальных условиях с соответствующими мерами безопасности [42].
6. Заключение и рекомендации для будущих исследований
Острые ишемические инсульты представляют собой осложнения COVID-19 с коагулопатией, эндотелиальной дисфункцией, кардиоэмболией и прямым вирусным поражением нейронов в качестве возможных основных причин. Пожилые пациенты с тяжелым заболеванием подвержены более высокому риску этого осложнения, но окклюзия крупных сосудов обычно наблюдается у более молодых пациентов.Быстрая оценка и вмешательство, необходимые для получения оптимальных результатов при лечении острейшего инсульта, осложнились COVID-19. Необходимо принять меры инфекционного контроля, обеспечивая при этом адекватный уход за этими пациентами. Следовательно, существует необходимость в дополнительных исследованиях, чтобы лучше понять, как COVID-19 вызывает инсульт, и взаимосвязь между инсультом крупных сосудов и пациентами более молодого возраста. Кроме того, следует изучить преимущества использования антикоагулянтов для профилактики и лечения инсульта у пациентов с COVID-19.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ишемический инсульт у пожилых людей: обзор доказательств
Стронг, К., Мазерс, К. и Бонита, Р. Профилактика инсультов: спасение жизней во всем мире. Lancet Neurol. 6 , 182–187 (2007).
Артикул PubMed Google Scholar
Ди Карло А. Человеческое и экономическое бремя инсульта. Возраст Старение 38 , 4–5 (2009).
Артикул PubMed Google Scholar
Мюррей К. Дж. И Лопес А. Д. Глобальная смертность, инвалидность и влияние факторов риска: исследование глобального бремени болезни. Ланцет 349 , 1436–1442 (1997).
Артикул CAS PubMed Google Scholar
Штурм, Дж.W. и др. . Качество жизни после инсульта: исследование заболеваемости инсультом в Северо-Восточном Мельбурне (NEMESIS). Инсульт 35 , 2340–2345 (2004).
Артикул PubMed Google Scholar
Эверс, С. М. и др. . Международное сравнение исследований стоимости инсульта. Инсульт 35 , 1209–1215 (2004).
Артикул PubMed Google Scholar
Аллендер, С. и др. . Европейская статистика сердечно-сосудистых заболеваний, 2008 г. Веб-сайт статистики Британского фонда сердца [онлайн], (2009 г.).
Google Scholar
Голдштейн, Л. Б. и др. . Первичная профилактика ишемического инсульта: рекомендации Американской кардиологической ассоциации / Американской ассоциации инсультов Совет по инсульту: при поддержке Междисциплинарной рабочей группы по атеросклеротическим заболеваниям периферических сосудов; Совет медсестер по сердечно-сосудистой системе; Совет клинической кардиологии; Совет по питанию, физической активности и метаболизму; и Междисциплинарная рабочая группа по исследованию качества медицинской помощи и результатов: Американская академия неврологии подтверждает ценность этого руководства. Инсульт 37 , 1583–1633 (2006).
Артикул Google Scholar
Ротвелл, П. М. и др. . Популяционное исследование частоты событий, заболеваемости, летальности и смертности для всех острых сосудистых событий на всех артериальных территориях (Oxford Vascular Study). Ланцет 366 , 1773–1783 (2005).
Артикул CAS PubMed Google Scholar
Рохас, Дж.I., Zurrú, MC, Romano, M., Patrucco, L. и Cristiano, E. Острый ишемический инсульт и транзиторная ишемическая атака у очень старых — профиль факторов риска и подтип инсульта между пациентами старше 80 лет и пациентами в возрасте до 80 лет. Eur. J. Neurol. 14 , 895–899 (2007).
Артикул CAS PubMed Google Scholar
Фейгин В.Л., Лоуз К.М., Беннетт Д.А. и Андерсон К.S. Эпидемиология инсульта: обзор популяционных исследований заболеваемости, распространенности и летальности в конце 20 века. Lancet Neurol. 2 , 43–53 (2003).
Артикул PubMed Google Scholar
Розамонд, W. и др. . Статистика сердечных заболеваний и инсульта — обновление 2008 г .: отчет Статистического комитета Американской ассоциации кардиологов и Подкомитета по статистике инсульта. Тираж 117 , e25 – e146 (2008).
PubMed Google Scholar
Круг, Э. Г., Мерси, Дж. А., Дальберг, Л. Л. и Цви, А. Б. Всемирный доклад о насилии и здоровье. Ланцет 360 , 1083–1088 (2002).
Артикул Google Scholar
Пауэлл, Дж. Л. и Кук, И. Г. Глобальное старение в сравнительной перспективе: критическое обсуждение. Внутр. J. Sociol. Soc.Политика 29 , 388–400 (2009).
Артикул Google Scholar
Варлоу, К. П. и др. . Инсульт: практическое ведение 3-е издание (Wiley – Blackwell, Oxford, 2008).
Google Scholar
Менса, Г. А. Эпидемиология инсульта и высокого кровяного давления в Африке. Сердце 94 , 697–705 (2008).
Артикул CAS PubMed Google Scholar
Khaw, K.Т. Здоровое старение. BMJ 315 , 1090–1096 (1997).
Артикул CAS PubMed PubMed Central Google Scholar
Раз, Н. в Новые рубежи в когнитивном старении (ред. Диксон, Р. А., Бекман, Л. и Нильссон, Л.-Г.) 115–134 (Oxford University Press, Oxford, 2004).
Google Scholar
Есири, М. М. Старение и мозг. J. Pathol. 211 , 181–187 (2007).
Артикул CAS PubMed Google Scholar
Андерсон, Дж. М., Хаббард, Б. М., Когхилл, Г. Р. и Слиддерс, В. Влияние пожилого возраста на содержание нейронов коры головного мозга. Наблюдения с использованием метода подсчета точек автоматического анализатора изображений. J. Neurol. Sci. 58 , 235–246 (1983).
Артикул CAS PubMed Google Scholar
Пфеффербаум, А. и др. . Количественное магнитно-резонансное исследование изменений морфологии мозга от младенчества до позднего взросления. Arch. Neurol. 51 , 874–887 (1994).
Артикул CAS PubMed Google Scholar
Резник, С. М., Фам, Д. Л., Краут, М. А., Зондерман, А. Б. и Давацикос, К. Исследования пожилых людей с помощью продольной магнитно-резонансной томографии: сокращение мозга. J. Neurosci. 23 , 3295–3301 (2003).
Артикул CAS PubMed Google Scholar
Скахилл Р. И. и др. . Продольное исследование изменений объема мозга при нормальном старении с использованием серийной регистрируемой магнитно-резонансной томографии. Arch. Neurol. 60 , 989–994 (2003).
Артикул PubMed Google Scholar
Абэ, О. и др. . Старение в ЦНС: сравнение объема серого / белого вещества и данных тензора диффузии. Neurobiol. Старение 29 , 102–116 (2008).
Артикул PubMed Google Scholar
Аллен, Дж. С., Брусс, Дж., Браун, К. К. и Дамасио, Х. Нормальные нейроанатомические изменения, обусловленные возрастом: основные доли и разбивка височной области. Neurobiol. Старение 26 , 1245–1260 (2005).
Артикул PubMed Google Scholar
Чен, Р. Л. и Престон, Дж. Э. Изменения кинетики поглощения аминокислот на стареющем барьере овечья кровь – спинномозговая жидкость. Neurobiol. Старение doi: 10.1016 / j.neurobiolaging.2010.01.015.
Коулман, П. Д. и Флуд, Д. Г. Число нейронов и протяженность дендритов при нормальном старении и болезни Альцгеймера. Neurobiol. Старение 8 , 521–545 (1987).
Артикул CAS PubMed Google Scholar
Вест, М. Дж., Коулман, П. Д., Флад, Д. Г. и Тронкосо, Дж. С. Различия в характере потери нейронов гиппокампа при нормальном старении и болезни Альцгеймера. Ланцет 344 , 769–772 (1994).
Артикул CAS PubMed Google Scholar
Вест, М. Дж. Новые стереологические методы подсчета нейронов. Neurobiol. Старение 14 , 275–285 (1993).
Артикул CAS PubMed Google Scholar
Моррисон, Дж. Х. и Хоф, П. Р. Жизнь и смерть нейронов в стареющем мозге. Наука 278 , 412–419 (1997).
Артикул CAS Google Scholar
Розовский И., Вей М., Морган Т. Э. и Финч К.E. Обратимые возрастные нарушения роста нейритов за счет манипуляций с астроцитарным GFAP. Neurobiol. Старение 26 , 705–715 (2005).
Артикул CAS PubMed Google Scholar
Бретелер М. М. и др. . Поражения белого вещества головного мозга, сосудистые факторы риска и когнитивные функции в популяционном исследовании: Роттердамское исследование. Неврология 44 , 1246–1252 (1994).
Артикул CAS Google Scholar
Фернандо, М.С. и др. . Поражения белого вещества в неизбираемой когорте пожилых людей. Молекулярная патология предполагает возникновение в результате хронического повреждения гипоперфузией. Инсульт 37 , 1391–1398 (2006).
Артикул PubMed Google Scholar
Пантони, Л. и Гарсия, Дж. Х. Патогенез лейкоареоза. Инсульт 28 , 652–659 (1997).
Артикул CAS Google Scholar
Bartzokis, G. et al. . Структурная целостность белого вещества у здоровых стареющих взрослых и пациентов с болезнью Альцгеймера: исследование магнитно-резонансной томографии. Arch. Neurol. 60 , 393–398 (2003).
Артикул PubMed Google Scholar
Фаркас, Э. и др. . Возрастная микрососудистая дегенерация перивентрикулярного белого вещества головного мозга человека. Acta Neuropathol. 111 , 150–157 (2006).
Артикул PubMed Google Scholar
де Гроот, Дж. К. и др. . Поражения белого вещества головного мозга и когнитивные функции: исследование Rotterdam Scan. Ann. Neurol. 47 , 145–151 (2000).
Артикул CAS PubMed PubMed Central Google Scholar
Пью К.Г. и Липсиц, Л. А. Микрососудистый лобно-подкорковый синдром старения. Neurobiol. Старение 23 , 421–431 (2002).
Артикул PubMed Google Scholar
Чалла, В. Р., Тор, К. Р., Муди, Д. М., Анстром, Дж. А. и Браун, В. Р. Увеличение сосудов нити белого вещества при болезни Альцгеймера. J. Alzheimers Dis. 6 , 379–383 (2004).
Артикул PubMed Google Scholar
Принс, Н.Д. и др. . Поражения белого вещества головного мозга и риск развития деменции. Arch. Neurol. 61 , 1531–1534 (2004).
Артикул PubMed PubMed Central Google Scholar
Inzitari, D. et al. . Изменения белого вещества как детерминанта глобального функционального снижения у пожилых независимых амбулаторных пациентов: трехлетнее наблюдение когорты исследования LADIS (лейкоареоз и инвалидность). BMJ 339 , b2477 (2009 г.).
Артикул PubMed PubMed Central Google Scholar
Котон С. и др. . Церебральный лейкоареоз у пациентов с инсультом или ТИА: клинические корреляты и годичный исход. Eur. J. Neurol. 16 , 218–225 (2009).
Артикул CAS PubMed Google Scholar
Фу, Дж. Х. и др. . Степень поражения белого вещества связана с острыми подкорковыми инфарктами и позволяет прогнозировать дальнейший риск инсульта у пациентов с первым в истории ишемическим инсультом. J. Neurol. Нейрохирургия. Психиатрия 76 , 793–796 (2005).
Артикул CAS PubMed PubMed Central Google Scholar
Балтан С. Ишемическое повреждение белого вещества: возрастной процесс. Невролог 15 , 126–133 (2009).
Артикул CAS PubMed Google Scholar
Скавоне, К. и др. . Возрастные изменения циклической GMP и PKG-стимулированной активности Na, K-АТФазы мозжечка. Neurobiol. Старение 26 , 907–916 (2005).
Артикул CAS PubMed Google Scholar
Балтан, С. и др. . Уязвимость белого вещества к ишемическому повреждению увеличивается с возрастом из-за повышенной эксайтотоксичности. J. Neurosci. 28 , 1479–1489 (2008).
Артикул CAS PubMed Google Scholar
Stephens, M. L., Quintero, J. E., Pomerleau, F., Huettl, P. & Gerhardt, G. A. Возрастные изменения высвобождения глутамата в CA3 и зубчатой извилине гиппокампа крысы. Neurobiol. Старение doi: 10.1016 / j.neurobiolaging.2009.05.009.
Бустовецкий Т., Ли В. и Брустовецкий Н. Стимуляция рецепторов глутамата в культивируемых нейронах гиппокампа вызывает Ca 2+ -зависимое сокращение митохондрий. Cell Calcium 246 , 18–29 (2009).
Артикул CAS Google Scholar
Теккёк, С. Б., Йе, З. и Рэнсом, Б. Р. Эксайтотоксические механизмы ишемического повреждения в миелинизированном белом веществе. J. Cereb. Blood Flow Metab. 27 , 1540–1552 (2007).
Артикул CAS PubMed Google Scholar
Марстранд, Дж.Р. и др. . Церебральная перфузия и цереброваскулярная реактивность снижены при гиперинтенсивности белого вещества. Инсульт 33 , 972–976 (2002).
Артикул CAS PubMed Google Scholar
Bertsch, K. et al. . Церебральный кровоток в покое, внимание и старение. Brain Res. 1267 , 77–88 (2009).
Артикул CAS PubMed Google Scholar
Митчелл, Г.F. Влияние старения центральной артерии на структуру и функцию периферической сосудистой сети: последствия для повреждения органов-мишеней. J. Appl. Physiol. 105 , 1652–1660 (2008).
Артикул PubMed PubMed Central Google Scholar
Qin, C.C., Hui, R.T. & Liu, Z.H. Дегенерация микрососудов головного мозга, связанная со старением, является важной причиной эссенциальной гипертензии. Med. Гипотезы 70 , 643–645 (2008).
Артикул PubMed Google Scholar
Хоссманн, К. А. Пороги жизнеспособности и полутень фокальной ишемии. Ann. Neurol. 36 , 557–565 (1994).
Артикул CAS PubMed Google Scholar
Дрейк, С. Т. и Ядекола, С. Роль нейрональной передачи сигналов в контроле мозгового кровотока. Brain Lang. 102 , 141–152 (2007).
Артикул PubMed Google Scholar
Де Йонг, Г. И. и др. . Гипоперфузия головного мозга вызывает повреждение капилляров в области CA1 гиппокампа, что коррелирует с нарушением пространственной памяти. Neuroscience 91 , 203–210 (1999).
Артикул CAS PubMed Google Scholar
Stoquart-ElSankari, S. и др. . Влияние старения на церебральную кровь и спинномозговую жидкость. J. Cereb. Blood Flow Metab. 27 , 1563–1572 (2007).
Артикул PubMed Google Scholar
Уэно М., Томимото Х., Акигучи И., Вакита Х. и Сакамото Х. Нарушение гематоэнцефалического барьера при поражениях белого вещества на крысиной модели хронической гипоперфузии головного мозга. J. Cereb. Blood Flow Metab. 22 , 97–104 (2002).
Артикул PubMed Google Scholar
Шах, Г. Н., Мурадян, А. Д. Возрастные изменения гематоэнцефалического барьера. Опыт . Gerontol. 32 , 501–519 (1997).
CAS Google Scholar
Фарралл, А. Дж. И Вардлоу, Дж. М. Гематоэнцефалический барьер: старение и микрососудистые заболевания — систематический обзор и метаанализ. Neurobiol. Старение 30 , 337–352 (2009).
Артикул CAS PubMed Google Scholar
Chen, R.L. Уместно ли использовать соотношение альбумина CSF / плазма для оценки проницаемости гематоэнцефалического барьера? Neurobiol. Старение doi: 10.1016 / j.neurobiolaging.2008.08.024.
Роджерс, Х. и др. . Факторы риска первого инсульта у пожилых людей на северо-востоке Англии.Популяционное исследование. Инсульт 35 , 7–11 (2004).
Артикул PubMed Google Scholar
Каммерсгаард, Л. П. и др. . Краткосрочный и долгосрочный прогноз для очень старых пациентов с инсультом: Копенгагенское исследование инсульта. Возраст Старение 33 , 149–154 (2004).
Артикул PubMed Google Scholar
Кран, А.Д., Манфреда, Дж., Тейт, Р. Б., Мэтьюсон, Ф. А. и Кадди, Э. Т. Естественное течение фибрилляции предсердий: частота, факторы риска и прогноз в последующем исследовании Маннитобы. Am. J. Med. 98 , 466–484 (1995).
Артикул Google Scholar
Arboix, A. и др. . Факторы сердечно-сосудистого риска у пациентов в возрасте 85 лет и старше с ишемическим инсультом. Clin. Neurol. Нейрохирургия. 108 , 638–643 (2006).
Артикул PubMed Google Scholar
Вольф, П. А., Эбботт, Р. Д. и Каннел, В. Б. Фибрилляция предсердий как независимый фактор риска инсульта: Фрамингемское исследование. Инсульт 22 , 983–988 (1991).
Артикул CAS PubMed PubMed Central Google Scholar
Шуайб А. и Хачински В. С. Механизм и лечение инсульта у пожилых людей. CMAJ 145 , 433–443 (1991).
CAS PubMed PubMed Central Google Scholar
Чатурведи, С. и др. . Стентирование сонной артерии у восьмидесятилетних детей. Анализ предикторов риска перипроцедурного инсульта из многоцентрового клинического исследования Carotid ACCULINK / ACCUNET Post Approval Trial для выявления редких событий (CAPTURE 2). Инсульт DOI: 10.1161 / STROKEAHA.109.569426.
де Веерд, М., Гревинг, Дж. П., де Йонг, А. В., Бускенс, Э. и Ботс, М. Л. Распространенность бессимптомного стеноза сонной артерии в зависимости от возраста и пола. Систематический обзор и метарегрессионный анализ. Инсульт 40 , 1105–1113 (2009).
Артикул PubMed Google Scholar
Fairhead, J. F. & Rothwell, P. M. Недостаточное исследование и недостаточное лечение каротидной болезни у пожилых пациентов с транзиторной ишемической атакой и инсультом: сравнительное популяционное исследование. BMJ 333 , 525–527 (2006).
Артикул PubMed PubMed Central Google Scholar
Миллер, М. Т., Комерота, А. Дж., Циллинис, А., Дауд, Ю. и Хаммерлинг, Дж. Эндартерэктомия сонной артерии у восьмидесятилетних детей: указывает ли возраст на «высокий риск»? J. Vasc. Surg. 41 , 231–237 (2005).
Артикул PubMed Google Scholar
Тесо, Д., Эдвардс, Р. Э., Фраттини, Дж. К., Дудрик, С. Дж. И Дардик, А. Безопасность каротидной эндартерэктомии у 2443 пожилых пациентов: уроки нанодесятилетнего возраста — мы приближаемся к пределу. J. Am. Coll. Surg. 200 , 734–741 (2005).
Артикул PubMed Google Scholar
Велес, К. А. и др. . Установка стента сонной артерии безопасна для очень пожилых людей (≥80 лет). Катетер. Кардиоваск.Интерв. 72 , 303–308 (2008).
Артикул PubMed Google Scholar
Грант, А. и др. . Безопасность и эффективность стентирования сонных артерий у пожилых людей. Катетер. Кардиоваск. Интерв. DOI: 10.1002 / ccd.22345.
Зариньш, К. К., Уайт, Р. А., Дитрих, Э. Б., Шакелтон, Р. Дж. И Сиами, Ф. С. Реваскуляризация сонных артерий с использованием эндартерэктомии или систем стентирования (CaRESS): результаты за 4 года. J. Endovasc. Ther. 16 , 397–409 (2009).
Артикул PubMed PubMed Central Google Scholar
Марини, К. и др. . Бремя первого в истории ишемического инсульта у самых пожилых людей: данные популяционного исследования. Неврология 62 , 77–81 (2004).
Артикул CAS PubMed Google Scholar
Хэнки, Г.Дж., Джамрозик, К., Бродхерст, Р. Дж., Форбс, С. и Андерсон, К. С. Длительная нетрудоспособность после первого в истории инсульта и связанные с ними прогностические факторы в исследовании инсульта в Перте, 1989–1990 гг. Инсульт 33 , 1034–1040 (2002).
Артикул PubMed Google Scholar
Ди Карло А. и др. . Инсульт у пожилых людей: клинические проявления и факторы, определяющие трехмесячный функциональный результат: европейская перспектива.Европейское исследование BIOMED группы помощи при инсульте. Инсульт 30 , 2313–2319 (1999).
Артикул CAS PubMed Google Scholar
Sharma, J. C., Flecher, S. & Vassallo, M. Инсульты у пожилых людей — более высокая острая и трехмесячная смертность — объяснение. Cerebrovasc. Dis 9 , 2–9 (1999).
Артикул CAS PubMed Google Scholar
Асплунд, К., Карберг, Б. и Сандерстрём, Г. Инсульт у пожилых людей. Наблюдения на популяционной выборке госпитализированных пациентов. Cerebrovasc. Дис. 2 , 152–157 (1992).
Артикул Google Scholar
Джонстон С.С., Гресс Д. Р., Браунер В. С. и Сидни С. Краткосрочный прогноз после экстренной диагностики ТИА. JAMA 284 , 2901–2906 (2000).
Артикул CAS Google Scholar
Фонаров, Г.С. и др. . Возрастные различия в характеристиках, показателях эффективности, направлениях лечения и результатах у пациентов с ишемическим инсультом. Тираж 121 , 879–891 (2010).
Артикул PubMed Google Scholar
Сапосник Г. и др. . Переменные, связанные с 7-дневным, 30-дневным и 1-летним летальным исходом после ишемического инсульта. Инсульт 39 , 2318–2324 (2008).
Артикул PubMed Google Scholar
Palnum, K. D. et al. . Пожилые пациенты с острым инсультом в Дании: качество лечения и краткосрочная смертность. Общенациональное последующее исследование. Возраст Старение 37 , 90–95 (2008).
Артикул PubMed Google Scholar
Картер, А. М., Катто, А. Дж., Мэнсфилд, М. В., Бэмфорд, Дж.М. и Грант П. Дж. Прогностические переменные смертности после острого ишемического инсульта. Инсульт 38 , 1873–1880 (2007).
Артикул PubMed Google Scholar
Коллинз, Т. К. и др. . Краткосрочная, среднесрочная и долгосрочная смертность пациентов, госпитализированных по поводу инсульта. J. Clin. Эпидемиол. 56 , 81–87 (2003).
Артикул PubMed Google Scholar
Стегер, К. и др. . Пациенты с инсультом и фибрилляцией предсердий имеют худший прогноз, чем пациенты без него: данные Австралийского регистра инсультов. Eur. Heart J. 25 , 1734–1740 (2004).
Артикул PubMed Google Scholar
Петти, Г. В. и др. . Подтипы ишемического инсульта: популяционное исследование функциональных исходов, выживаемости и рецидивов. Инсульт 31 , 1062–1068 (2000).
Артикул CAS PubMed Google Scholar
Джин, К. и др. . Вызванный ишемией нейрогенез сохраняется, но снижается в мозге старых грызунов. Ячейка старения 3 , 373–377 (2004).
Артикул CAS PubMed Google Scholar
ДиНаполи, В. А., Хубер, Дж. Д., Хаузер, К., Ли, X. и Розен, С. Л. Ранние нарушения гематоэнцефалического барьера могут способствовать усилению нейронального повреждения и длительному функциональному восстановлению после инсульта у старых крыс. Neurobiol. Старение 29 , 753–764 (2008).
Артикул CAS PubMed Google Scholar
Шапира, С., Сапир, М., Венжер, А., Грауэр, Э. и Кадар, Т. Старение оказывает комплексное влияние на модель ишемического инсульта на крысах. Brain Res. 925 , 148–158 (2002).
Артикул CAS PubMed Google Scholar
Розен, К.Л., Динаполи В. А., Нагамин Т. и Крокко Т. Влияние возраста на исход инсульта после преходящей очаговой ишемии. J. Neurosurg. 103 , 687–694 (2005).
Артикул PubMed Google Scholar
Лю Ф., Юань Р., Бенашски С. Э. и Маккаллоу Л. Д. Изменения экспериментальных исходов инсульта на протяжении жизни. J. Cereb. Blood Flow Metab. 29 , 792–802 (2009).
Артикул CAS PubMed PubMed Central Google Scholar
Wagner, J. C. & Lutsep, H. L. Тромболизис у молодых людей. J. Thromb. Тромболизис 20 , 133–136 (2005).
Артикул PubMed Google Scholar
Андерсен, М. Б., Циммер, Дж. И Самс-Додд, Ф. Специфические поведенческие эффекты, связанные с возрастом и церебральной ишемией у крыс. Pharmacol. Biochem. Behav. 62 , 673–682 (1999).
Артикул CAS PubMed Google Scholar
Грин, А. Р. Фармакологические подходы к острому ишемическому инсульту: реперфузия, конечно, нейрозащита, возможно. Br. J. Pharmacol. 153 (Приложение 1), S325 – S338 (2008).
CAS PubMed Google Scholar
[Авторы не указаны] Тканевый активатор плазминогена при остром ишемическом инсульте.Национальный институт неврологических расстройств и инсульта Группа исследования инсульта rt-PA. N. Engl. J. Med. 333 , 1581–1587 (1995).
Квятковски Т.Г. и др. . Эффекты тканевого активатора плазминогена при остром ишемическом инсульте через год. Национальный институт неврологических заболеваний и инсульта Группа по изучению инсульта, рекомбинантного тканевого активатора плазминогена. N. Engl. J. Med. 340 , 1781–1787 (1999).
Артикул CAS PubMed Google Scholar
Grotta, J.И Марлер, Дж. Внутривенное введение RT-PA: размышления о десятой годовщине. Surg. Neurol. 68 (Приложение 1), S12 – S16 (2007).
Артикул PubMed PubMed Central Google Scholar
[Авторы не указаны] Общая эффективность t-PA при остром инсульте. Подгрупповой анализ исследования инсульта NINDS t-PA. Инсульт 28 , 2119–2125 (1997).
Hacke, W. et al. .Тромболизис альтеплазой через 3–4,5 часа после острого ишемического инсульта. N. Engl. J. Med. 359 , 1317–1329 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
Уолгрен, Н. и др. . Тромболизис с альтеплазой при остром ишемическом инсульте в исследовании «Безопасное внедрение тромболизиса при мониторинге инсульта» (SITS-MOST): обсервационное исследование. Ланцет 369 , 275–282 (2007).
Артикул CAS PubMed PubMed Central Google Scholar
Зееви, Н., Чабра, Дж., Сильверман, И. Э., Ли, Н. С. и Маккалоу, Л. Д. Ведение острого инсульта у пожилых людей. Cerebrovasc. Дис. 23 , 304–308 (2007).
Артикул PubMed Google Scholar
Танне, Д. и др. . Внутривенный тканевый активатор плазминогена при остром ишемическом инсульте у пациентов в возрасте 80 лет и старше: опыт исследования инсульта tPA. Инсульт 31 , 370–375 (2000).
Артикул CAS PubMed Google Scholar
Simon, JE, Sandler, DL, Pexman, JH, Hill, MD и Buchan, AM Безопасен ли внутривенный рекомбинантный тканевый активатор плазминогена (rt-PA) для пациентов старше 80 лет с острым ишемическим инсультом? — опыт Калгари. Возраст Старение 33 , 143–149 (2004).
Артикул PubMed Google Scholar
Дерекс, Л.И Нигхоссян Н. Тромболизис, госпитализация в инсультное отделение и ранняя реабилитация пожилых пациентов. Нат. Rev. Neurol. 5 , 506–511 (2009).
Артикул PubMed Google Scholar
Энгельтер, С. Т., Бонати, Л. Х. и Лайрер, П. А. Внутривенный тромболизис у пациентов с инсультом в возрасте ≥80 лет по сравнению с возрастом <80 лет - систематический обзор когортных исследований. Возраст Старение 35 , 572–580 (2006).
Артикул PubMed Google Scholar
Сапосник, Г. и др. . Исход инсульта у лиц старше 80 лет: многоцентровое когортное исследование по всей Канаде. Инсульт 39 , 2310–2317 (2008).
Артикул PubMed Google Scholar
Pundik, S. et al. . Пожилой возраст не увеличивает риск геморрагических осложнений после внутривенного и / или внутриартериального тромболизиса при остром инсульте. J. Stroke Cerebrovasc. Дис. 17 , 266–272 (2008).
Артикул PubMed Google Scholar
Meseguer, E. et al. . Детерминанты исхода и безопасности внутривенной терапии rt-PA в очень старом возрасте: исследование из клинического реестра и систематический обзор. Возраст Старение 37 , 107–111 (2008).
Артикул PubMed Google Scholar
[Авторы не указаны] Большое рандомизированное контролируемое исследование тромболизиса с внутривенным введением рекомбинантного тканевого активатора плазминогена (rt-PA) при остром ишемическом инсульте в течение 6 часов. Третье международное исследование инсульта (тромболизис) [онлайн], (2009).
дель Зоппо, Дж. Дж. и др. . PROACT: рандомизированное исследование проурокиназы II фазы путем прямой артериальной доставки при остром инсульте средней мозговой артерии. PROACT следователи. Пролиз при острой церебральной тромбоэмболии. Инсульт 29 , 4–11 (1998).
Артикул CAS PubMed PubMed Central Google Scholar
Фурлан, А. и др. . Внутриартериальная проурокиназа при остром ишемическом инсульте. Исследование PROACT II: рандомизированное контролируемое исследование. Пролиз при острой церебральной тромбоэмболии. JAMA 282 , 2003–2011 (1999).
Артикул CAS PubMed PubMed Central Google Scholar
Kase, C. и др. . Кровоизлияние в мозг после внутриартериального тромболизиса при ишемическом инсульте: исследование PROACT II. Неврология 57 , 1603–1610 (2001).
Артикул CAS PubMed Google Scholar
Кидвелл, С. и др. . Предикторы геморрагической трансформации у пациентов, получавших внутриартериальный тромболизис. Инсульт 33 , 717–724 (2002).
Артикул PubMed Google Scholar
Ким, Д. и др. . Внутриартериальный тромболизис при остром инсульте у пациентов 80 лет и старше: сравнение результатов у пациентов моложе 80 лет. AJNR Am. J. Neuroradiol. 28 , 159–163 (2007).
CAS PubMed Google Scholar
Вулф Т. и др. . Сравнение комбинированного венозного и артериального тромболизиса с первичной артериальной терапией с использованием рекомбинантного тканевого активатора плазминогена при остром ишемическом инсульте. J. Stroke Cerebrovasc. Дис. 17 , 121–128 (2008).
Артикул PubMed Google Scholar
Smith, W. S. et al. . Механическая тромбэктомия при остром ишемическом инсульте: окончательные результаты исследования Multi MERCI. Инсульт 39 , 1205–1212 (2008).
Артикул PubMed PubMed Central Google Scholar
Bose, A. и др. . Исследователи по исследованию инсульта фазы I Penumbra. Система Penumbra: механическое устройство для лечения острого инсульта из-за тромбоэмболии. AJNR Am. J. Neuroradiol. 29 , 1409–1413 (2008).
Артикул CAS PubMed Google Scholar
Брекенфельд, К. и др. . Установка стента при острой окклюзии мозговой артерии: использование саморасширяющегося внутричерепного стента для лечения острого инсульта. Инсульт 40 , 847–852 (2009).
Артикул PubMed Google Scholar
Бродерик, Дж. П. Эндоваскулярная терапия острого ишемического инсульта. Ход 40 , S103 – S106 (2009).
Артикул PubMed Google Scholar
Натараджан С. К. и др. . Безопасность и эффективность эндоваскулярной терапии через 8 часов после начала острого ишемического инсульта и пробуждения. Инсульт 40 , 3269–3274 (2009).
Артикул CAS PubMed Google Scholar
Исследователи IMS II. Исследование интервенционного ведения инсульта (IMS) II. Инсульт 38 , 2127–2135 (2007).
Перес де ла Осса, Н. и Давалос, А. Нейропротекция при инфаркте головного мозга: возможность новых исследований. Cerebrovasc. Дис. 24 (Доп.1. С. 153–156 (2007).
Артикул PubMed Google Scholar
О’Коллинз, В. Э. и др. . 1026 экспериментальных методов лечения острого инсульта. Ann. Neurol. 59 , 467–477 (2006).
Артикул CAS Google Scholar
Фишер М. и др. . Содействие развитию и утверждению методов лечения острого инсульта: круглый стол в академической индустрии по терапии инсульта. Инсульт 36 , 1808–1813 (2005).
Артикул PubMed Google Scholar
Адамс, Х. П. младший и др. . Рекомендации по раннему ведению взрослых с ишемическим инсультом: рекомендации Американской кардиологической ассоциации / Американского совета по инсульту, Совета по клинической кардиологии, Совета по сердечно-сосудистой радиологии и вмешательствам, а также Совета по атеросклеротическим заболеваниям периферических сосудов и качеству лечения в междисциплинарных исследованиях Группы: Американская академия неврологии подтверждает ценность этого руководства как учебного пособия для неврологов. Инсульт 38 , 1655–1711 (2007).
Артикул PubMed PubMed Central Google Scholar
Калифорнийские исследователи из экспериментального реестра острого инсульта. Влияние стандартизированных порядков инсульта на соблюдение передовых практик. Неврология 65 , 360–365 (2005).
Форстер А. и др. . Реабилитация пожилых людей в условиях длительного ухода. Кокрановская база данных систематических обзоров , выпуск 1.Изобразительное искусство. №: CD004294. DOI: 10.1002 / 14651858.CD004294.pub2 (2009).
Google Scholar
Candelise, L. et al. . Уход за пациентами с острым инсультом в инсультном отделении: последующее наблюдательное исследование. Ланцет 369 , 299–305 (2007).
Артикул PubMed Google Scholar
Сапосник, Г. и др. . Все ли возрастные группы получают пользу от организованной стационарной помощи при инсульте? Инсульт 40 , 3321–3327 (2009).
Артикул PubMed Google Scholar
Лоз, К. М., Беннет, Д. А., Фейгин, В. Л. и Роджерс, А. Артериальное давление и инсульт: обзор опубликованных обзоров. Инсульт 35 , 776–785 (2004).
Артикул PubMed Google Scholar
Тернбулл, Ф. и др. . Влияние различных схем снижения артериального давления на основные сердечно-сосудистые события у пожилых и молодых людей: метаанализ рандомизированных исследований. BMJ 336 , 1121–1123 (2008).
CAS PubMed Google Scholar
Беккет, Н. С. и др. . Лечение артериальной гипертензии у пациентов в возрасте 80 лет и старше. N. Engl. J. Med. 358 , 1887–1898 (2008).
Артикул CAS PubMed Google Scholar
Чалмерс, Дж. и др. .Международное общество гипертонии (ISH): заявление о снижении артериального давления и профилактике инсульта. J. Hypertens. 21 , 651–663 (2003).
Артикул PubMed Google Scholar
[Авторы не указаны] Профилактика инсульта с помощью антигипертензивной терапии у пожилых людей с изолированной систолической гипертензией. Окончательные результаты программы «Систолическая гипертензия у пожилых людей» (SHEP). Группа совместных исследований SHEP. JAMA 265 , 3255–3264 (1991).
Совместная группа «ПРОГРЕСС». Рандомизированное исследование схемы снижения артериального давления на основе периндоприла среди 6105 человек, перенесших инсульт или транзиторную ишемическую атаку. Ланцет 358 , 1033–1041 (2001).
Шредер, Дж. и др. . Заболеваемость и смертность после инсульта, эпросартан в сравнении с нитрендипином для вторичной профилактики: основные результаты проспективного рандомизированного контролируемого исследования (MOSES). Инсульт 36 , 1218–1226 (2005).
Артикул CAS PubMed Google Scholar
Огихара Т. и др. . Оптимальное целевое артериальное давление для антигипертензивной терапии у пожилых японских пациентов с гипертонией высокого риска: субанализ исследования выживания кандесартана при антигипертензивной выживаемости в Японии (CASE-J). Hypertension Res. 31 , 1595–1601 (2008).
Артикул Google Scholar
Объединенный национальный комитет по профилактике, выявлению, оценке и лечению высокого кровяного давления. Национальный институт сердца, легких и крови [онлайн], (2004).
Оутс, Д. Дж., Берловиц, Д. Р., Гликман, М. Э., Силлиман, Р. А. и Борзецки, А. М. Артериальное давление и выживаемость в пожилом возрасте. J. Am. Гериатр. Soc. 55 , 383–388 (2007).
Артикул PubMed Google Scholar
[Авторы не указаны] Совместный обзор рандомизированных исследований антитромбоцитарной терапии — I: предотвращение смерти, инфаркта миокарда и инсульта путем длительной антиагрегантной терапии у различных категорий пациентов. Сотрудничество исследователей антитромбоцитов. BMJ 308 , 81–106 (1994).
[Авторы не указаны] Международное исследование инсульта (IST): рандомизированное исследование аспирина, подкожного гепарина, обоих или ни одного, среди 19 435 пациентов с острым ишемическим инсультом.Международная группа по исследованию инсульта. Ланцет 349 , 1569–1581 (1997).
[Авторы не указаны] CAST: рандомизированное плацебо-контролируемое исследование раннего применения аспирина у 20 000 пациентов с острым ишемическим инсультом. CAST (Китайское исследование острого инсульта), совместная группа. Ланцет 349 , 1641–1649 (1997).
Ридкер П. М. и др. . Рандомизированное исследование низких доз аспирина в первичной профилактике сердечно-сосудистых заболеваний у женщин. N. Engl. J. Med. 352 , 1293–1304 (2005).
Артикул CAS PubMed Google Scholar
Сакко Р. Л. и др. . Рекомендации по профилактике инсульта у пациентов с ишемическим инсультом или транзиторной ишемической атакой: заявление для медицинских работников от Американской кардиологической ассоциации / Совета Американской ассоциации инсульта по инсульту: при совместном спонсировании Совета по сердечно-сосудистой радиологии и вмешательству: Американской академии неврологии подтверждает ценность этого руководства. Инсульт 37 , 577–617 (2006).
Артикул Google Scholar
[Авторы не указаны] Факторы риска инсульта и эффективность антитромботической терапии при фибрилляции предсердий. Анализ объединенных данных пяти рандомизированных контролируемых исследований. Arch. Междунар. Med. 154 , 1449–1457 (1994).
Мант, Дж. и др. . Варфарин по сравнению с аспирином для профилактики инсульта у пожилых людей с фибрилляцией предсердий (Бирмингемское исследование мерцательной аритмии в пожилом исследовании, BAFTA): рандомизированное контролируемое исследование. Ланцет 370 , 493–503 (2007).
Артикул CAS PubMed Google Scholar
Цивгулис, Г. и др. . Эффективность антикоагуляции для вторичной профилактики инсульта у пожилых людей с неклапанной фибрилляцией предсердий: проспективное исследование серии клинических случаев. Возраст Старение 34 , 35–40 (2005).
Артикул PubMed Google Scholar
Анселл, Дж. и др. . Фармакология и лечение антагонистов витамина К: Руководства по клинической практике, основанные на фактических данных Американского колледжа врачей-терапевтов (8 -е издание ). Сундук 133 , (Дополнение 6), S160 – S198 (2008).
Артикул Google Scholar
[Авторы не указаны] MRC / BHF Heart Protection Study по снижению холестерина с помощью симвастатина у 20 536 человек из группы высокого риска: рандомизированное плацебо-контролируемое исследование. Ланцет 360 , 7–22 (2002).
Baigent, C. et al. . Эффективность и безопасность лечения, снижающего уровень холестерина: проспективный метаанализ данных 90 056 участников 14 рандомизированных исследований статинов. Ланцет 366 , 1267–1278 (2005).
Артикул CAS PubMed Google Scholar
Ридкер П. М. и др. . Розувастатин для профилактики сосудистых событий у мужчин и женщин с повышенным уровнем С-реактивного белка. N. Engl. J. Med. 359 , 2195–2207 (2008).
Артикул CAS PubMed Google Scholar
Чатурведи, С. и др. . Эффект аторвастатина у пожилых пациентов с недавно перенесенным инсультом или транзиторной ишемической атакой. Неврология 72 , 688–694 (2009).
Артикул CAS PubMed Google Scholar
Афилало, Дж. и др. . Статины для вторичной профилактики у пожилых пациентов: иерархический байесовский метаанализ. J. Am. Coll. Кардиол. 51 , 37–45 (2008).
Артикул CAS PubMed Google Scholar
Zhang, L. et al. . Многоцелевые эффекты статин-усиленной тромболитической терапии инсульта с рекомбинантным человеческим активатором плазминогена тканевого типа у крыс. Тираж 112 , 3486–3494 (2005).
Артикул CAS PubMed Google Scholar
Бушнелл, К. Д. и др. . Использование статинов и исходы инсульта в зависимости от пола у пациентов с сосудистыми заболеваниями. Инсульт 37 , 1427–1431 (2006).
Артикул CAS PubMed Google Scholar
Аппельрос П., Стегмайр Б. и Терент А. Половые различия в эпидемиологии инсульта: систематический обзор. Инсульт 40 , 1082–1090 (2009).
Артикул PubMed Google Scholar
Arboix, A. и др. . Острое цереброваскулярное заболевание у женщин. Eur. Neurol. 45 , 199–205 (2001).
Артикул CAS PubMed Google Scholar
Бежо, Ю. и др. . Инсульт у пожилых людей: заболеваемость, факторы риска, клинические особенности, исходы и доступ к ресурсам — 22-летнее популяционное исследование. Cerebrovasc. Дис. 29 , 111–121 (2010).
Артикул PubMed Google Scholar
Усман А.А., Танг Г.Л. и Эскандари М.К. Метаанализ процедурного инсульта и смерти среди восьмидесятилетних детей: стентирование сонной артерии в сравнении с каротидной эндартерэктомией. J. Am. Coll. Surg. 208 , 1124–1131 (2009).
Артикул PubMed Google Scholar
Сешадри, С. и др. . Повышенное артериальное давление в среднем возрасте увеличивает риск инсульта у пожилых людей: исследование Framingham. Arch. Междунар. Med. 161 , 2343–2350 (2001).
Артикул CAS PubMed Google Scholar
Weverling-Rijnsburger, AW, Jonkers, IJ, van Exel, E., Gussekloo, J. & Westendorp, RG Холестерин липопротеидов высокой плотности по сравнению с холестерином низкой плотности как фактор риска развития ишемической болезни сердца и инсульта в пожилом возрасте возраст. Arch. Междунар. Med. 163 , 1549–1554 (2003).
Артикул CAS PubMed Google Scholar
Милионис, Х. Дж. и др. . Компоненты метаболического синдрома и риск первого в истории острого ишемического неэмболического инсульта у пожилых людей. Инсульт 36 , 1372–1376 (2005).
Артикул PubMed Google Scholar
Скотт Д.J. и др. . Адипоцитокины и риск инсульта у пожилых людей: вложенное исследование случай – контроль. Внутр. J. Epidemiol. 38 , 253–261 (2009).
Артикул Google Scholar
Савва, Г. М. и др. . Возраст, невропатология и деменция. N. Engl. J. Med. 360 , 2302–2309 (2009).
Артикул CAS PubMed Google Scholar
Джеллингер, К.A. Морфологический диагноз «сосудистой деменции» — критическое обновление. J. Neurol. Sci. 270 , 1–12 (2008).
Артикул Google Scholar
Петрович, Х. и др. . Поражения и инфаркты AD у слабоумных и недемольных японско-американских мужчин. Ann. Neurol. 57 , 98–103 (2005).
Артикул PubMed Google Scholar
Любовь, С., Майнерс, С., Палмер, Дж., Чалмерс, К. и Кехо, П. Понимание патогенеза и патогенности церебральной амилоидной ангиопатии. Перед. Biosci. 14 , 4778–4792 (2009).
Артикул CAS Google Scholar
Тал, Д. Р., Гриффин, В. С., де Вос, Р. А. и Гребремедин, Э. Церебральная амилоидная ангиопатия и ее связь с болезнью Альцгеймера. Acta Neuropathol. 115 , 599–609 (2008).
Артикул CAS PubMed Google Scholar
Тор, К. Р. и др. . Морфометрический анализ извилистости артериол в белом веществе головного мозга человека недоношенных, молодых и пожилых людей. J. Neuropathol. Exp. Neurol. 66 , 337–345 (2007).
Артикул PubMed Google Scholar
Шнайдер Дж. А., Арванитакис З., Bang, W. & Bennett, D. A. Смешанные патологии головного мозга составляют большую часть деменции у пожилых людей, проживающих в сообществах. Неврология 69 , 2197–2204 (2007).
Артикул PubMed PubMed Central Google Scholar
Саузерн, Л., Уильямс, Дж. И Эсири, М. М. Иммуногистохимическое исследование N -эпсилон-карбоксиметиллизина (ХМЛ) в мозге человека: связь с сосудистой деменцией. BMC Neurol. 7 , 35 (2007).
Артикул CAS PubMed PubMed Central Google Scholar
Сато Т. и др. . Теория токсичных конечных продуктов гликирования (TAGE) при болезни Альцгеймера. Am. J. Alzheimers Dis. Другой Демен. 21 , 197–208 (2006).
Артикул PubMed Google Scholar
Лоу, Дж., Мирра, С. С., Хайман, Б. Т. и Диксон, Д. У. в Greenfield’s Neuropathology 8-е изд. Vol. 1 (ред. Лав С., Луис, Д. Н. и Эллисон, Д. У.) 1031–1152 (Ходдер Арнольд, Лондон, 2008).
Google Scholar
Инс, П. Г., Кларк, Б., Холтон, Дж., Ревес, Т. и Уортон, С. Б. в Greenfield’s Neuropathology 8-е изд. Vol. 1 (ред. Лав, С., Луи, Д. Н. и Эллисон, Д. У.) 889–1030 (Ходдер Арнольд, Лондон, 2008).
Google Scholar
Ишемический инсульт | Неврология | Mercy Health
Типы ишемических инсультов
Эмболические инсульты
Эмболический инсульт возникает, когда сгусток крови, образующийся в другой части тела, вырывается и попадает в мозг. Сгусток крови может блокировать кровоток в артерии, ведущей к мозгу, и вызывать инсульт. Это обычное явление у пациентов с фибрилляцией предсердий.
Тромботические инсульты
Тромботический инсульт возникает, когда сгусток крови формируется и блокирует артерию, снабжающую мозг.Пациенты с повышенным уровнем холестерина наиболее подвержены тромботическому инсульту. Тромботические инсульты далее классифицируются как тромбоз крупных сосудов или тромбоз мелких сосудов.
На ишемические инсульты приходится более 85 процентов всех случаев инсульта.
Причины ишемического инсульта
Причины ишемического инсульта включают:
Атеросклероз
Атеросклероз, когда бляшки накапливаются в артериях, является наиболее частой причиной ишемического инсульта. По мере того, как бляшки накапливаются в артериях, они могут блокировать всю артерию, ведущую к головному мозгу, и останавливать приток крови к мозгу.
Сгусток крови
Сгусток крови, который застревает в сонной артерии и блокирует поток богатой кислородом крови в мозг, может привести к ишемическому инсульту.
Факторы риска ишемического инсульта
Существует множество изменяемых и немодифицируемых факторов риска, которые увеличивают вероятность ишемического инсульта.
Факторы риска ишемического инсульта, которые можно изменить, включают:
- Высокое кровяное давление (гипертония) — основной фактор риска инсульта
- Диабет — люди с диабетом в четыре раза чаще страдают заболеванием сонной артерии
- Ишемическая болезнь сердца
- Курение — может увеличить образование бляшек в артериях, что может привести к инсульту
Большинство случаев ишемического инсульта можно предотвратить, изменив образ жизни (физические упражнения, бросьте курить, сбросьте вес и правильно питайтесь), чтобы вести более здоровый образ жизни.
Факторы риска, которые нельзя изменить, включают:
- Возраст — риск инсульта выше, если вы старше 55 лет
- Пол — мужчины чаще страдают инсультом, чем женщины
- Раса — афроамериканцы, американцы с Аляски и американские индейцы чаще страдают от инсульта
Симптомы ишемического инсульта
Симптомы ишемического инсульта включают:
- Падение или онемение одной стороны лица
- Слабость в руках — невозможность поднять руку
- Проблемы с речью
- Путаница
- Проблемы при ходьбе
- Проблемы со зрением
Диагностика ишемического инсульта
Если вы или член вашей семьи испытываете признаки инсульта, немедленно позвоните в службу 911.По мере того как проходит каждая минута до начала лечения, умирает все больше клеток мозга.
Когда вы окажетесь под наблюдением медицинского работника, он или она быстро осмотрит вас на предмет признаков инсульта. Профессионал проведет медицинский осмотр, чтобы измерить артериальное давление, послушать частоту сердечных сокращений и проверить ваши глаза на наличие признаков налета. Другие тесты, которые ваш врач может назначить для диагностики инсульта, включают:
- Анализы крови — анализы крови могут выявить другие потенциальные причины ваших симптомов, а также определить, насколько быстро ваша кровь сворачивается.

 — 8.2%
— 8.2%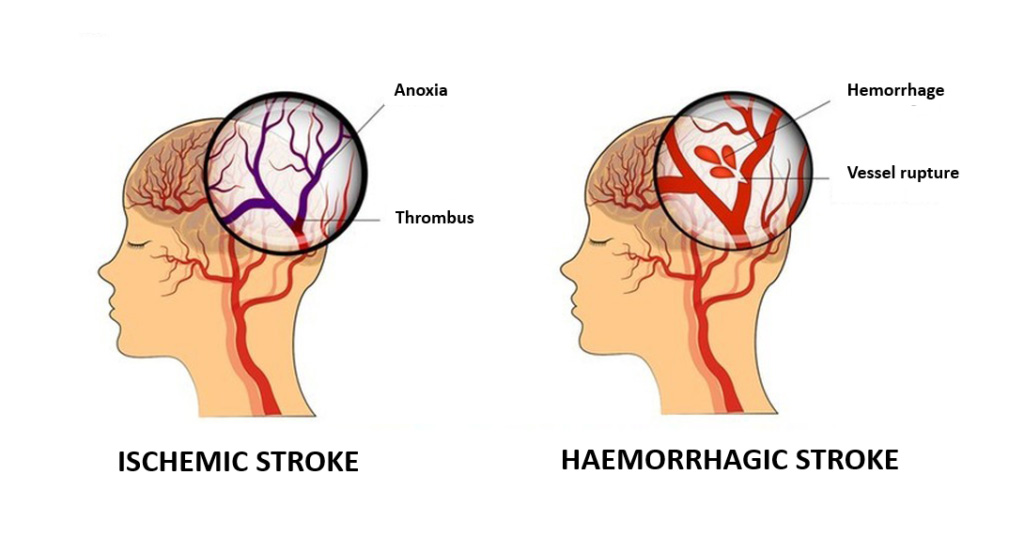 Он западет на одну сторону
Он западет на одну сторону
 2010; 11 (10): 27—34. doi:10.1093/ejechocard/jeq120
2010; 11 (10): 27—34. doi:10.1093/ejechocard/jeq120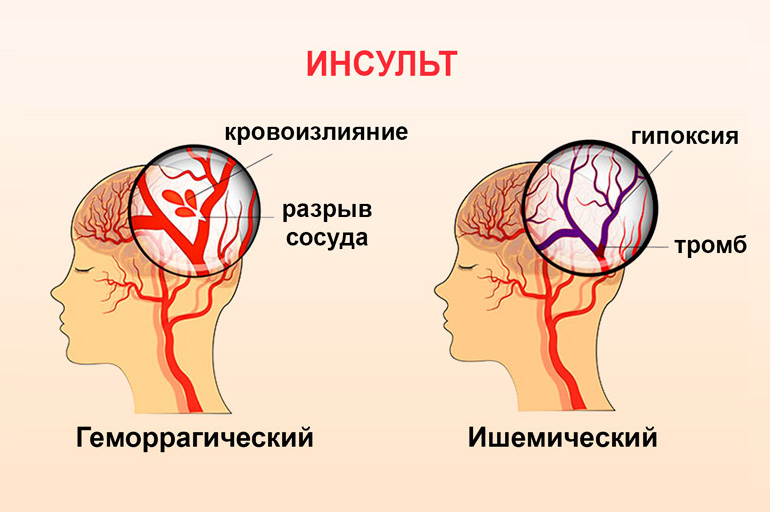 Команда специалистов по лечению острого инсульта работает с нашими пациентами, чтобы выявлять возможные осложнения, отслеживать изменения в работе сердца и мозга, а также оценивать и лечить причину инсульта. Если пациент находится в критическом состоянии, помощь оказывается в ультрасовременном отделении нейрореанимации Лойолы.
Команда специалистов по лечению острого инсульта работает с нашими пациентами, чтобы выявлять возможные осложнения, отслеживать изменения в работе сердца и мозга, а также оценивать и лечить причину инсульта. Если пациент находится в критическом состоянии, помощь оказывается в ультрасовременном отделении нейрореанимации Лойолы.