Инсульт легкий: Как распознать инсульт? Признаки и симптомы
Инсульт-реабилитация: врачи, клиники, цены | Russian Hospitals
Признаки инсульта и первая помощь
Симптомы примерно одинаковые и при ишемическом, и при геморрагическом инсульте:
- слабость и головокружение
- головная боль
- боязнь света или потеря зрения
- затруднения при глотании
- нарушения речи
- нарушения в координации движений
- судороги и онемение конечностей или лица
- потеря сознания
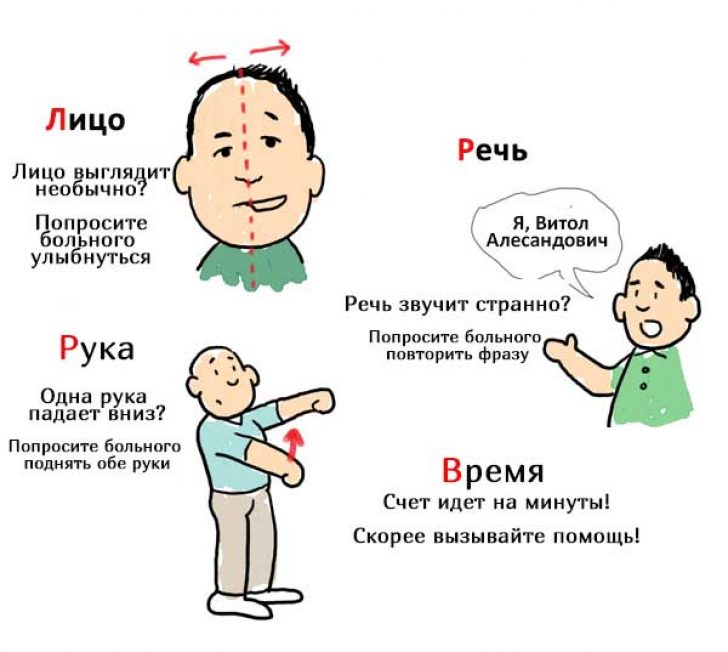
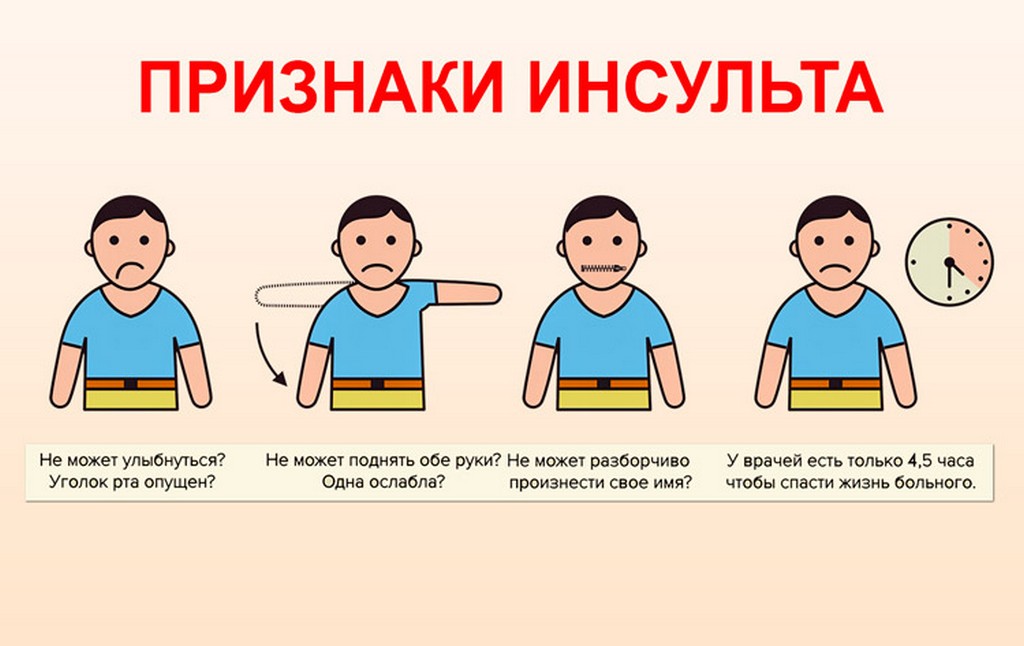
Запомните легкий тест FAST, который поможет выявить инсульт у вашего близкого человека:
- F («лицо» от англ. face) — при улыбке один уголок рта остается опущенным
- A («рука» от англ. arm) — при поднятии одновременно двух рук, одна рука самопроизвольно опускается либо человек не может ею управлять
- S («речь» от англ. speech) — при инсульте даже простая фраза звучит невнятно, неразборчиво
- T («время» от англ.

В стационаре состояние пациента стабилизируют и проведут тромболитическую терапию. Цели первой помощи:
- остановить закупорку артерий
- возобновить кровоток
- снять спазмов сосудов
- восстановить нейроны пораженного участка мозга
Этапы и сроки реабилитации
Чем раньше началась реабилитация, тем выше шанс предотвратить инвалидизацию и развитие сосудистой деменции (дисциркуляторной энцефалопатии). Лечение дает больший результат в период «реабилитационного окна» — одного года после инсульта.
Восстановление делится на 5 этапов:
- 1 этап. Острейший период. Длится первые 5 суток
- 2 этап. Острый период. Длится 3-4 недели
- 3 этап. Ранний восстановительный период. Длится до шести месяцев
- 4 этап. Поздний восстановительный период. От 6 до 12 месяцев
- 5 этап. Период остаточных явлений. После 1-го года
Восстановление речи, когнитивных и двигательных навыков
Речь, когнитивные и базовые двигательные функции начинают восстанавливать первыми.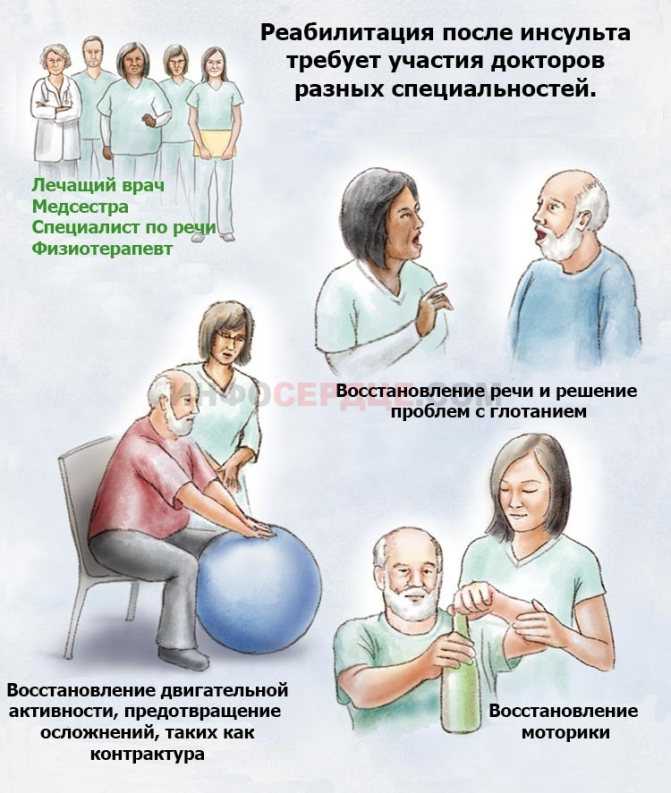 Максимально речь восстанавливается в первые 3–6 месяцев после инсульта. Основной принцип восстановления речи — постоянное общение с пациентом.
Максимально речь восстанавливается в первые 3–6 месяцев после инсульта. Основной принцип восстановления речи — постоянное общение с пациентом.
Часто у пациентов с инсультом развиваются парезы (частичный паралич). Помимо поражения головного мозга, возникают боли, препятствующие движениям, и нарушения иннервации, что может привести к патологии суставов. Последствия у пациентов после инсульта разные, поэтому общие рекомендации не так эффективны, как подобранное группой узких врачей индивидуальное лечение. Первые 3 месяца раннего восстановительного этапа лучше проводить в реабилитационном отделении больницы, чем на дому.
Восстановление бытовых навыков
Слабость в мышцах убирает регулярное выполнение назначенных врачом реабилитационных упражнений.
Если потерялись навыки самообслуживания, человек потихоньку учится им заново. Задача близких — следить за равновесием человека, направлять и поддерживать его, помогать независимым движениям пациента.
Методы постинсультной реабилитации
Медикаментозное лечение
Лекарственная терапия назначается лечащим врачом и поддерживает работоспособность организма, способствует защите нейронов, нормализации кровообращения. Назначаются препараты для:
Назначаются препараты для:- улучшения церебрального кровоснабжения и разжижения крови
- активизации мышления и памяти
- улучшения передачи нервных импульсов
- нормализации обменных процессов
- успокоительные
- противоспазматические и противоэпилептические средства
Реабилитация после инсульта на дому
Иногда реабилитацию сначала проходят на дому, с помощью сестринской службы, которая контролирует состояние пациента и обеспечивает нужный уход. После улучшения восстановление лучше продолжить в специализированном медицинском центре.
При реабилитации дома пациенту необходима помощь близких и амбулаторная терапия. Родственникам необходимо обучиться правилам ухода и техникам перемещения, чтобы не повредить больному и себе. Желательно купить пациенту функциональную кровать и оборудовать поручни в квартире.
Амбулаторная реабилитация включает:
- медикаментозную терапию
- физиотерапию
- кинезиотерапию
- трудотерапию
- психотерапию
Реабилитация в медицинском учреждении
В медицинском учреждении с пациентом работает не один врач, а группа разнопрофильных специалистов. Назначаются физиопроцедуры, лечебная гимнастика, массаж, занятия с логопедом, эрготерапевтом, психологом. Психолог также помогает устранить депрессию, когда человек при потере навыков сохраняет интеллект и тяжело переживает возникшие ограничения. Нейропсихолог помогает восстановлению памяти и мышления. Как правило, качественная реабилитация доступна в частных клиниках, и она же помогает снизить риск повторения инсульта.
Назначаются физиопроцедуры, лечебная гимнастика, массаж, занятия с логопедом, эрготерапевтом, психологом. Психолог также помогает устранить депрессию, когда человек при потере навыков сохраняет интеллект и тяжело переживает возникшие ограничения. Нейропсихолог помогает восстановлению памяти и мышления. Как правило, качественная реабилитация доступна в частных клиниках, и она же помогает снизить риск повторения инсульта.
Вероятность повторения: как снизить риск?
25-35% всех инсультов — повторные. С каждым повтором восстановить функции и вернуться к полноценной жизни сложнее. Главная причина инсультов — нарушения движения крови в сосудистом русле. Профилактика повторного инсульта направлена на коррекцию таких гемодинамических нарушений, как:
- снижение артериального давления до цифр менее 140/90
- показатели холестерина и липидного состава крови
- риск возникновения тромбов
Кроме лекарств, основной способ снижения АД и показателей крови — коррекция питания и двигательной активности.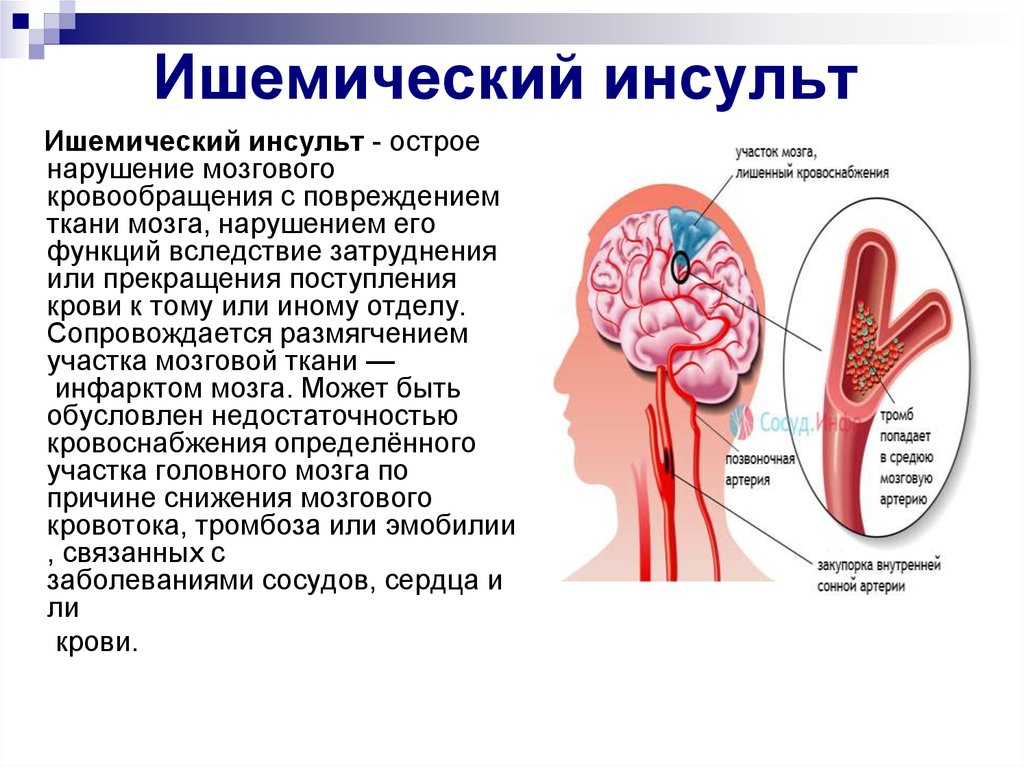
Подбор центра реабилитации
В частный реабилитационный центр попасть быстрее и проще, чем в государственный центр по ОМС. Скорость начала реабилитации напрямую влияет на то, насколько пациент сможет восстановиться и не станет обузой для себя и своих родственников.
Чтобы оперативно, в течение 48 часов, получить предложения о прохождении реабилитации от ведущих центров страны, заполните форму обращения, приложите медицинские документы. Специалисты RussianHospitals помогут вам выбрать наилучший вариант для прохождения реабилитации, услуга бесплатная.
Материалы по теме
- Научная статья по первичной и вторичной профилактике инсульта
Кардиогенный ишемический инсульт.
Ишемический инсульт (ИИ) — одна из наиболее острых проблем современной медицины. Число пострадавших от ИИ в мире неуклонно растет — более 16 млн новых случаев заболевания регистрируется каждый год. Увеличивается и нагрузка от инсульта, определяемая комплексом медицинских и социальных проблем, связанных с оказанием помощи пострадавшим и необходимостью ухода за больными, большинство из которых нуждаются в постоянной посторонней помощи.
 В ходе РКИ изучаются лекарственные средства, механизм действия которых направлен на ключевые звенья патогенеза заболевания (артериальная гипертония, аритмия, гиперкоагуляционный синдром). Относительно продолжительный период проведения РКИ (обычно 2-3 года) позволяет установить величину годового риска сосудистых событий в контрольной группе и в группе больных, получавших лечение. Эти данные являются более надёжным основанием для прогностических суждений, чем результаты популяционных исследований. Сравнительный анализ результатов РКИ показывает, что артериальная гипертония (АГ) увеличивает риск ИИ на 5 — 6% в год, грубый атеросклеротический стеноз артерий головного мозга на 4 — 12%, аритмия — на 5 — 7% [3]. Оценка индивидуального риска и возможность его снижения определяют суть современной стратегии высокого риска в профилактических программах. Новые тенденции в превентивной кардионеврологии характеризуются двумя важными признаками: 1) — возможностью
В ходе РКИ изучаются лекарственные средства, механизм действия которых направлен на ключевые звенья патогенеза заболевания (артериальная гипертония, аритмия, гиперкоагуляционный синдром). Относительно продолжительный период проведения РКИ (обычно 2-3 года) позволяет установить величину годового риска сосудистых событий в контрольной группе и в группе больных, получавших лечение. Эти данные являются более надёжным основанием для прогностических суждений, чем результаты популяционных исследований. Сравнительный анализ результатов РКИ показывает, что артериальная гипертония (АГ) увеличивает риск ИИ на 5 — 6% в год, грубый атеросклеротический стеноз артерий головного мозга на 4 — 12%, аритмия — на 5 — 7% [3]. Оценка индивидуального риска и возможность его снижения определяют суть современной стратегии высокого риска в профилактических программах. Новые тенденции в превентивной кардионеврологии характеризуются двумя важными признаками: 1) — возможностью  Эти условия в последние годы созданы благодаря внедрению в клиническую практику новейших методов функциональной диагностики и визуализации (КТ, МРТ, эхокардиография, дуплекснове сканирование сосудов и др.). Результаты РКИ последних десятилетий сделали концепцию гетерогенности ИИ продуктивной не только в научном, но и в практическом отношении [3]. Представления о патогенетических подтипах ИИ (атеротромботический, кардиоэмболический, лакунарный, микроциркуляторный, гемодинамический) оказались полезными не столько для уточнения характера уже свершившегося сосудистого события, сколько для разработки эффективных направлений превентивного лечения в рамках как первичной, так и вторичной профилактики. В современной системе предупреждения сосудистых катастроф лечение становится дифференцированным, патогенетически обоснованным и направленным на снижение индивидуального риска ИИ [4-7].
Эти условия в последние годы созданы благодаря внедрению в клиническую практику новейших методов функциональной диагностики и визуализации (КТ, МРТ, эхокардиография, дуплекснове сканирование сосудов и др.). Результаты РКИ последних десятилетий сделали концепцию гетерогенности ИИ продуктивной не только в научном, но и в практическом отношении [3]. Представления о патогенетических подтипах ИИ (атеротромботический, кардиоэмболический, лакунарный, микроциркуляторный, гемодинамический) оказались полезными не столько для уточнения характера уже свершившегося сосудистого события, сколько для разработки эффективных направлений превентивного лечения в рамках как первичной, так и вторичной профилактики. В современной системе предупреждения сосудистых катастроф лечение становится дифференцированным, патогенетически обоснованным и направленным на снижение индивидуального риска ИИ [4-7].Участие сердца в патогенезе сосудистых заболеваний головного мозга во многих клинических случаях представляется очевидным.
Интерес исследователей и практических врачей к проблеме КЭИ обусловлен важными обстоятельствами, некоторые из которых приобрели особое значение в последние годы:
- Увеличилась распространенность КЭИ в популяции и его доля в структуре ОНМК.
- КЭИ приводит к более тяжелым исходам в сравнении с другими ОНМК.

- Стали более доступными и надежными методы диагностики патологических процессов, приводящих к развитию КЭИ (ультразвуковые и функциональные исследования).
- Разработаны и внедрены в клиническую практику лекарственные средства, обладающие высоким превентивным потенциалом в отношении кардиогенных эмболий.
Эти факты позволяют предполагать, что за счет уменьшения доли КЭИ в структуре ОНМК в целом, можно получить, наконец, уменьшение заболеваемости ИИ.
По данным разных источников КЭИ составляют от 14 до 38% всех ИИ [1,4,7]. Фибрилляция предсердий (ФП) повышает риск КЭИ в 5 — 6 раз и является самой частой причиной кардиогенной церебральной эмболии [7]. Абсолютный индивидуальный риск ИИ у больных с ФП колеблется от 5 до 9% в год, но в старших возрастных группах может достигать 24% [8,9] Женщины старше 65 лет с ФП подвержены более высокому риску ИИ, чем мужчины (годовой риск 6,2% и 4,2% соответственно) [9]. Исследователи объясняют этот факт большей распространённостью АГ у женщин старших возрастных групп [10,11].

Для клинической картины КЭИ характерно острейшее начало с максимально выраженным неврологическим дефицитом в дебюте заболевания. Нарушения сознания и судорожный синдром, тошнота и рвота — типичные признаки кардиогенной церебральной эмболии [7,15]. В отличие от других ИИ, при КЭИ очаговые и общемозговые симптомы довольно быстро регрессируют уже в течение первой недели заболевания [15,16]. В структуре всех ИИ тяжелые инсульты (> 20 баллов по шкале NIHSS) составляют около 13%, при этом большинство из них — это КЭИ [16]. Летальность при КЭИ на 20-30% выше, чем в целом в группе ИИ. Это обусловлено высокой частотой геморрагической трансформации ишемического очага и сложным патогенезом сочетанной сердечно-сосудистой патологии, характерной для больных с ФП [17]. Наряду с типичным тяжелым течением, в клинической практике встречаются относительно легкие проявления церебральной кардиоэмболии: транзиторные ишемические атаки (ТИА), малые инсульты с полным восстановлением функций и «парциальные» инсульты [17-19]. Нередко эти больные не попадают в неврологический стационар, а иногда и не обращаются за медицинской помощью. Это обстоятельство позволяет предполагать, что эпизодов острой церебральной ишемии, обусловленной кардиогенной эмболией больше, чем принято считать.
Нередко эти больные не попадают в неврологический стационар, а иногда и не обращаются за медицинской помощью. Это обстоятельство позволяет предполагать, что эпизодов острой церебральной ишемии, обусловленной кардиогенной эмболией больше, чем принято считать.
Больной С., 57 лет обратился к неврологу по поводу головной боли. Из анамнеза известно, что около 2 недель назад ухудшилось зрение, что не мешало пациенту продолжать работать. Артериальная гипертония (эпизодическое повышение АД до 160 мм рт ст) около 5 лет. Антигипертензивных препаратов регулярно не принимал. В неврологическом статусе: при ориентировочном исследовании полей зрения — левостороння гемианопсия, рефлексы орального автоматизма, легкая анизорефлексия на руках, симптом Бабинского слева. АД — 130/80 мм рт ст. ЧСС — 68 уд в 1 мин. Тоны сердца ясные, ритмичные, шумов нет. КТ головного мозга: признаки дисциркуляторной энцефалопатии — мелкие очаги пониженной плотности в глубине правого и левого полушарий, свежий ишемический очаг 3,6 × 2,2 мм в глубине правой височной доли. Консультация офтальмолога: левосторонняя верхняя квадрантная гемианопсия. ХМ 23 часа 20 мин: три эпизода фибрилляции предсердий продолжительность 2, 3 и 8 мин соответственно. ЭхоКГ: сократительная способность миокарда не нарушена, полости сердца незначительно расширены, пролапс митрального клапана. Диагноз: Артериальная гипертония первой степени. ИБС: пароксизмальная форма ФП. Кардиоэмболический инсульт, левосторонняя гемианопсия, легкий левосторонний пирамидный синдром.
Консультация офтальмолога: левосторонняя верхняя квадрантная гемианопсия. ХМ 23 часа 20 мин: три эпизода фибрилляции предсердий продолжительность 2, 3 и 8 мин соответственно. ЭхоКГ: сократительная способность миокарда не нарушена, полости сердца незначительно расширены, пролапс митрального клапана. Диагноз: Артериальная гипертония первой степени. ИБС: пароксизмальная форма ФП. Кардиоэмболический инсульт, левосторонняя гемианопсия, легкий левосторонний пирамидный синдром.
Клинический пример показывает, что у больного имеются значительные повреждения головного мозга, которые, вероятно, обусловлены повторными эпизодами церебральной эмболией. Вероятно, эти повреждения не имели ярких клинических проявлений. Предположение о значительной распространенности легких форм острой церебральной ишемии среди больных с ФП подтверждается исследованиями природы лакунарных инфарктов [7,20]. Используя ультразвуковой мониторинг церебрального кровотока, исследователи показали, что в значительной части наблюдений типичный по своим клиническим проявлениям лакунарный ИИ, был обусловлен церебральной кардиоэмболией [7].
Уточнение патогенетического подтипа уже свершившегося или будущего ИИ является непременным условием эффективности мер первичной и вторичной профилактики сосудистых событий [3]. У многих больных ФП протекает бессимптомно и первым клиническим признаком неблагополучия становится ОНМК [21]. Для выявления нарушений ритма у всех больных старше 65 лет рекомендуется периодический скрининг с помощью пальпации пульса и регистрации ЭКГ (Класс I Уровень В) [13]. С помощью ЭКГ и холтеровского мониторирования (ХМ) обнаруживают нарушения ритма, которые чаще всего ассоциируются с кардиогенной эмболией (постоянная, персистирующая или пароксизмальная форма). При пароксизмальной ФП даже длительное мониторирование в течение 7 дней позволяет документировать нарушения ритма примерно в 70% случаев. Имплантируемые устройства (безэлектродные петлевые регистраторы) увеличивают надёжность регистрации коротких эпизодов тахиаритмии [13].
ЭхоКГ является основным методом выявления потенциальных источников тромбоэмболии. Трансторакальная методика позволяет убедительно установить источник кардиальной эмболии только в 10 — 14% случаев, чрезпищеводная ЭхоКГ- более чем у 40% [7,8]. Ультразвуковое исследование сердца имеет большую чувствительность и специфичность в отношении изменений клапанов, формы и размеров полостей сердца. С помощью ЭхоКГ можно обнаружить тромб в левом желудочке сердца у больного, перенесшего инфаркт миокарда или спонтанную эхоконтрастную тень в левом предсердии у больного с ФП. ЭхоКГ должна выполняться всем больным с подозрением на кардиогенный характер ИИ.
Трансторакальная методика позволяет убедительно установить источник кардиальной эмболии только в 10 — 14% случаев, чрезпищеводная ЭхоКГ- более чем у 40% [7,8]. Ультразвуковое исследование сердца имеет большую чувствительность и специфичность в отношении изменений клапанов, формы и размеров полостей сердца. С помощью ЭхоКГ можно обнаружить тромб в левом желудочке сердца у больного, перенесшего инфаркт миокарда или спонтанную эхоконтрастную тень в левом предсердии у больного с ФП. ЭхоКГ должна выполняться всем больным с подозрением на кардиогенный характер ИИ.
Ультразвуковая детекция микроэмболов, движущихся по средней мозговой артерии — безопасный и надёжный метод верификации КЭИ. Мониторирование мозгового кровотока позволяет в автоматическом режиме обнаружить факт эмболии, подсчитать количество эмболических эпизодов [7].
Визуализация головного мозга (КТ, МРТ) часто склоняет врача к обсуждению проблемы КЭИ, если эти методы обнаруживают мультифокальные поражения головного мозга, «свежие» и «старые» ишемические очаги, как правило, небольших размеров, расположенные субкортикально или в глубинных отделах полушарий [3,5,7,8].
Таким образом, диагноз КЭИ устанавливается на основании клинической картины (острое начало с максимальным неврологическим дефицитом в дебюте), анамнеза (ТИА, нарушения ритма, заболевания сердца), ЭКГ и ХМ, ЭхоКГ (потенциальные источники эмболии), визуализации головного мозга (характерная картина мультифокальных ишемических повреждений). Предположения о возможной церебральной эмболии основываются на результатах кардионеврологического обследования, которое обнаруживает потенциальные источники эмболии.
Лечение КЭИ, как и других ишемических инсультов, проводится на основании общепринятых стандартов: базисная терапия, лечение и предупреждение осложнений, применение специальных методов терапии (Инсульт. Нормативные документы, 2010) [22]. К специальным методам лечения ИИ относят тромболитическую терапию, а в последние годы и механическую тромбэктомию [23]. Тромболитическая терапия возможна в течение первых 4,5 часов от появления первых симптомов ОНМК при условии выполнения протокола проведения операции [22]. Существуют обоснованные данные, что эндоваскулярная тромбэктомия может расширить терапевтическое окно для фибринолитической терапии до 8 часов, однако в настоящее время еще нет достаточных данных о применении метода у больных с кардиогенными инсультами [23]. Тромболизис не проводится больным с нарушениями ритма, которые уже получают антикоагулянты по постоянной схеме. В остром периоде ИИ могут быть использованы и другие методы антитромботической терапии. Эффективность и безопасность ацетилсалициловой кислоты (АСК) доказана результатами РКИ высокой степени достоверности (CAST) [24] Результаты применения нефракционированного и низкомолекулярного гепарина в остром периоде ИИ противоречивы, хотя в ряде руководств КЭИ указывается как единственное показание к назначению гепарина при ОНМК [14, 22]. Сомнительная эффективность прямых антикоагулянтов, как правило, не оправдывает значительную опасность геморрагических осложнений, в том числе тяжелых внутричерепных.
Существуют обоснованные данные, что эндоваскулярная тромбэктомия может расширить терапевтическое окно для фибринолитической терапии до 8 часов, однако в настоящее время еще нет достаточных данных о применении метода у больных с кардиогенными инсультами [23]. Тромболизис не проводится больным с нарушениями ритма, которые уже получают антикоагулянты по постоянной схеме. В остром периоде ИИ могут быть использованы и другие методы антитромботической терапии. Эффективность и безопасность ацетилсалициловой кислоты (АСК) доказана результатами РКИ высокой степени достоверности (CAST) [24] Результаты применения нефракционированного и низкомолекулярного гепарина в остром периоде ИИ противоречивы, хотя в ряде руководств КЭИ указывается как единственное показание к назначению гепарина при ОНМК [14, 22]. Сомнительная эффективность прямых антикоагулянтов, как правило, не оправдывает значительную опасность геморрагических осложнений, в том числе тяжелых внутричерепных.
Задача предотвращения повторных эпизодов церебральной и системной эмболии у больных с кардиогенными инсультами становится актуальной уже в остром периоде ОНМК.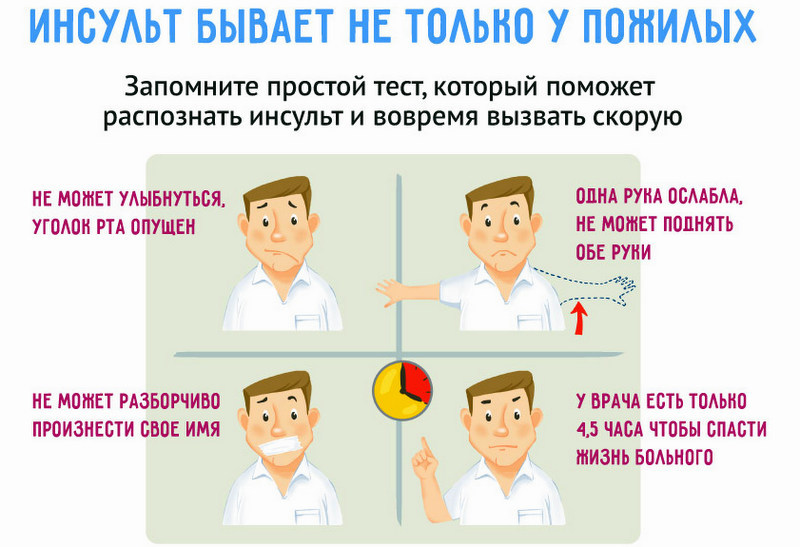 Современные Рекомендации по диагностике и лечению фибрилляции предсердий, оставляют возможность применения АСК для этой цели только в случаях, если по каким-то причинам не могут быть назначены антикоагулянты [13]. Больные с КЭИ, получавшие АСК (150 — 300 мг в сутки) в остром периоде заболевания, в дальнейшем должны принимать антикоагулянты. Конкретные сроки перевода зависят от величины очага повреждения, эффективности контроля за АД и других клинических обстоятельств. Сочетание тромбоцитарных антиагрегантов с антикоагулянтами не оправдано — количество повторных инсультов не уменьшается, а вероятность геморрагических осложнений увеличивается [13,25]. После легких эпизодов кардиогенной эмболии антикоагулянты можно назначать уже на 2-3 день, в остром периоде малого инсульта — на 5 — 6 день. Если повреждения головного мозга обширны, то не ранее 12-14 дня [13,21]. В некоторых случаях (геморрагическая трансформация ишемического очага, резистентная артериальная гипертензия, высокий риск кровотечений) начало превентивного лечения антикоагулянтами может быть отсрочено на более стабильный период.
Современные Рекомендации по диагностике и лечению фибрилляции предсердий, оставляют возможность применения АСК для этой цели только в случаях, если по каким-то причинам не могут быть назначены антикоагулянты [13]. Больные с КЭИ, получавшие АСК (150 — 300 мг в сутки) в остром периоде заболевания, в дальнейшем должны принимать антикоагулянты. Конкретные сроки перевода зависят от величины очага повреждения, эффективности контроля за АД и других клинических обстоятельств. Сочетание тромбоцитарных антиагрегантов с антикоагулянтами не оправдано — количество повторных инсультов не уменьшается, а вероятность геморрагических осложнений увеличивается [13,25]. После легких эпизодов кардиогенной эмболии антикоагулянты можно назначать уже на 2-3 день, в остром периоде малого инсульта — на 5 — 6 день. Если повреждения головного мозга обширны, то не ранее 12-14 дня [13,21]. В некоторых случаях (геморрагическая трансформация ишемического очага, резистентная артериальная гипертензия, высокий риск кровотечений) начало превентивного лечения антикоагулянтами может быть отсрочено на более стабильный период.
Для первичной и вторичной профилактики КЭИ у больных с кардиогенными инсультами чаще используется варфарин (В). Применение В для профилактики тромбоэмболий имеет многолетнюю историю и основано на надёжных доказательствах [13,25]. Варфарин является препаратом выбора при лечении больных с механическими клапанами сердца, грубыми клапанными стенозами, ревматическими пороками сердца. У больных с ФП лечение В (МНО 2,0 — 3,0) снижает риск КЭИ на 64 — 68% [25]. Однако необходимость частого лабораторного контроля, взаимодействие с лекарствами и пищей, индивидуальная чувствительность и высокий риск геморрагических осложнений во время лечения часто нивелируют высокую эффективность препарата: только 50 — 70% больных получают варфарин в адекватных дозах с необходимым уровнем контроля. Нередко врачи опасаются назначать В, предпочитая «безопасный» аспирин или другие тромбоцитарные антиагреганты. Новые антикоагулянты (НА) — дабигатрана этексилат — (прямой ингибитор тромбина), ривароксабан и апиксабан — ингибиторы фактора Xа свёртывания крови, находят всё большее применение в клинической практике. Преимущества НПА представляются значительными: фиксированные дозы, отсутствие необходимости лабораторного мониторинга, эффективность сравнимая с В и меньшая опасность кровотечений. Несмотря на очевидные преимущества, доля больных, получающих с профилактической целью НА в настоящее время не превышает 5-6% от числа всех пациентов, нуждающихся в проведении активной превентивной антитромботической терапии. Это связано с высокой стоимостью НА и существенными ограничениями в показаниях. Показания к назначению НА принято определять с помощью шкалы CHA2DS2VASc. Риск кровотечений определяют по шкале HAS-BLED [26,27]. Основные цели, требующие внимания врача при ведении больного, получающего антикоагулянты: приверженность к лечению, соблюдение режима дозирования, тромбоэмболические эпизоды и кровотечения, побочные эффекты, совместимость с другими лекарствами, анализ лабораторных тестов. Нельзя утверждать, что больные, получающие НА, не требуют лабораторного контроля. Общий анализ крови, уровень креатинина и показатели, отражающие функцию печени, целесообразно повторять как минимум 2 раза в год, а при нарушении функции печени и почек — чаще — 1 раз в 2 — 3 месяца [28].
Преимущества НПА представляются значительными: фиксированные дозы, отсутствие необходимости лабораторного мониторинга, эффективность сравнимая с В и меньшая опасность кровотечений. Несмотря на очевидные преимущества, доля больных, получающих с профилактической целью НА в настоящее время не превышает 5-6% от числа всех пациентов, нуждающихся в проведении активной превентивной антитромботической терапии. Это связано с высокой стоимостью НА и существенными ограничениями в показаниях. Показания к назначению НА принято определять с помощью шкалы CHA2DS2VASc. Риск кровотечений определяют по шкале HAS-BLED [26,27]. Основные цели, требующие внимания врача при ведении больного, получающего антикоагулянты: приверженность к лечению, соблюдение режима дозирования, тромбоэмболические эпизоды и кровотечения, побочные эффекты, совместимость с другими лекарствами, анализ лабораторных тестов. Нельзя утверждать, что больные, получающие НА, не требуют лабораторного контроля. Общий анализ крови, уровень креатинина и показатели, отражающие функцию печени, целесообразно повторять как минимум 2 раза в год, а при нарушении функции печени и почек — чаще — 1 раз в 2 — 3 месяца [28].
Таким образом, предупреждение кардиогенного ишемического инсульта является одним из наиболее важных и перспективных направлений превентивной кардионеврологии. Методы диагностики патологических синдромов, способных привести к КЭИ, надёжны, доступны, эффективны и широко используются в клинической практике. Большинство КЭИ ассоциируется с ФП, распространённость которой в популяции увеличивается вместе с увеличением продолжительности жизни. Антитромботическая терапия, основанная на применении антикоагулянтов, является эффективным способом предупреждения кардиогенных инсультов (при правильном её проведении).
Литература
- Тул Д. Ф. Сосудистые заболевания головного мозга/Перевод с англ./Под редакцией акад. РАМН Е.И.Гусева, проф. А.Б. Гехт/ Руководство для врачей: 6 изд. – М.: ГЭОТАР-Медиа, 2007.
- 2013 АСС/AHA Guidline on the Assesment of Cardiovascular Risk/ http://content.onlinejacc.org/pdfAccess.ashx?url=/data/Journals/JAC/0
- Широков Е.
 А. Технология предупреждения инсульта. Пять лекций для врачей общей практики. – М.: Издательство КВОРУМ, 2011.
А. Технология предупреждения инсульта. Пять лекций для врачей общей практики. – М.: Издательство КВОРУМ, 2011. - Adams H.P., Bendixen B.H., Kappele L.J. et al. Classification of subtype of acute stroke: Definition for use in a multicentre clinical trial, TOAST, Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993; 24 (1): 35-41
- Bladin C.F., Chambers B.R. Frequency and pathogenesis of hemodynamic stroke. Stroke. 1994; 25: 2179 – 2182.
- Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии.– М.: Медицина.–1997.
- Шевченко Ю.Л., Кузнецов А.Н., Виноградов О.И. Лакунарный инфаркт головного мозга. – М.: РАЕН, 2011.
- Фонякин А.В., Гераскина Л.А., Суслина З.А. Кардиологическая диагностика при ишемическом инсульте. – СПб.: Инкрат, 2005.
- Friberg L., Benson L., Rosengvist M., Lip G. Assesment of female sex as a risk factor in atrial fibrillation in Sweden: nationwide retrospective cohort study.
 BMJ 2012; 334: e3552.
BMJ 2012; 334: e3552. - Волков В.Е. Фибрилляция предсердий, ассоциированная с артериальной гипертензией. Фарматека. 2011; 14: 20 – 23.
- Кательницкая Л.И., Хаишева Л.А. Гендерные особенности клинического течения и лечения больных артериальной гипертонией. Рациональная фармакотерапия в кардиологии. 2008; 1: 76 – 80.
- Lioyd-Jones D.M., Wang T.J., Leip E.P., et al. Lifetime risk for developvent of atrial fibrillation: the Framingham Heart Stdy. Circulation. 2004; 110:1042-1046.
- Диагностика и лечение фибрилляции предсердий. Рекомендации РКО, ВНОА и АССХ, 2012 г. Выпуск 2.
- Парфенов В.А., Хасанова Д.Р. Ишемический инсульт. – М.: ООО «Издательство «Медицинское информационное агентство», 2012.
- Ёлкина Т.А., Осетров А.С. Клинико-неврологическая характеристика острого периода кардиоэмболического инсульта. Журнал «Медицина и образование в Сибири». Сетевое издание. 2013; 3.
- Bill O., Zufferey P., Faouzi M..
 et al. Severe stroke: patient profile and predictors of favorable Outcome. J Stroke Cerebrov Dis. 2013; 22(8): 373–380.
et al. Severe stroke: patient profile and predictors of favorable Outcome. J Stroke Cerebrov Dis. 2013; 22(8): 373–380. - Milionis H., Faouzi M., Cordier M., D`Ambrogio-Remillard S., Eskandari A., Michel P. Characteristics and early and long-term outcome in patients with acute ischemic stroke and low ejection fraction. Int J Cardiol. 2012; 4: 84-88.
- Mathias T. L., Albright K C., Boehme A.K., et al. Cardiac Function and Short-Term Outcome in Patients with Acute Ischemic Stroke: A Cross-Sectional Study. J CardVasc Dis. 2013; 2(1): 26-29.
- Chimowitz M.I. The Feinberg award lecture 2013. Treatment of intracranial atherosclerosis: from the past and planning for the future. Stroke. 2013; 44:9: 2664 – 2669.
- Кузнецов А.Н., Винорадов О.И., Рыбалко Н.В. Современные подходы к антитромботической терапии у больных с кардиоэмболическим инсультом. Неврология. Нейропсихиатрия. Психосоматика. 2013; (Спецвыпуск 2): 28-39.
- Kirchhof P., Bax J.
 , Blomstorm-Lundquist C., et al. Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference «Research perspectives in AF». Eur Heart J. 2009; 30: 2969-2977.
, Blomstorm-Lundquist C., et al. Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference «Research perspectives in AF». Eur Heart J. 2009; 30: 2969-2977. - Инсульт. Нормативные документы. Под редакцией П.А.Воробьева. М.: НЬЮДИАМЕД, 2010.
- Alshekhlee A., Pandya D.J., English J., et al. Merci mechanical thrombectomy retriever for acute ischemic stroke therapy. Neurology. 2012; 25 (79): 126-134.
- CAST (Chinese Acute Stroke Trial) Collaborative grope, CAST: randomized placebo-controlled trial of early aspirin use in 20 000 patients with fcute ischemic stroke. Lancet. 1997; 349:1641-1649.
- Wolf P.A., Mitchell J.B., Baker C.S., et al. Impact of atrial fibrillation on mortality, stroke. And medical costs. Arch Intern Med. 1988; 158 (3): 229 -234.
- Ezekowith M.C., Connolly S., Parekh A., et al. Rationale and design of RE-LY: randomized evalution of long-term anticoagulant therapy, warfarin, compared with dabigatran, Am Heart J.
 2009; 157 (5): 805-810.
2009; 157 (5): 805-810. - Alberts M.J., Berstein R.A., Naccarelli G. V., Garcia D.A. Using dabigatran in patients with stroke. A practical guide for clinicians. Stroke. 2012; 43:271-279.
- Heidbuchel H., Verhamme P., Alings M., et al. European Heart Rhythm Association Practical Guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation. Europace. 2013;15:625-651.
Сканирование мозга «может предсказать риск» даже после легкого инсульта
Опубликовано
Все пациенты должны пройти сканирование мозга после инсульта, даже если это мини-инсульт, говорят канадские исследователи, пишущие в журнале Stroke.
Это связано с тем, что изображения мозга могут помочь врачам оценить нанесенный ущерб и предсказать риск повторного инсульта.

В Великобритании руководства рекомендуют срочное лечение пациентов с высоким риском инсульта.
Но Ассоциация по борьбе с инсультом утверждает, что тысячи жизней могут быть спасены путем лечения микроинсультов в течение 24 часов.
Исследовательская группа во главе с доктором Джеффри Перри, адъюнкт-профессором медицины неотложных состояний в Оттавском университете в Канаде, отследила более 2000 пациентов, которым в течение 24 часов была проведена компьютерная томография после транзиторной ишемической атаки (ТИА) или неинвалидизирующего инсульта. .
ТИА вызывается ограниченным кровоснабжением головного мозга, и симптомы могут длиться всего несколько минут.
Компьютерная томография объединяет серию рентгеновских изображений, чтобы дать врачам изображения поперечного сечения головного мозга.
Сканирование показало, что 40% имели повреждения головного мозга из-за нарушения кровообращения.
Врачи искали признаки недавно поврежденной ткани из-за плохой циркуляции, ранее поврежденной ткани и любого типа повреждения мелких кровеносных сосудов в головном мозге, например, сужение мелких сосудов.

У четверти пациентов, обнаруживших все эти типы повреждений головного мозга при сканировании, в течение 90 дней был повторный инсульт.
Это по сравнению с 3,4% людей в исследовательской группе в целом, что делает сканирование полезным инструментом прогнозирования.
Д-р Перри сказал: «В течение 90-дневного периода, а также в течение первых двух дней после первоначального приступа пациенты чувствовали себя намного хуже с точки зрения последующего инсульта, если у них были дополнительные области повреждения наряду с острой ишемией».
Он добавил, что врачи должны быть готовы использовать компьютерную томографию у пациентов в течение 24 часов после легкого инсульта, даже если симптомы не длятся долго.
«Эти результаты должны побудить врачей быть более агрессивными в лечении пациентов с ТИА или неинвалидизирующим инсультом, у которых диагностирована острая ишемия».
Другие меры по предотвращению повторного инсульта могут включать кардиомониторинг или прием лекарств для снижения артериального давления, лечения высокого уровня холестерина или предотвращения образования тромбов.

Крис Ларкин, региональный руководитель Ассоциации по борьбе с инсультом, сказал, что микроинсульт часто может быть предупредительным признаком того, что приближается серьезный инсульт.
«Каждый год около 46 000 человек в Великобритании переносят мини-инсульт [транзиторную ишемическую атаку или ТИА].
«Быстрая реакция на инсульт может значительно снизить риск смерти и инвалидности.
«Если пациенты с мини-инсультом обследуются и получают неотложную помощь в течение 24 часов, риск большого инсульта снижается на 80%. .»
BBC не несет ответственности за содержание внешних сайтов.
Внутривенная альтеплаза при остром ишемическом ишемическом инсульте легкой степени тяжести, не приводящем к инвалидности: слишком далеко? | Цереброваскулярная болезнь | JAMA
Внутривенная альтеплаза для лечения легкого неинвалидизирующего острого ишемического инсульта: мост слишком далеко? | Цереброваскулярная болезнь | ДЖАМА | Сеть ДЖАМА [Перейти к навигации]Эта проблема
Просмотр показателей
- Скачать PDF
- Полный текст
Поделиться
Твиттер Фейсбук Эл.
 адрес
LinkedIn
адрес
LinkedIn- Процитировать это
- Разрешения
Редакция
10 июля 2018 г.
Уильям Дж. Пауэрс, MD 1
Принадлежность автора Информация о статье
1 Медицинский факультет Университета Северной Каролины в Чапел-Хилл
ДЖАМА. 2018;320(2):141-143. дои: 10.1001/jama.2018.8511
Полный текст
Лечение пациентов с инсультом существенно изменилось за последние 25 лет. В 1995 г. исследование NINDS rt-PA показало, что среди отдельных пациентов с острым ишемическим инсультом, которым вводили альтеплазу внутривенно в течение 3 часов после известного начала инсульта или последней известной продолжительности выздоровления, инвалидность снизилась через 3 месяца.




 А. Технология предупреждения инсульта. Пять лекций для врачей общей практики. – М.: Издательство КВОРУМ, 2011.
А. Технология предупреждения инсульта. Пять лекций для врачей общей практики. – М.: Издательство КВОРУМ, 2011. BMJ 2012; 334: e3552.
BMJ 2012; 334: e3552. et al. Severe stroke: patient profile and predictors of favorable Outcome. J Stroke Cerebrov Dis. 2013; 22(8): 373–380.
et al. Severe stroke: patient profile and predictors of favorable Outcome. J Stroke Cerebrov Dis. 2013; 22(8): 373–380. , Blomstorm-Lundquist C., et al. Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference «Research perspectives in AF». Eur Heart J. 2009; 30: 2969-2977.
, Blomstorm-Lundquist C., et al. Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference «Research perspectives in AF». Eur Heart J. 2009; 30: 2969-2977. 2009; 157 (5): 805-810.
2009; 157 (5): 805-810.

 адрес
LinkedIn
адрес
LinkedIn