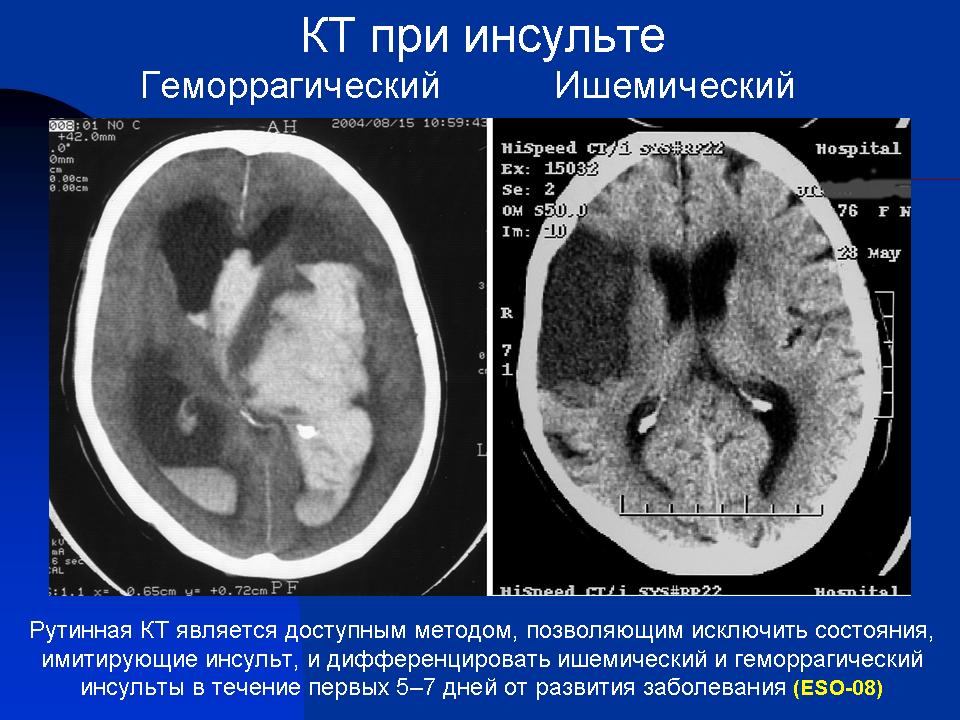
Гемодинамический инсульт: Мозговой инсульт — КГБУЗ «МАНСКАЯ РАЙОННАЯ БОЛЬНИЦА»
ИНСУЛЬТ
«Инсультом» называется внезапное прерывание кровоснабжения в головной мозг, вызывающее нарушение его нормального функционирования.
Последствия инсульта
Как правило, в зависимости от локализации инсульта, могут проявляться перечисленные ниже симптомы.
Левое полушарие
- Слабость в правой стороне тела
- Потеря чувствительности в правой стороне тела
- Потеря зрения в правом поле зрения
- Нарушения выражения или понимания языка
- Трудности в речи
- Немота
- Замена слов или слогов
- Ошибки в названиях объектов
- Проблемы чтения и/или письма
Правое полушарие
- Слабость в левой стороне тела
- Потеря чувствительности в левой стороне тела
- Потеря зрения в левом поле зрения
- Отсутствие распознания левой стороны тела или окружающей среды слева
- Проблемы с вниманием, частые отвлечения, потеря концентрации
- Низкая осведомленность о текущих или будущих проблемах актуальности, непризнание своего заболевания
Anoxia/Hipoxia ISQUÉMICA
- Поведенческие проблемы с преобладанием импульсивности и внезапных изменений характера
- Потеря сознания
- Трудности при глотании
- Трудности артикуляции
- Двойное зрение
- Неуверенная ходьба
- Потеря координации
Виды инсульта
Ишемические инсульты являются наиболее распространенными и составляют около 85% всех инсультов. Ишемические инсульты происходят по причине снижения кровоснабжения мозга. Существуют несколько типов ишемического инсульта:
Ишемические инсульты происходят по причине снижения кровоснабжения мозга. Существуют несколько типов ишемического инсульта:
Транзиторная ишемическая атака (ТИА)
ТИА (транзиторная ишемическая атака) — это симптомы, вызванные инсультом, имеющие временный характер и исчезающие в течении суток. Клинические проявления ТИА схожи с описанными выше для инсульта. Очень важно научится распознать предупреждающие симптомы и вероятность возникновения ТИА, поскольку каждый третий пациент, перенесший ТИА без соответствующего лечения, подвергается риску повторения данного инсульта примерно через год.
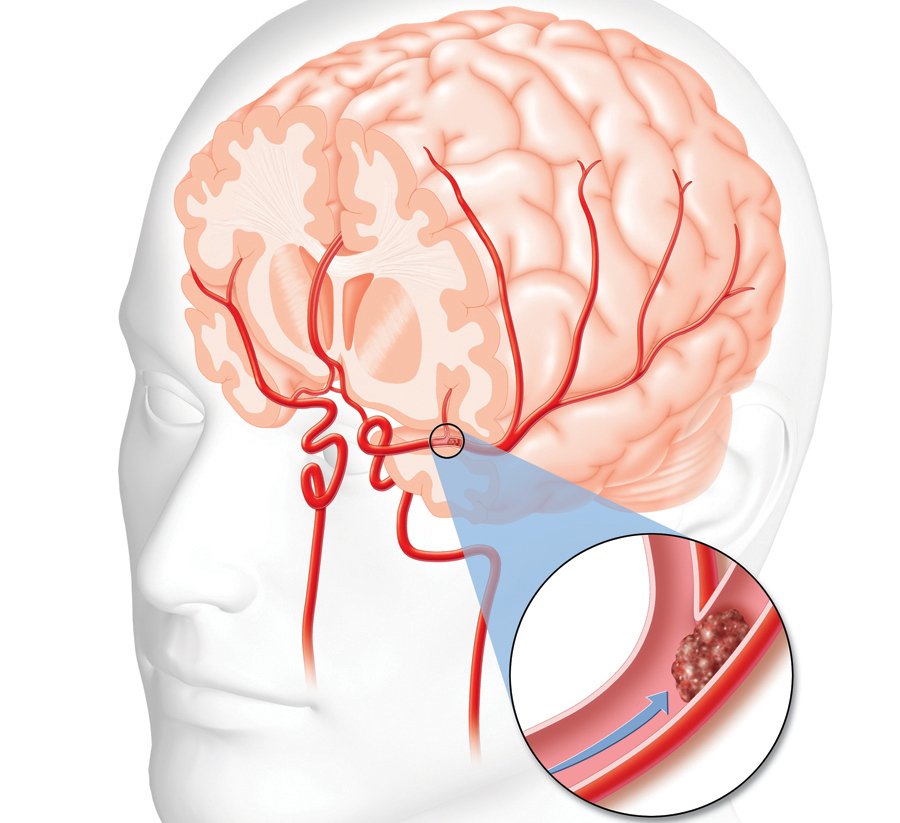
Атеротромботический инсульт или тромбоз
Этот вид инсульта получил свое название благодаря бляшке «атеромы» или «атеросклероза», которая прикрепляется к стенке одного из сосудов, снабжающих головной мозг кровью. Бляшка начинает расти и формирует сгусток или «тромб», который блокирует кровоснабжение головного мозга. Атеротромбическим инсультом чаще всего страдают пациенты, перенесшие заболевания сердца, связанные с атеросклерозом, такие как «стенокардия» и инфаркт миокарда.
Эмболический инсульт или эмболия
Эмболический инсульт возникает в результате закупорки сосуда головного мозга тромбом, образовавшимся в сердце или другой части тела. Сгусток крови, получивший название «поршень», оторвавшись от места своего образования, переносится в головной мозг с током крови. При достижении тонких артерий и капилляров головного мозга, поршень может блокировать ток крови, что приводит к ишемическому поражению тканей.
Гемодинамический инсульт
Гемодинамический инсульт является достаточно редкой разновидностью ишемического инсульта. Он возникает, как правило, на фоне артериальной гипертонии и сопровождается нарушениями внутримозгового кровообращения, разрывом сосудов мозга и выходом эритроцитов через стенки артерий в окружающие ткани. Причиной этого типа инсульта могут стать остановка сердца, тяжелая аритмия или тяжелой длительная гипотензии.
Геморрагический инсульт
Геморрагический инсульт встречается реже, чем ишемический (около 15% от всех инсультов), но традиционно ассоциируется с повышенной смертностью, особенно в первые часы. Часто геморрагический инсульт может стать причиной вторичного ишемического инсульта, так как разрыв сосуда приводит к остановке кровоснабжения зависимой области, а изливающая кровь оказывает комрессионное воздействие на структуры головного мозга, и окружающие пораженную область сосуды.
Часто геморрагический инсульт может стать причиной вторичного ишемического инсульта, так как разрыв сосуда приводит к остановке кровоснабжения зависимой области, а изливающая кровь оказывает комрессионное воздействие на структуры головного мозга, и окружающие пораженную область сосуды.
Среди геморрагических инсультов первое место по частоте встречаемости занимают внутримозговые кровоизлияния а второе — субарахноидальные кровоизлияния.
Какие бывают патогенетические варианты ишемического инсульта
Актуальность проблемы
Проблема предупреждения и лечения острых нарушений мозгового кровообращения (ОНМК), в последние годы, становится все более актуальной. Ежегодно в мире мозговой удар настигает более 15 млн. человек. Рост заболеваемости инсультом связывают с увеличением средней продолжительности жизни в большинстве стран мира. Однако, существует и другая тенденция — инсульт молодеет. В последние годы не менее 20% ОНМК диагностируется у больных моложе 50 лет [4,7,8]. Несмотря на внедрение в клиническую практику новых методов диагностики и лечения заболеваний сердечно-сосудистой системы, в ближайшие годы существенного снижения заболеваемости инсультом ожидать нельзя. Это связано только с большей распространенностью заболеваний сердечно-сосудистой системы в популяции, но и со значительной дистанцией между современными знаниями о природе инсульта и их практическим применением. Одним из наиболее перспективных направлений повышения эффективности борьбы с инсультом является направление индивидуальной профилактики, предполагающее своевременную диагностику, прогностическую оценку и коррекцию патологических процессов и клинических синдромов, способных привести к инсульту. Разработка этого направления требует глубокого изучения патокинеза инсульта – последовательных стадий развития патологического процесса, которые приводят к декомпенсации кровоснабжения мозга [8].
Несмотря на внедрение в клиническую практику новых методов диагностики и лечения заболеваний сердечно-сосудистой системы, в ближайшие годы существенного снижения заболеваемости инсультом ожидать нельзя. Это связано только с большей распространенностью заболеваний сердечно-сосудистой системы в популяции, но и со значительной дистанцией между современными знаниями о природе инсульта и их практическим применением. Одним из наиболее перспективных направлений повышения эффективности борьбы с инсультом является направление индивидуальной профилактики, предполагающее своевременную диагностику, прогностическую оценку и коррекцию патологических процессов и клинических синдромов, способных привести к инсульту. Разработка этого направления требует глубокого изучения патокинеза инсульта – последовательных стадий развития патологического процесса, которые приводят к декомпенсации кровоснабжения мозга [8].
 Современное кардионеврологическое обследование (исследование центральной и церебральной гемодинамики, лабораторные тесты, визуализация мозга и сосудов), позволяет выявить относительно небольшое количество клинических, клинико-лабораторных и клинико-инструментальных синдромов, «ответственность» которых за ОНМК доказана достоверным уменьшением числа инсультов при использовании соответствующей тактики превентивного лечения – репрезентативных синдромов. Такими синдромами являются: артериальная гипертония, нарушения сердечного ритма, гиперкоагуляция крови, атеросклеротические стенозы и окклюзии брахиоцефальных артерий [2,5,6]. Существуют и другие патологические процессы, течение которых осложняется ОНМК, но коррекция этих четырех симптомокомплексов имеет наибольший превентивный потенциал и может оказать заметное влияние на заболеваемость. Антигипертензивная терапия способна снизить частоту ОНМК на 28 – 30%, антикоагулянты и дезагреганты – на 30 – 60%, реконструктивные операции при стенозировании брахиоцефальных артерий – на 12-35% [5-8].
Современное кардионеврологическое обследование (исследование центральной и церебральной гемодинамики, лабораторные тесты, визуализация мозга и сосудов), позволяет выявить относительно небольшое количество клинических, клинико-лабораторных и клинико-инструментальных синдромов, «ответственность» которых за ОНМК доказана достоверным уменьшением числа инсультов при использовании соответствующей тактики превентивного лечения – репрезентативных синдромов. Такими синдромами являются: артериальная гипертония, нарушения сердечного ритма, гиперкоагуляция крови, атеросклеротические стенозы и окклюзии брахиоцефальных артерий [2,5,6]. Существуют и другие патологические процессы, течение которых осложняется ОНМК, но коррекция этих четырех симптомокомплексов имеет наибольший превентивный потенциал и может оказать заметное влияние на заболеваемость. Антигипертензивная терапия способна снизить частоту ОНМК на 28 – 30%, антикоагулянты и дезагреганты – на 30 – 60%, реконструктивные операции при стенозировании брахиоцефальных артерий – на 12-35% [5-8].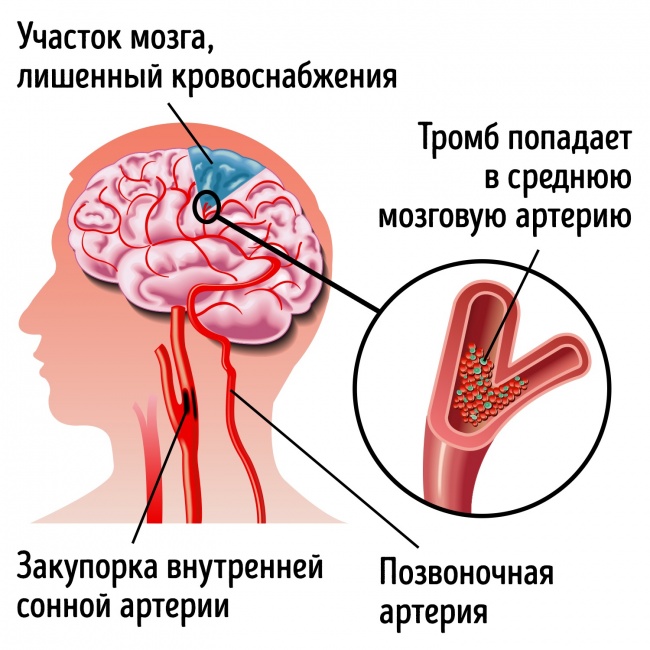
Идеологический сдвиг от множества бессистемных факторов риска к диагностике и коррекции репрезентативных синдромов, определяющих степень индивидуального риска, представляется существенным прогрессом в превентивной кардионеврологии. Однако, и репрезентативные синдромы составляют лишь звено длинной цепи патологических процессов, которые каждого больного своим путем приводят к сосудистой катастрофе. Репрезентативные синдромы создают необходимые условия для декомпенсации мозгового кровообращения, но не являются причинами инсульта. Артериальная гипертония может всю жизнь сопутствовать больному и никогда не осложниться ОНМК. Обнаруженный при ультразвуковом исследовании критический стеноз сонной артерии формируется много лет и не всегда приводит к инсульту. Между патологическим процессом, создающим условия для ОНМК, и мозговой катастрофой всегда происходит событие, которое декомпенсирует гемодинамические и гемостатические резервы. В патокинезе ОНМК существует одна общая закономерность: инсульт развивается внезапно на фоне длительного существования патологических процессов.
Гемодинамический криз и его варианты
Гемодинамический криз — результат накопления последовательно и параллельно протекающих патологических процессов, создающих «критическую массу» органических и функциональных нарушений, которые при определенном стечении обстоятельств, приводят к возникновению лавинообразно нарастающих изменений, затрагивающих всю систему кровообращения. Для большинства хронических заболеваний сердечно-сосудистой системы характерно длительное течение с периодами обострений. Но в некоторых случаях такое обострение носит характер обвала, криза (crisis – внезапная перемена в течении болезни). Криз отличается от обострения болезни скоротечностью событий и декомпенсацией кровообращения на уровне центральной, региональной гемоднамики и микроциркуляции.
 Клинические данные, анамнез и современные методы исследования дают возможность выделять и идентифицировать восемь вариантов гемодинамических кризов: гипертонический, гипотонический, аритмический, коронарный, ангиодистонический, гемореологический, нейроэндокринный, обтурационный [8].
Клинические данные, анамнез и современные методы исследования дают возможность выделять и идентифицировать восемь вариантов гемодинамических кризов: гипертонический, гипотонический, аритмический, коронарный, ангиодистонический, гемореологический, нейроэндокринный, обтурационный [8].Гипертонический криз – одна из наиболее частых причин развития ОНМК. С гипертоническим кризом связано абсолютное большинство ОНМК, 20% поводов для вызова бригад скорой помощи и 30% всех оснований, требующих оказания неотложной помощи. Повышение артериального давления часто сопутствует другим гемодинамическим кризам, является следствием, а не причиной церебральной ишемии. Поскольку регистрация высоких цифр АД осуществляется, чаще всего, в ходе развития криза, можно предполагать, что с гипертоническим кризом связано меньшее количество ОНМК, чем это принято считать. Гипертонический криз может быть спровоцирован стрессом, употреблением алкоголя, отменой приема лекарств. В зависимости от сократительной функции сердца и состояния сосудов мозга, гипертонический криз может привести к развитию лакунарного, гемодинамического ишемического инсульта [7-9].
В последние годы исследователи стали обращать внимание на абсолютную и относительную артериальную гипотонию у больных, адаптированных к высоким цифрам АД. Эпизоды снижения системного АД приобретают особое значение у больных с выраженными атеросклеротическими изменениями брахиоцефальных артерий [8]. Гипотонические кризы характерны для больных паркинсонизмом, они могут быть следствием неадекватного применения антигипертензивных лекарственных средств. По данным Научного центра неврологии не менее 21% ОНМК происходит на фоне значительного снижения АД, вызванного неадекватным использованием различных лекарственных средств. Гипотонический криз может быть связан с нарушениями суточного ритма АД, которые можно выявить методом длительного мониторирования. Идиопатическая артериальная гипотония приобретает клиническое значение в пожилом возрасте, вместе с проявлениями ишемической болезни сердца. Гипотонический криз может быть вызван интоксикацией, инфекцией, болью и другими внутренними и внешними факторами. Гипотонические кризы ассоциируются с серийными преходящими нарушениями мозгового кровообращения и гемодинамическими инсультами с мультифокальными мелкоочаговыми повреждениями мозга.
Гипотонический криз может быть связан с нарушениями суточного ритма АД, которые можно выявить методом длительного мониторирования. Идиопатическая артериальная гипотония приобретает клиническое значение в пожилом возрасте, вместе с проявлениями ишемической болезни сердца. Гипотонический криз может быть вызван интоксикацией, инфекцией, болью и другими внутренними и внешними факторами. Гипотонические кризы ассоциируются с серийными преходящими нарушениями мозгового кровообращения и гемодинамическими инсультами с мультифокальными мелкоочаговыми повреждениями мозга.
Коронарный криз – одна из частых, но не всегда диагностируемых причин декомпенсации мозгового кровообращения. Не только стенокардия, но и безболевая ишемия миокарда способны привести к снижению эффективной работы сердца. Не менее, чем у 16% больных с гемодинамическим инсультом при холтеровском мониторировании выявляются транзиторные эпизоды безболевой ишемии миокарда [9-12]. Кроме того, коронарная недостаточность часто сопровождается кратковременными нарушениями ритма сердца (желудочковой экстрасистолией, фибрилляцией предсердий).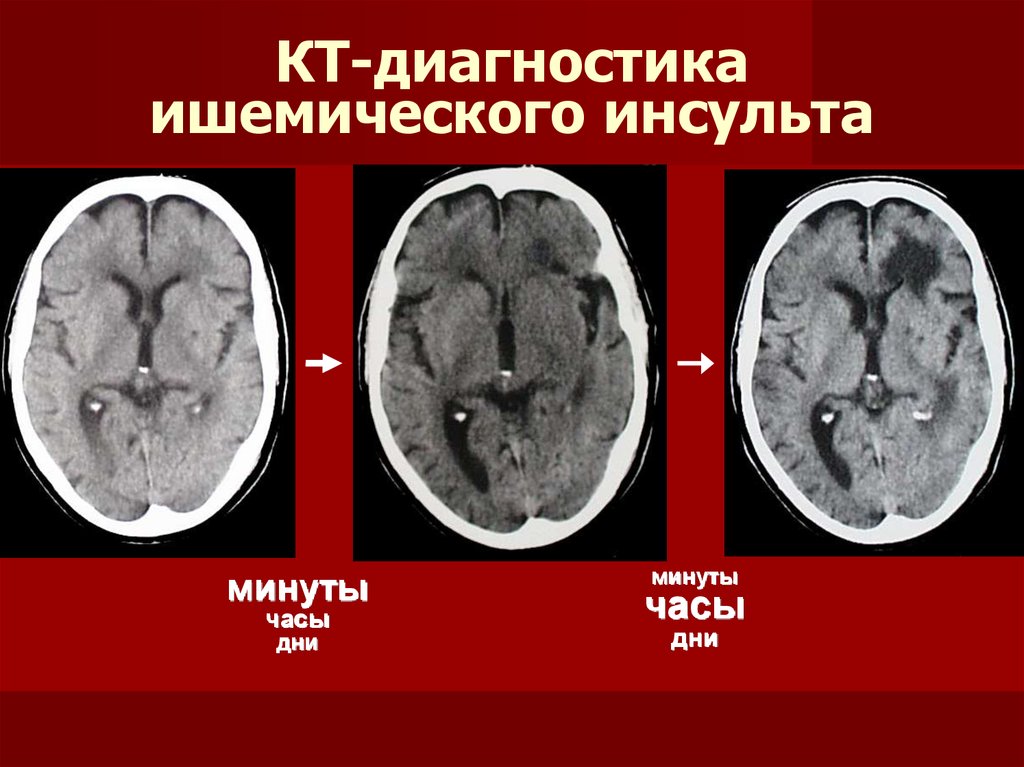 Коронарный атеросклероз, проявляющийся стенокардией или безболевой ишемией миокарда, как правило, сочетается со стенозами брахиоцефальных артерий. Кратковременное снижение ударного объема крови не может быть компенсировано патологически измененной артериальной системой мозга. Коронарный криз является причиной сочетанного повреждения сердца и мозга при инфаркте миокарда. Предикторы коронарного криза обнаруживаются на ЭКГ (признаки коронарной недостаточности, желудочковая экстрасистолия). С большей вероятностью коронарные эпизоды можно выявить при суточном мониторировании ЭКГ или нагрузочных пробах. Коронарный криз обычно приводит к развитию гемодинамического или кардиоэмболического инсульта.
Коронарный атеросклероз, проявляющийся стенокардией или безболевой ишемией миокарда, как правило, сочетается со стенозами брахиоцефальных артерий. Кратковременное снижение ударного объема крови не может быть компенсировано патологически измененной артериальной системой мозга. Коронарный криз является причиной сочетанного повреждения сердца и мозга при инфаркте миокарда. Предикторы коронарного криза обнаруживаются на ЭКГ (признаки коронарной недостаточности, желудочковая экстрасистолия). С большей вероятностью коронарные эпизоды можно выявить при суточном мониторировании ЭКГ или нагрузочных пробах. Коронарный криз обычно приводит к развитию гемодинамического или кардиоэмболического инсульта.
Аритмический криз (пароксизмальные формы нарушений ритма сердца) – одна из самых частых причин ОНМК. Пароксизм мерцательной аритмии снижает минутный объем крови на 20 – 25%, что составляет патофизиологическую основу для ишемии мозга [1,11]. Фибрилляция предсердий создает условия для образования тромбов в полостях сердца.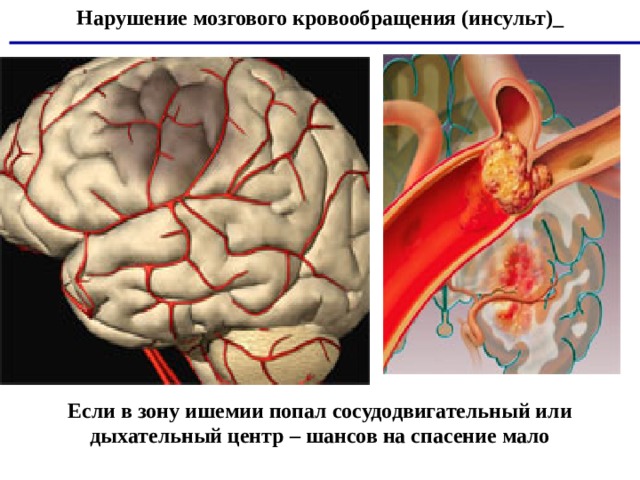 Известно, что синдром слабости синусового узла встречается значительно чаще у пациентов с инсультами не установленной этиологии. У 48% больных с инсультом, пароксизмы аритмии протекали бессимптомно [8,10-12]. Предикторы ОНМК в этом случае – выявляемые при суточном мониторировании ЭКГ пароксизмальные нарушения ритма. В некоторых случаях при ЭхоКГ удается обнаружить пристеночные тромботические массы в полостях сердца или спонтанные эхо-контрастные тени. Аритмический криз является основной причиной кардиоэмболического инсульта. В некоторых случаях, при выраженных атеросклеротических изменениях артериальной системы мозга, возможен гемодинамический механизм церебральной ишемии.
Известно, что синдром слабости синусового узла встречается значительно чаще у пациентов с инсультами не установленной этиологии. У 48% больных с инсультом, пароксизмы аритмии протекали бессимптомно [8,10-12]. Предикторы ОНМК в этом случае – выявляемые при суточном мониторировании ЭКГ пароксизмальные нарушения ритма. В некоторых случаях при ЭхоКГ удается обнаружить пристеночные тромботические массы в полостях сердца или спонтанные эхо-контрастные тени. Аритмический криз является основной причиной кардиоэмболического инсульта. В некоторых случаях, при выраженных атеросклеротических изменениях артериальной системы мозга, возможен гемодинамический механизм церебральной ишемии.
Ангиодистонический криз обычно сопутствует вертеброгенным нарушениям сосудистого тонуса. Типичная иллюстрация – синдром позвоночной артерии. Для ангиодистонических кризов характерны эпизоды недостаточности кровообращения в вертебрально-базилярной системе. Проявлением ангиодистонического криза может служить приступ мигрени. Тяжелые формы мигрени предполагают возможность очаговых повреждений мозга (мигренозный инсульт). Вторичные ишемические повреждения головного мозга, возникающие при внутричерепных кровоизлияниях, являются следствием спазма внутримозговых артерий. Предикторы ангиодистонического криза выявляются при транскраниальной ультразвуковой допплерографии – асимметрия, увеличение линейной скорости в дистальных отрезках внутримозговых артерий. Ангиодистонический криз чаще приводит к преходящим нарушениям мозгового кровообращения, реже – к развитию гемодинамического ишемического инсульта с мелкоочаговыми повреждениями мозга [8].
Тяжелые формы мигрени предполагают возможность очаговых повреждений мозга (мигренозный инсульт). Вторичные ишемические повреждения головного мозга, возникающие при внутричерепных кровоизлияниях, являются следствием спазма внутримозговых артерий. Предикторы ангиодистонического криза выявляются при транскраниальной ультразвуковой допплерографии – асимметрия, увеличение линейной скорости в дистальных отрезках внутримозговых артерий. Ангиодистонический криз чаще приводит к преходящим нарушениям мозгового кровообращения, реже – к развитию гемодинамического ишемического инсульта с мелкоочаговыми повреждениями мозга [8].
Нейроэндокринный криз – всегда следствие гормональной дисфункции или нарушений нейрогенной регуляции. Нейроэндокринные кризы можно наблюдать у женщин в период климакса, у больных с тиреотоксикозом. Наиболее демонстративны проявления нейроэндокринного криза у больных с нейроэндокринными опухолями. В этом случае патофизиологической основой повреждения сердечно-сосудистой системы является массивный выброс в кровь катехоламинов, который кроме выраженных гемодинамических эффектов, приводит к повреждению миокарда и сосудистой стенки.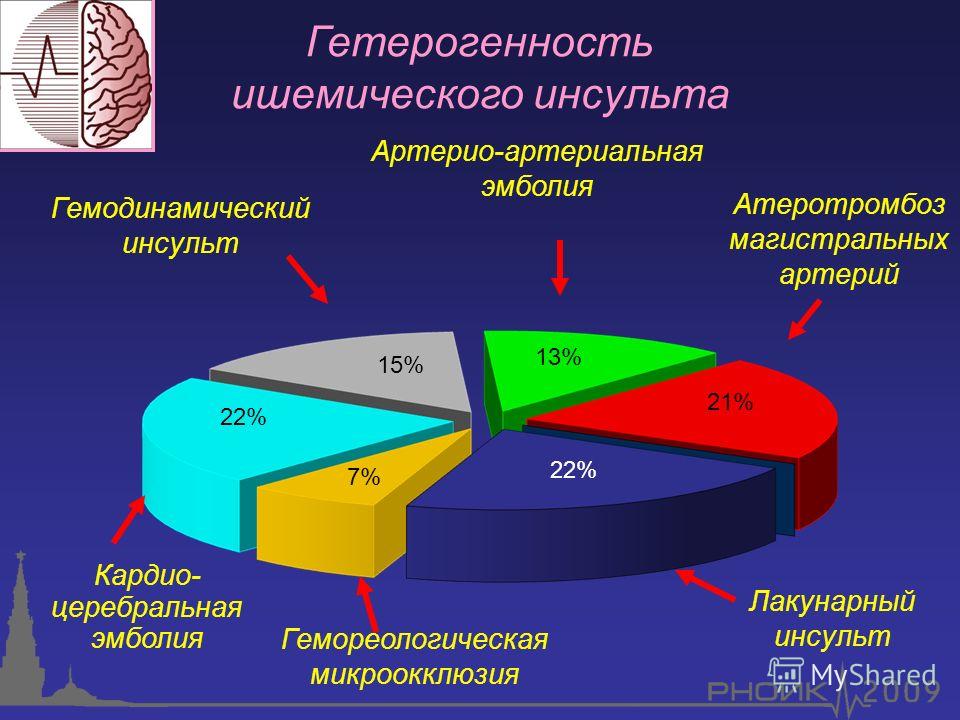 Не случайно феохромоцитома примерно в 20% случаев дебютирует ОНМК. Не только феохромоцитома, но и карциноиды, другие опухоли, могут стимулировать нейроэндокринные кризы. Предикторами нейроэндокринного криза являются, определяемые соответствующими лабораторными тестами, признаки, подтверждающие повышенное содержание в крови катехоламинов, гистамина, серотонина и продуктов их деградации. Нейроэндокринные кризы приводят к развитию гемодинамических и атеротромботических ишемических инсультов [7-9].
Не случайно феохромоцитома примерно в 20% случаев дебютирует ОНМК. Не только феохромоцитома, но и карциноиды, другие опухоли, могут стимулировать нейроэндокринные кризы. Предикторами нейроэндокринного криза являются, определяемые соответствующими лабораторными тестами, признаки, подтверждающие повышенное содержание в крови катехоламинов, гистамина, серотонина и продуктов их деградации. Нейроэндокринные кризы приводят к развитию гемодинамических и атеротромботических ишемических инсультов [7-9].
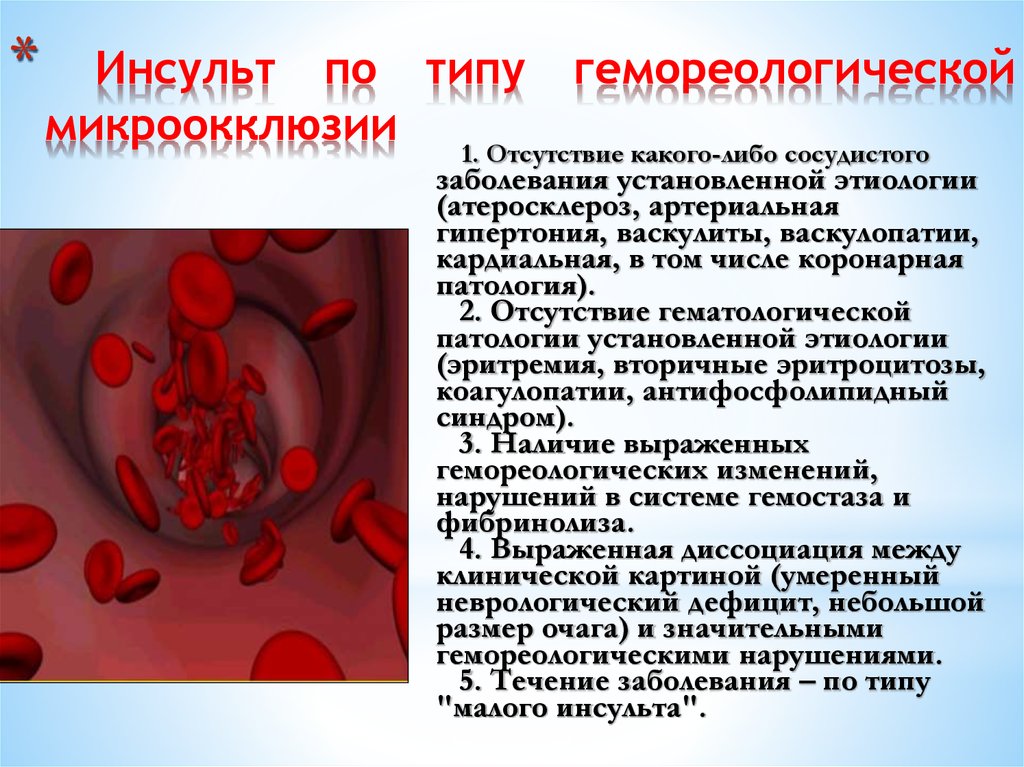
Гемореологический криз – одна из наиболее частых причин декомпенсации мозгового кровообращения. Гиперкоагуляция, гипервискозность крови служат основой для системных нарушений микроциркуляции. При определенных условиях (гипертермия, обезвоживание, интоксикация, стресс) системные расстройства регионального кровообращения могут привести к блокаде микроциркуляции. Микроциркуляторный блок создает условия для ишемии стандартных органов-мишеней: мозг, сердце, почки. Артериальная гипертония в таких случаях носит симптоматический характер и лишь увеличивает нагрузку на миокард. Гемореологический криз осложняется ОНМК по типу гемореологической микроокклюзии (гемореологический инсульт), гемодинамическим или атеротромботическим инсультом. Предикторами гемореологического криза могут служить результаты лабораторных исследований, свидетельствующие о гипергкоагуяции, снижении гемостатических резервов и высокой вязкости крови.
Гемореологический криз осложняется ОНМК по типу гемореологической микроокклюзии (гемореологический инсульт), гемодинамическим или атеротромботическим инсультом. Предикторами гемореологического криза могут служить результаты лабораторных исследований, свидетельствующие о гипергкоагуяции, снижении гемостатических резервов и высокой вязкости крови.
Обтурационный криз предполагает острую закупорку артерии среднего или крупного калибра тромбом или фрагментом распадающейся атеросклеротической бляшки. Расслаивание стенки артериального ствола так же может стать причиной обтурации. Закупорка крупной артерии обычно возникает в местах наиболее выраженных артеросклеротических изменений вследствие «активации» бляшек или тромботических осложнений. Предикторы обтурационного криза — рыхлые, гетерогенные бляшки, атеросклеротические стенозы и окклюзии брахиоцефальных артерий, обнаруживаемые при ультразвуковом сканировании или ангиографии. В результате обтурационного криза развиваются тяжелые крупноочаговые ишемические повреждения мозга, протекающие по типу атеротромботического инсульта.
Гемодинамические кризы и их связь с патогенетическими подтипами ишемического инсульта
Патофизиология различных вариантов гемодинамических кризов имеет много общего. Критическое повышение или снижение системного АД, коронарная недостаточность, аритмия с нарушениями внутрисердечной гемодинамики, микроциркуляторный блок или закупорка крупной артерии – приводят к возникновению комплекса патологических процессов, которые завершаются развитием инсульта [8,10]. Эксплозивное течение гемодинамического криза связано с феноменом взаимного отягощения, который характерен для декомпенсированных патологических процессов. Гиперкоагуляция и артериальная гипертония составляют ядро любого гемодинамического криза, выступая в качестве пускового и (или) поддерживающего механизма каскада взаимосвязанных нарушений системной и региональной гемодинамики и микроциркуляции. Несмотря на общность патофизиологии различных вариантов гемодинамических кризов, они ассоциируются с определенными подтипами ишемических инсультов. Целенаправленный анализ 200 наблюдений больных, госпитализированных в специализированный неврологический стационар, позволил провести необходимые сопоставления (Таблица 1).
Целенаправленный анализ 200 наблюдений больных, госпитализированных в специализированный неврологический стационар, позволил провести необходимые сопоставления (Таблица 1).
Таблица 1. Гемодинамические кризы и их связь с патогенетическими подтипами ишемического инсульта
| Гемодинамический криз | Связь с инсультом | Патогенетический подтип ишемического инсульта |
| Гипертонический | 30% | Лакунарный, гемодинамический |
| Аритмический | 24% | Кардиоэмболический, гемодинамический |
| Обтурационный | 16% | Атеротромботический |
| Гемореологический | 10% | Гемореологическая микроокклюзия, атеротромботический |
| Гипотонический | 8% | Гемодинамический |
| Ангиодистонический | 6% | Гемодинамический |
| Коронарный | 4% | Кардиоэмболический, гемодинамический |
| Нейроэндокринный | 2% | Лакунарный, атеротромботический, гемодинамический |
Необходимость клинической оценки гемодинамических кризов обусловлена тем важным обстоятельством, что кризы предшествуют ОНМК и определяют характер будущего инсульта. Результаты тщательного кардионеврологического обследования в большинстве случаев дают достаточные основания предполагать развитие того или иного варианта гемодинамического криза. [8,12]. Предполагая возможную причину ОНМК можно прогнозировать патогенетический подтип инсульта. Полученные сведения могут оказать существенное влияние на тактику ведения больного. Превентивное лечение становится эффективным, если оно с достаточной степенью надежности устраняет гемодинамические кризы – непосредственные причины ОНМК. Концепция гемодинамических кризов в превентивной кардионеврологии позволяет выработать оптимальные алгоритмы клинического, лабораторного и инструментального обследования больных и, в конечном счете, повысить эффективность индивидуальных профилактических программ.
Результаты тщательного кардионеврологического обследования в большинстве случаев дают достаточные основания предполагать развитие того или иного варианта гемодинамического криза. [8,12]. Предполагая возможную причину ОНМК можно прогнозировать патогенетический подтип инсульта. Полученные сведения могут оказать существенное влияние на тактику ведения больного. Превентивное лечение становится эффективным, если оно с достаточной степенью надежности устраняет гемодинамические кризы – непосредственные причины ОНМК. Концепция гемодинамических кризов в превентивной кардионеврологии позволяет выработать оптимальные алгоритмы клинического, лабораторного и инструментального обследования больных и, в конечном счете, повысить эффективность индивидуальных профилактических программ.
Литература
1. Артериальная гипертония и профилактика инсульта. (Краткое руководство для врачей под редакцией Верещагина Н.В. и Чазова Е.И). -М:, -1996. –31 с.
2. Бокарев И.Н. Атеросклероз – проблема современности. Тромбоз, гемостаз и реология. 2000; 1: 6-7.
Тромбоз, гемостаз и реология. 2000; 1: 6-7.
3. Верещагин Н.В. Гетерогенность инсульта: взгляд с позиций клинициста//Журнал неврологии и психиатрии им. С.С.Корсакова. 2003. 9: 8-9.
4. Виленский Б.С. Современная тактика борьбы с инсультом. –СПб.: ООО «Издательство ФОЛИАНТ», 2005. – 288 с.
5. Гогин Е.Е. Синдром артериальной гипертонии как признак дезадаптационных нарушений. Клин. Мед. 2002; 11: 4 – 7.
6. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М.: Медицина. 2000. –328 с.
7. Симоненко В.Б., Широков Е.А., Виленский Б.С. Профилактика инсульта: традиции и перспективы//Военно-мед. журн. 1999. 4: 31 — 34.
8. Симоненко В.Б., Широков Е.А. Превентиваня кардионеврология. –СПб: ООО «Издательство ФОЛИАНТ», 2008. – 224 с.
9. Суслина З.А., Гераскина Л.А., Фонякин А.В. Особенности антигипертензивной терапии при цереброваскулярных заболеваниях. Клиническая фармакология и терапия. 2002; 5: 83 – 87.
10. Широков Е.А., Симоненко В.Б. Современные представления о роли гемодинамических кризов в этиологии и патогенезе инсульта. Клиническая медицина. -2001. 8: 4 – 7.
Широков Е.А., Симоненко В.Б. Современные представления о роли гемодинамических кризов в этиологии и патогенезе инсульта. Клиническая медицина. -2001. 8: 4 – 7.
11. Фонякин А.В., Гераскина Л.А., Суслина З.А. Патогенетическая оценка нарушений ритма сердца и ишемии миокарда при гемодинамическом инсульте. Клин. Мед. –2002; 10: 17-20.
12. Фонякин А.В., Суслина З.А., Гераскина Л.А. Кардиологическая диагностика при ишемическом инсульте. –СПб.: ИНКАРТ, 2005. – 224 с.
Гемодинамические нарушения и риск инсульта: доказать это
Передовая редакционная статья
Колин П. Дердейн
Американский журнал нейрорадиологии, февраль 2001 г., 22 (2) 233-234;
- Статья
- Информация и показатели
- Ссылки
Miyazawa et al (стр. 243) в этом выпуске AJNR пациенты со средней артерио-окклюзией и бессимптомным течением при окклюзии внутренней сонной артерии (ВСА). Кроме того, они сообщают о связи между появлением новых ишемических поражений на МРТ-изображениях и наличием гемодинамических нарушений.
Клинические исследования гемодинамических факторов риска инсульта, такие как настоящее исследование, сложны по многим причинам. Многие физиологические, клинические и эпидемиологические проблемы остаются в значительной степени неясными. Существующие клинические методы гемодинамической оценки основаны на различных гемодинамических механизмах и косвенно основаны на предположениях (некоторые из них, вероятно, неточны) относительно лежащих в основе физиологических процессов. Патофизиологические механизмы, посредством которых тяжелые гемодинамические нарушения могут предрасполагать к ишемическому инсульту, неизвестны. Кроме того, связь между аномальным результатом большинства, но не всех, этих клинических методов и риском инсульта не доказана (1). Для каждого из доступных методов гемодинамической оценки требуется эмпирическое доказательство связи аномального гемодинамического ответа и риска будущего инсульта. В этой области еще предстоит собрать много важных данных, и это должно быть сделано тщательным образом. Наконец, после установления связи следующей задачей является доказательство того, что связь является причинно-следственной: т. е. исправление гемодинамической аномалии с помощью медицинского или механического вмешательства фиксирует риск инсульта. Пилотные данные Миядзавы и др., опубликованные в этом выпуске 9-го0020 AJNR следует интерпретировать с учетом этих соображений.
Наконец, после установления связи следующей задачей является доказательство того, что связь является причинно-следственной: т. е. исправление гемодинамической аномалии с помощью медицинского или механического вмешательства фиксирует риск инсульта. Пилотные данные Миядзавы и др., опубликованные в этом выпуске 9-го0020 AJNR следует интерпретировать с учетом этих соображений.
Когда артерия сильно сужается или полностью закупоривается, давление в сосуде за пределами поражения может падать. Артериальное давление в дистальном отделе кровообращения, питаемом этим сосудом, будет зависеть не только от степени сужения, но и от способности коллатеральных сосудов обеспечивать кровоток. Круг Уиллиса обеспечивает адекватный коллатеральный кровоток для многих пациентов с полной окклюзией общей или ВСА, например (2). Однако у некоторых пациентов эти коллатеральные каналы не поддерживают нормальное артериальное давление. Экспериментальные исследования, в основном на животных и с участием острой и тяжелой гипотензии, показали, что начальным рефлекторным ответом цереброваскулярной системы является ауторегуляторная вазодилатация мелких артериол (3). Это служит для поддержания нормального кровотока за счет снижения сосудистого сопротивления. При дальнейшем снижении давления способность ауторегуляции превышается, и кровоток пассивно падает в зависимости от давления. Симптомы ишемии не обязательно развиваются при таком снижении кровотока, так как мозг может увеличивать долю извлечения кислорода из крови (фракция извлечения кислорода) и поддерживать нормальный метаболизм кислорода и функцию мозга (4). Однако степень, в которой эти различные физиологические реакции на снижение перфузионного давления сохраняются у людей с хроническими заболеваниями, неизвестна.
Это служит для поддержания нормального кровотока за счет снижения сосудистого сопротивления. При дальнейшем снижении давления способность ауторегуляции превышается, и кровоток пассивно падает в зависимости от давления. Симптомы ишемии не обязательно развиваются при таком снижении кровотока, так как мозг может увеличивать долю извлечения кислорода из крови (фракция извлечения кислорода) и поддерживать нормальный метаболизм кислорода и функцию мозга (4). Однако степень, в которой эти различные физиологические реакции на снижение перфузионного давления сохраняются у людей с хроническими заболеваниями, неизвестна.
Кроме того, не установлен механизм, посредством которого тяжелое нарушение гемодинамики может привести к последующему ишемическому инфаркту. Одна из гипотез заключается в том, что наличие тяжелых гемодинамических нарушений может увеличить вероятность ишемического повреждения вследствие эмболии. Транскраниальные допплеровские исследования сообщают о частых клинически бессимптомных эмболических событиях у пациентов с атеросклеротическим заболеванием (5).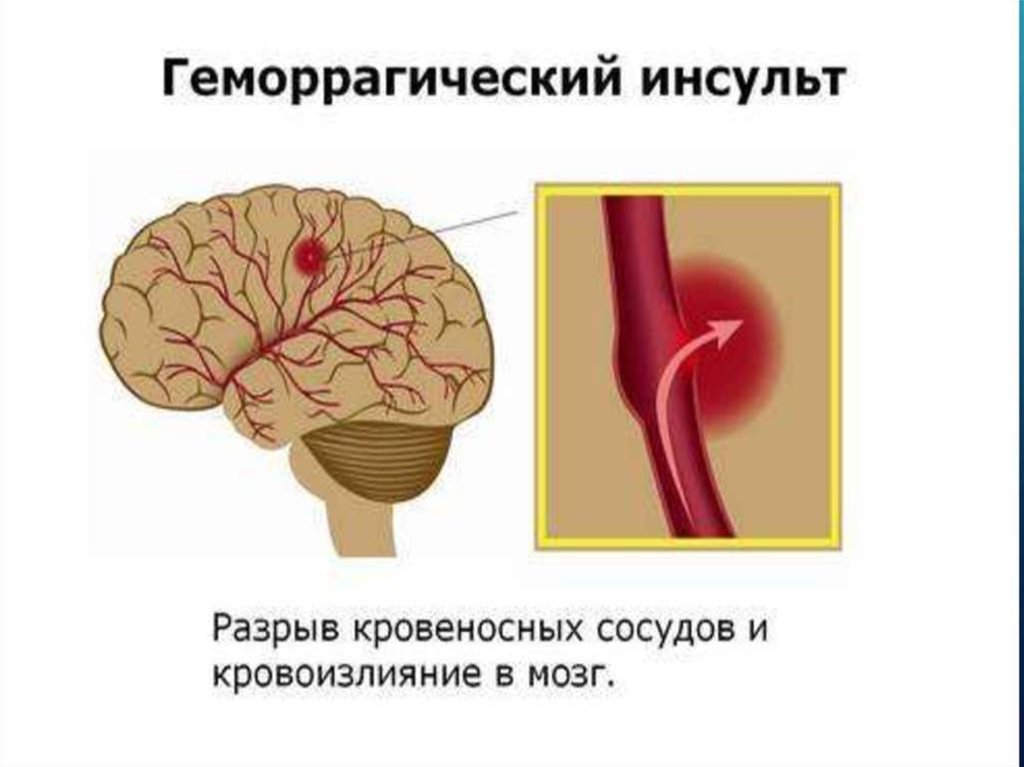 Эмбол, застрявший в сосуде, в котором артериальное давление и кровоток низкие, а экстракция тканей кислородом уже максимальна, с большей вероятностью может вызвать ишемическое повреждение. Эта гипотеза подтверждается исследованиями на животных с использованием микросферической модели эмболического инсульта в нормальных и коллатеральных полушариях (6).
Эмбол, застрявший в сосуде, в котором артериальное давление и кровоток низкие, а экстракция тканей кислородом уже максимальна, с большей вероятностью может вызвать ишемическое повреждение. Эта гипотеза подтверждается исследованиями на животных с использованием микросферической модели эмболического инсульта в нормальных и коллатеральных полушариях (6).
Определение нарушений гемодинамики у живых людей, как правило, производится на основе вывода с использованием одного из трех различных клинических подходов. Первые два теоретически проверяют наличие ауторегуляторной вазодилатации. В первом методе наличие ауторегуляторной вазодилатации предполагается, когда нормальный устойчивый ответ CBF или скорости кровотока на вазодилататорную нагрузку ослаблен или отсутствует. Метод парного потока использовался в исследовании Miyazawa et al., с количественными измерениями CBF, выполненными с помощью стабильного ксенона CT (Xe-CT) до и после введения ацетазоламида, мощного сосудорасширяющего средства. При втором подходе предполагается наличие ауторегуляторной вазодилатации, когда увеличиваются измерения среднего времени транзита или церебрального объема крови. Третий подход основан на измерении увеличения извлечения кислорода.
При втором подходе предполагается наличие ауторегуляторной вазодилатации, когда увеличиваются измерения среднего времени транзита или церебрального объема крови. Третий подход основан на измерении увеличения извлечения кислорода.
Корреляция между этими методами может быть очень плохой (1). Например, гемодинамические исследования пациентов с окклюзионным заболеванием сонных артерий, сравнивающие сосудорасширяющие эффекты ацетазоламида с гиперкапнией или физиологической активацией, выявили поразительные расхождения (7, 8). Kazumata и коллеги измерили увеличение CBF, связанное с гиперкапнией, у 10 из 11 пациентов, у которых отсутствовало повышение или парадоксальное снижение CBF после введения ацетазоламида (8). Расширение сосудов в ответ на ацетазоламид опосредуется механизмами, отличными от механизмов ауторегуляции (9).). Дополнительным мешающим фактором при использовании Xe-CT для измерения CBF является то, что ксенон сам по себе также является мощным сосудорасширяющим средством. Вместо аналогии со слепыми, которые ощупывают разные части слона и приходят к разным выводам о природе слона, в этой ситуации слепые могут чувствовать разных слонов.
Вместо аналогии со слепыми, которые ощупывают разные части слона и приходят к разным выводам о природе слона, в этой ситуации слепые могут чувствовать разных слонов.
Требуется эмпирическое доказательство связи между аномальным результатом каждого из этих тестов и риском последующего инсульта. Необходимо оценить исходные факторы риска инсульта, такие как артериальная гипертензия, курение и гиперлипидемия. Различия в риске инсульта, наблюдаемые между группами, могут быть связаны с различиями в этих факторах, а не с нарушениями гемодинамики. Следовательно, клинические исследования, призванные доказать такую связь, должны включать несколько из следующих факторов.
Во-первых, популяция пациентов должна быть четко определена и недвусмысленна с точки зрения наличия предшествующих ишемических симптомов и типа поражения артерий. Данные текущего и других исследований иллюстрируют необходимость этого требования. Риск инсульта у пациентов с бессимптомной окклюзией сонных артерий очень низок и, вероятно, связан с низкой частотой гемодинамических нарушений в этой популяции (10). И наоборот, частота гемодинамических нарушений у пациентов с окклюзией СМА, вероятно, довольно высока (11). Во-вторых, гемодинамический фактор риска должен быть определен проспективно (а не ретроспективное определение порога аномального теста, основанное на знании исхода пациента). В-третьих, сравнение групп высокого и низкого риска (определяется с помощью гемодинамического теста) и исхода (инсульт или новое ишемическое поражение, определяемое с помощью МРТ) должно быть статистически достоверным (анализ кривой выживаемости, а не тест хи-квадрат, для пример). Наконец, необходимо оценить независимость (многофакторный анализ по сравнению с другими факторами риска инсульта) и силу связи. На сегодняшний день наиболее вескими доказательствами в пользу оценки гемодинамики как предиктора риска инсульта является измерение увеличенной фракции извлечения кислорода с помощью позитронно-эмиссионной томографии у пациентов с окклюзией сонных артерий (1, 12).
И наоборот, частота гемодинамических нарушений у пациентов с окклюзией СМА, вероятно, довольно высока (11). Во-вторых, гемодинамический фактор риска должен быть определен проспективно (а не ретроспективное определение порога аномального теста, основанное на знании исхода пациента). В-третьих, сравнение групп высокого и низкого риска (определяется с помощью гемодинамического теста) и исхода (инсульт или новое ишемическое поражение, определяемое с помощью МРТ) должно быть статистически достоверным (анализ кривой выживаемости, а не тест хи-квадрат, для пример). Наконец, необходимо оценить независимость (многофакторный анализ по сравнению с другими факторами риска инсульта) и силу связи. На сегодняшний день наиболее вескими доказательствами в пользу оценки гемодинамики как предиктора риска инсульта является измерение увеличенной фракции извлечения кислорода с помощью позитронно-эмиссионной томографии у пациентов с окклюзией сонных артерий (1, 12).
В исследовании Miyazawa et al., опубликованном в этом выпуске AJNR, бессимптомный пациент с окклюзией СМА (n = 18) или окклюзией ВСА (n = 17) был выявлен с помощью МР-ангиографии во время МРТ-исследований 3965 пациентов с неишемическими неврологическими симптомами.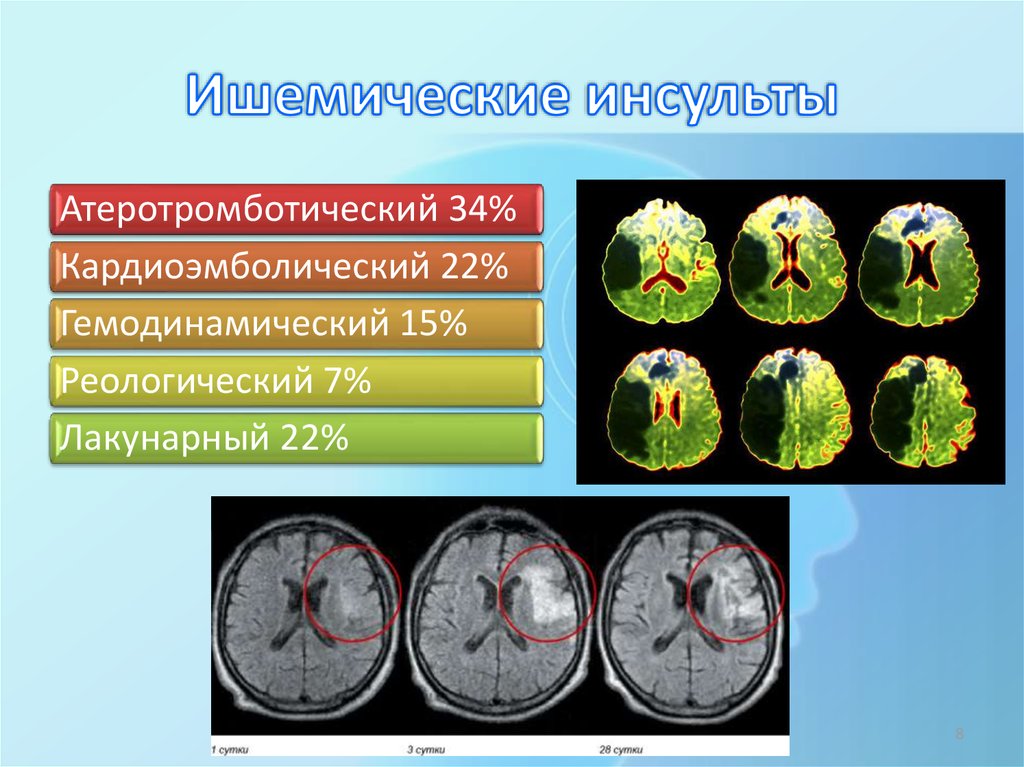 . Парные измерения CBF до и после введения актазоламида были выполнены с помощью Xe-CT. Время Xe-CT по отношению к включению в исследование не было указано, равно как и определение аномальной реакции кровотока (пороговый уровень, определяющий нормальный от аномального). Исходные клинические и эпидемиологические факторы риска инсульта не регистрировались и не анализировались. Всем больным выполнялась контрольная МРТ (в среднем 3,8 раза с неустановленными интервалами). Методика клинического наблюдения не описана.
. Парные измерения CBF до и после введения актазоламида были выполнены с помощью Xe-CT. Время Xe-CT по отношению к включению в исследование не было указано, равно как и определение аномальной реакции кровотока (пороговый уровень, определяющий нормальный от аномального). Исходные клинические и эпидемиологические факторы риска инсульта не регистрировались и не анализировались. Всем больным выполнялась контрольная МРТ (в среднем 3,8 раза с неустановленными интервалами). Методика клинического наблюдения не описана.
Хотя это и не является статистически значимым, клинические ишемические события, возникающие в течение периода наблюдения, чаще встречались у пациентов с окклюзией СМА (4 из 18 по сравнению с одним из 17 пациентов с окклюзией сонных артерий). Три из этих пяти ишемических событий были на территории исходного артериального поражения. Бессимптомный инфаркт был обнаружен у семи пациентов (пять с окклюзией СМА и два с окклюзией ВСА). Расположение бессимптомных поражений относительно артериальной окклюзии не сообщалось. Как группа, пациенты с новыми поражениями (как бессимптомными, так и симптоматическими) имели значительно более низкий ответ CBF на ацетазоламид, чем пациенты без новых поражений, проявляющихся при МРТ. Взаимосвязь между нарушением гемодинамики и появлением новых поражений у отдельных пациентов не изучалась.
Как группа, пациенты с новыми поражениями (как бессимптомными, так и симптоматическими) имели значительно более низкий ответ CBF на ацетазоламид, чем пациенты без новых поражений, проявляющихся при МРТ. Взаимосвязь между нарушением гемодинамики и появлением новых поражений у отдельных пациентов не изучалась.
Исследование Miyazawa et al. дает важные экспериментальные данные о прогнозе бессимптомной окклюзии СМА. Эти пациенты имели высокий риск развития клинического инсульта или бессимптомного инфаркта (50%). Возможно, что этот риск мог быть из-за высокой частоты гемодинамических нарушений. Необходимо хорошо спланированное проспективное исследование гемодинамических факторов и риска инсульта у этой популяции пациентов.
- ↵
Дердейн С.П., Грабб Р.Л., мл., Пауэрс В.Дж. Нарушение церебральной гемодинамики: методы измерения и связь с риском инсульта. Neurology 1999;53:251-259
- ↵
Gibbs JM, Wise RJS, Leendeers KL, Jones T.
 Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314
Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314 - ↵
Rapela CE, зеленый HD. Ауторегуляция мозгового кровотока у собак. Circ Res 1964;15:I205-I211
- ↵
Кети С.С., Кинг Б.Д., Хорват С.М., Джефферс В.А., Хафкеншил Д.Х. Влияние острого снижения артериального давления посредством дифференциальной спинальной симпатической блокады на мозговое кровообращение у больных гипертонической болезнью. J Clin Invest 1950;29:402-407
- ↵
Моллой Дж., Маркус Х.С. Бессимптомная эмболизация предсказывает риск инсульта и ТИА у пациентов со стенозом сонных артерий. Ход 1999;30:1440-1443
- ↵
Omae T, Li F, Fisher M. Бессимптомная гемодинамическая недостаточность усугубляет ишемическое повреждение в модели микроэмболического инсульта у крыс. Инсульт 2000;31:346
- ↵
Инао С.
 , Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967
, Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967 - ↵
Казумата К., Танака Н., Исикава Т., Курода С., Хоукин К., Мицумури К. Диссоциация вазореактивности на ацетазоламид и гиперкапния. Сравнительное исследование пациентов с хронической окклюзионной болезнью крупных мозговых артерий. Stroke 1996;27:2052-2058
- ↵
Demolis P, Florence G, Thomas L, Dinh YRT, Giudicelli J.-F, Seylaz J. расширение сосудов? Экспериментальное исследование. Ход 2000;31:508-515
- ↵
Powers WJ, Derdeyn CP, Yundt KD, Carpenter DA, Fritsch SM, Videen TO, Spitznagel EJ, Grubb RL, Jr. Доброкачественное течение бессимптомной окклюзии сонной артерии. Neurology 2000;54:878-882
- ↵
Derdeyn CP, Grubb RL, Jr, Powers WJ.
 Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469
Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469 Grubb RL, Jr, Derdeyn CP, Fritsch SM, et al. Значение гемодинамических факторов в прогнозе симптоматической окклюзии сонных артерий. JAMA 1998;280:1055-1060
ПредыдущийСледующий
Наверх
[PDF] Гемодинамический инсульт: клинические признаки, прогноз и лечение
Симптоматическая окклюзия внутренней сонной артерии: последствия нарушения гемодинамики
- S. Person
Медицина, биология
- 3 исследования в 6 1 8 10009 900 Диссертация была направлена на улучшение выявления пациентов с повышенным риском повторного ишемического инсульта на основе клинических характеристик и гемодинамических измерений с помощью транскраниальной допплерографии (ТКД) с СО2-реактивностью или позитронно-эмиссионной томографии (ПЭТ) кислорода-15.

Аварийный стентирование для острого симптоматического стеноза сонной артерии: рассеивать доказательства
- D. Werring, F. Robertson
Medicine
Практические неврологии
- 2015
Большинство неврологических. регулярно, однако его лечение остается сложной задачей: приемлемыми вариантами считаются антитромбоцитарные препараты или антикоагулянты.
Доказательства эффективности терапии, основанной на измерении церебральной гемодинамики, при симптоматическом поражении крупных церебральных артерий
- H. Yamauchi
Медицина, Психология
Neurologia Medico-Chirurgica
- 2015
Гипертония является основным фактором риска для инсульта, а антигипертентная терапия обеспечивает общую пользу для пациентов с симптомами с симптомами. однако польза строгого контроля артериального давления для снижения риска инсульта у пациентов с нарушением гемодинамики является предметом дискуссий.

Улучшение церебральной перфузии у пациентов с гемодинамическим инсультом после каротидного стентирования
- Taurus Laisari, A. F. Sani, Sita Setyowatie
Медицина, психология
Международный журнал медицинских наук
- 2022
Мужчина 49 лет жалуется на внезапную слабость правой половины тела после пробуждения, сопровождающееся головной болью и трудностями в общении, а по результатам КТ головы без контраста выявлен подострый мозговой ишемический инфаркт в корково-подкорковом отделе левой теменной доли.
Транскраниальная допплерография Реактивность CO2 не является предиктором повторного ишемического инсульта у пациентов с симптоматической окклюзией сонных артерий
- W. Jolink, R. Heinen, S. Persoon, A. van der Zwan, L. Kappelle, C. Klijn
Медицина
Цереброваскулярные заболевания
- 2013
У пациентов с ТИА или неинвалидизирующим инсультом, связанным с окклюзией сонной артерии, долгосрочный годовой риск инсульта, как правило, низкий при тщательном контроле сосудистых факторов риска.

Нарушение перфузии изменяет взаимосвязь между артериальным давлением и риском инсульта при поражении крупных церебральных артерий и психиатрия
- 2013
Нарушение перфузии изменило взаимосвязь между артериальным давлением и риском инсульта, хотя это исследование имело ограничения, включая ретроспективный анализ, потенциально необъективную выборку, небольшое количество критических событий и тот факт, что АД измеряли только как снимок в клинике.
Limb-shaking TIA: a case of cerebral hypoperfusion in severe cerebrovascular disease in a young adult
- T. Richardson, P. Beech, G. Cloud
Medicine
BMC Neurology
- 2021
A молодая женщина, у которой развилась ТИА с дрожанием конечностей, представлена в контексте прогрессирующего тяжелого внутричерепного атеросклеротического заболевания (ICAD), и подчеркивается важность визуализации церебральной перфузии для подтверждения диагноза, а также терапевтические возможности, доступные для облегчения симптомов и снижения риска инсульта.

 Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314
Оценка церебрального перфузионного резерва у пациентов с окклюзией сонных артерий. Lancet 1984;1:310-314  , Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967
, Тадокоро М., Нишино М., Мизутани Н., Терада К., Бундо М., Кучиваки Х., Йошида Дж. Нейронная активация головного мозга при гемодинамической недостаточности. J Cereb Blood Flow and Metab 1998;18:960-967  Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469
Гемодинамические и метаболические эффекты стеноза и окклюзии средней мозговой артерии. AJNR Am J Neuroradiol 1998;19:1463-1469