Чадс шкала: Оценка фибрилляции предсердий по шкале CHA(2)DS(2)-VASc для определения риска инсульта
Тромбоз левого предсердия и/или его ушка при неклапанной фибрилляции предсердий: эхокардиографические и лабораторные факторы риска, возможности прогнозирования и коррекции | Заиграев
1. January C.T., Wann L.S., Alpert J.S., Calkins H., Cigarroa J.E., Cleveland J.C. Jr. et aL 2014 AHA/ ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: executive summary: a report of the American College of Cardiology/ American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation. 2014;130(23):2071-2104. doi: 10.1161/CIR.0000000000000040.
2. Scherr D., Dalai D., ChiLukuri K., Dong J., Spragg D., Henrikson C.A. et aL. Incidence and predictors of Left atriaL thrombus prior to catheter abLation of atrial fibrillation 2009. J Cardiovasc Electrophysiol. 2009;20(4):379-384. doi: 10.1111/j.1540-8167.2008.01336.x.
3. Kirchhof P., Benussi S., Kotecha D., AhLsson A., Atar D., Casadei B. et aL. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37(38):2893-2962. doi: 10.1093/eurheartj/ehw210.
Eur Heart J. 2016;37(38):2893-2962. doi: 10.1093/eurheartj/ehw210.
4. Beigel R., Wunderlich N.C., Ho S.Y, Arsanjani R., Siegel R.J. The Left atrial appendage: anatomy, function, and noninvasive evaluation. JACC Cardiovasc Imaging. 2014;7(12):1251-1265. doi: 10.1016/j.jcmg.2014.08.009.
5. Frenkel D., D’Amato S.A., Markowitz S.M., Liu C.F., Thomas G., Ip J.E. et al. Prevalence ofleft atrial thrombus detection by transesophageal echocardiography a comparison of continuous non-vitamin K antagonist oral anticoagulant versus warfarin therapy in patients undergoing catheter ablation for atrial fibrillation. JACC Clin Electrophysiol. 2016;2(3):295-303. doi: 10.1016/j.jacep.2016.01.004.
6. Stoddard M.F., Singh P., Buddhadeb D., Longaker R. Left atrial thrombus predicts transient ischemic attack in patients with atrial fibrillation. Am Heart J. 2003;145(4):676-682. doi: 10.1067/mhj.2003.91.
7. Doukky R., KhandeLwaL A., Garcia-Sayan E. External vaHdation of a novel transthoracic echocardiographic tool in predictingLeft atrial appendage thrombus formation in patients with nonvalvular atrial fibriUation. п patients during anticoaguLation therapy — Warfarin vs. Direct Oral Anticoagulants. Circ J. 2017;81(5):645-651. doi: 10.1253/circj.CJ-16-1089.
п patients during anticoaguLation therapy — Warfarin vs. Direct Oral Anticoagulants. Circ J. 2017;81(5):645-651. doi: 10.1253/circj.CJ-16-1089.
9. Blustin J.M., McBane R.D., Mazur M., Ammash N., Sochor O., GriU D.E., Wysokinski W.E. The association between thromboembolic complications and blood group in patients with atrial fibriUation. Mayo Clin Proc. 2015;90(2):216-223. doi: 10.1016/j.mayocp.2014.11.013.
10. Заиграев И.А., Явелов И.С. Тромбоз левого предсердия и/или его ушка при неклапанной фибрилляции предсердий: частота выявления и клинические факторы риска. Атеротромбоз. 2019(2):68-79. doi: 10.21518/2307-1109-2019-2-68-79.
11. Jenkins P.V., O’Donnell J.S. ABO blood group determines plasma von Willebrand factorlev-els: a biologic function after all? Transfusion. 2006;46(10):1836-1844. doi: 10.1111/j.1537-2995.2006.00 975.x.
12. Guo Y., Lip G.Y.H., Apostolakis S. Inflammatory Biomarkers and Atrial Fibrillation: Potential Role of Inflammatory Pathways in the Pathogenesis of Atrial Fibrillation-induced Thromboembolism. Curr Vasc Pharmacol. 2015;13(2):192-201. doi: 10.2174/15701611113116660165.
Curr Vasc Pharmacol. 2015;13(2):192-201. doi: 10.2174/15701611113116660165.
13. Meus R., Son M., Sobczyk D. Prothrombotic state in patients with aleft atrial appendage thrombus of unknown origin and cerebrovascular events. Stroke. 2016;47(7):1872-1878. doi: 10.1161/STROKEAHA.116.012856.
14. Yuan Fu, Kuibao Li, Xinchun Yang. ABO blood groups: a risk factor forleft atrial andleft atrial appendage thrombogenic milieu in patients with non-valvular atrial fibrillation. Thromb Res. 2017;156:45-50. doi: 10.1016/j.thromres.2017.05.018.
15. Kaya A., Tukkan C., Alper A.T., Gungor B., Ozcan K.S., Tatlisu M.A. et al. Increasedlevels of red cell distribution width is correlated with presence ofleft atrial stasis in patients with non-valvular atrial fibrillation. North Clin Istanb. 2017;4(1):66-72. doi: 10.14744/nci.2017.72324.
16. Lappe J.M., Horne B.D., Shah S.H., May H.T., Muhlestein J.B., Lappe D.L. et al. Red cell distribution width, C-reactive protein, the complete blood count, and mortality in patients with coronary disease and a normal comparison population. Clin Chim Acta. 2011;412(23-24):2094-2099. doi: 10.1016/j.cca.2011.07.018.
Clin Chim Acta. 2011;412(23-24):2094-2099. doi: 10.1016/j.cca.2011.07.018.
17. Providencia R., Ferreira M.J., Gonsalves L., Paiva L., Fernandes A., Barra S. et al. Mean corpuscular volume and red cell distribution width as predictors of left atrial stasis in patients with non-valvular atrial fibrillation. Am J Cardiovasc Dis. 2013;3(2):91-102. Available at: https://europepmc.org/article/pmc/pmc3683407#abstract
18. Ulu S.M., Ozkeqeci G., Akci O., Ahsen A., Altug A., Demir K., Acarturk G. Mean platelet volume, in predicting severity of mitral regurgitation and left atrial appendage thrombosis. Blood Coagul Fibrinolysis. 2014;25(2):119-124. doi: 10.1097/MBC.0b013e328364c453.
19. Hong-ling Yang, Yong-Ping Lin, Yan Long, Qing-ling Ma, Cheng Zhou. Predicting cardioembolic stroke with the B-type natriuretic peptide test: a systematic review and meta-analysis. J Stroke Cerebrovasc Dis. 2014;23(7):1882—1889. doi: 10.1016/j.jstrokecere-brovasdis.2014.02.014.
20. Pant R., Patel M. , Garcia-Sayan E., Wassouf M., D’Silva O., Kehoe R.F., Doukky R. Impact of B-type natriuretic peptidelevel on the risk ofleft atrial appendage thrombus in patients with nonvalvular atrial fibrillation: a prospective study. Cardiovasc Ultrasound. 2015;14:4. doi: 10.1186/s12947-016-0047-6.
, Garcia-Sayan E., Wassouf M., D’Silva O., Kehoe R.F., Doukky R. Impact of B-type natriuretic peptidelevel on the risk ofleft atrial appendage thrombus in patients with nonvalvular atrial fibrillation: a prospective study. Cardiovasc Ultrasound. 2015;14:4. doi: 10.1186/s12947-016-0047-6.
21. Doukky R., Gage H., Nagarajan V., Demopoulos A., Cena M., Garcia-Sayan E. et al. B-type natriuretic peptide predictsleft atrial appendage thrombus in patients with nonvalvular atrial fibrillation. Echocardiography. 2013;30(8):889-895. doi: 10.1111/echo.12169.
22. Ochiumi Y., Kagawa E., Kato M., Sasaki S., Nakano Y., Itakura K. et al. Usefulness of brain natriuretic peptide for predictingleft atrial appendage thrombus in patients with unanticoagulated nonvalvular persistent atrial fibrillation. J Arrhythm. 2015;31:307-312. doi: 10.1016/j.joa.2015.04.002.
23. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American society of echocardiography and the European association of cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2016;17(4):412. doi: 10.1093/ehjci/jew041.
Eur Heart J Cardiovasc Imaging. 2016;17(4):412. doi: 10.1093/ehjci/jew041.
24. Mancia G., Fagard R., Narkiewicz K., Redan J., Zanchetti A., Bohm M. et al. 2013 Practice guidelines for the management of arterial hypertension of the European Society of Hypertension (ESH) and the European Society of Cardiology (ESC): ESH/ESC Task Force for the Management of Arterial Hypertension. J Hypertens. 2013;31(10):1925-1238. doi: 10.1097/HJH.0b013e328364ca4c.
25. Boyd A.C., McKay T., Nasibi S., Richards D.A.B., Thomas L. Left ventricular mass predictsleft atrial appendage thrombus in persistent atrial fibrillation. Eur Heart J Cardiovasc Imaging. 2013;14(3):269-275. doi: 10.1093/ehjci/jes153.
26. Faustino A., Providencia R., Barra S., Paiva L., Trigo J., Botelho A. et al. Which method ofleft atrium size quantification is the most accurate to recognize thromboembolic risk in patients with non-valvular atrial fibrillation? Cardiovasc Ultrasound. 2014;12:28. doi: 10.1186/1476-7120-12-28.
27. Ayirala S., Kumar S., O’Sullivan D.M., Silverman D.I. Echocardiographic predictors ofleft atrial appendage thrombus formation. J Am Soc Echocardiogr. 2011;24(5):499-505. doi: 10.1016/j.echo.2011.02.010.
28. Doukky R., Khandelwal A., Garcia-Sayan E., Gage H. External validation of a novel transthoracic echocar-diographic tool in predictingleft atrial appendage thrombus formation in patients with nonvalvular atrial fibrillation. Eur Heart J Cardiovasc Imaging. 2013;14(9):876-881. doi: 10.1093/ehjci/jes313.
29. Doukky R., Garcia-Sayan E., Gage H., Nagarajan V., Demopoulos A., Cena M. et al. The value of diastolic function parameters in the prediction ofleft atrial appendage thrombus in patients with nonvalvular atrial fibrillation. Cardiovasc Ultrasound. 2014;12:10. doi: 10.1186/1476-7120-12-10.
30. Garcia-Sayan E.D., Patel M., Wassouf M., Pant R., D’Silva O.J., Kehoe R.F., Doukky R. Derivation and validation of E/e ratio as a parameter in the evalu-ation ofleft atrial appendage thrombus formation in patients with nonvalvular atrial fibrillation. Int J Cardiovasc Imaging. 2016;32(9):1349-1356. doi: 10.1007/s10554-016-0916-y.
Int J Cardiovasc Imaging. 2016;32(9):1349-1356. doi: 10.1007/s10554-016-0916-y.
31. Doukky R., Garcia-Sayan E., Patel M., Pant R., Wassouf M., Shah S. et al. Impact of diastolic function parameters on the risk forleft atrial appendage thrombus in patients with nonvalvular atrial fibril-lation: a prospective study. J Am Soc Echocardiogr. 2016;29(6):545-553. doi: 10.1016/j.echo.2016.01.014.
32. Sasaki S., Watanabe T., Tamura H., Nishiyama S., Wanezaki M., Sato C. et al. Left atrial strain as evalu-ated by two-dimensional speckle tracking predicts left atrial appendage dysfunction in patients with acute ischemic stroke. BBA Clin. 2014;2:40-47. doi: 10.1016/j.bbacli.2014.09.004.
33. Wang Y., Li M., Zhong L., Ren S., Li H., Tang Y. et al. Left Atrial Strain as Evaluated by Two-Dimensional Speckle Tracking Predicts Left Atrial Appendage Dysfunction in Chinese Patients with Atrial Fibrillation. Cardiology Research and Practice, 2020;2020:1-8. doi: 10.1155/2020/5867617.
34. Piccini J.P., Sievert H., Patel M.R. Left atrial appendage occlusion: rationale, evidence, devices, and patient selection. Eur Heart J. 2017. 21;38(12):869-876. doi: 10.1093/eurheartj/ehw330.
Piccini J.P., Sievert H., Patel M.R. Left atrial appendage occlusion: rationale, evidence, devices, and patient selection. Eur Heart J. 2017. 21;38(12):869-876. doi: 10.1093/eurheartj/ehw330.
35. Tan N.Y., Yasin O.Z., Sugrue A., Sabbagh A.E., Foley T.A., Asirvatham S.J. Anatomy and Physiologic Roles of the Left Atrial Appendage: Implications for Endocardial and Epicardial Device Closure. Interv Cardiol Clin. 2018;7(2):185-199. doi: 10.1016/j.iccl.2017.12.001.
36. Tilz R.R., Potpara T., Chen J., Dobreanu D., Larsen T.B., Haugaa K.H., Dagres N. Left atrial appendage occlude implantation in Europe: indications and anticoagulation post-implantation. Results of the European Heart Rhythm Association Survey. Europace. 2017;19(10):1737-1742. doi: 10.1093/euro-pace/eux254.
37. Beigel R., Wunderlich N.C., Ho S.Y., Arsanjani R., Siegel R.J. Theleft atrial appendage: anatomy, function, and noninvasive evaluation. JACC Cardiovasc Imaging. 2014;7(12):1251-1265. doi: 10.1016/j.jcmg. 2014.08.009.
2014.08.009.
38. Di Biase L., Santangeli P., Anselmino M., Mohanty P., Salvetti I., Gili S. et al. Does theleft atrial appendage morphology correlate with the risk of stroke in patients with atrial fibrillation? Results from a multicenter study. J Am Coll Cardiol. 2012;60(6):531-538. doi: 10.1016/j.jacc.2012.04.032.
39. Khurram I.M., Dewire J., Mager M., Maqboo F., Zimmerman S.L., Zipunnikov Z. et al. Relationship betweenleft atrial appendage morphology and stroke in patients with atrial fibrillation. Heart Rhythm. 2013;10(12):1843-1849. doi: 10.1016/j.hrthm.2013.09.065.
40. He J., Fu Z., Yang L., Liu W., Tian Y., Liu Q. et al. The predictive value of a concise classification ofleft atrial appendage morphology to thrombosis in non-valvular atrial fibrillation patients. Clin Cardiol. 2020. doi: 10.1002/clc.23381.
41. Wang F., Zhu M., Wang X., Zhang W., Su Y., Lu Y. et al. Predictive value ofleft atrial appendagelobes on left atrial thrombus or spontaneous echo contrast in patients with non-valvular atrial fibrillation.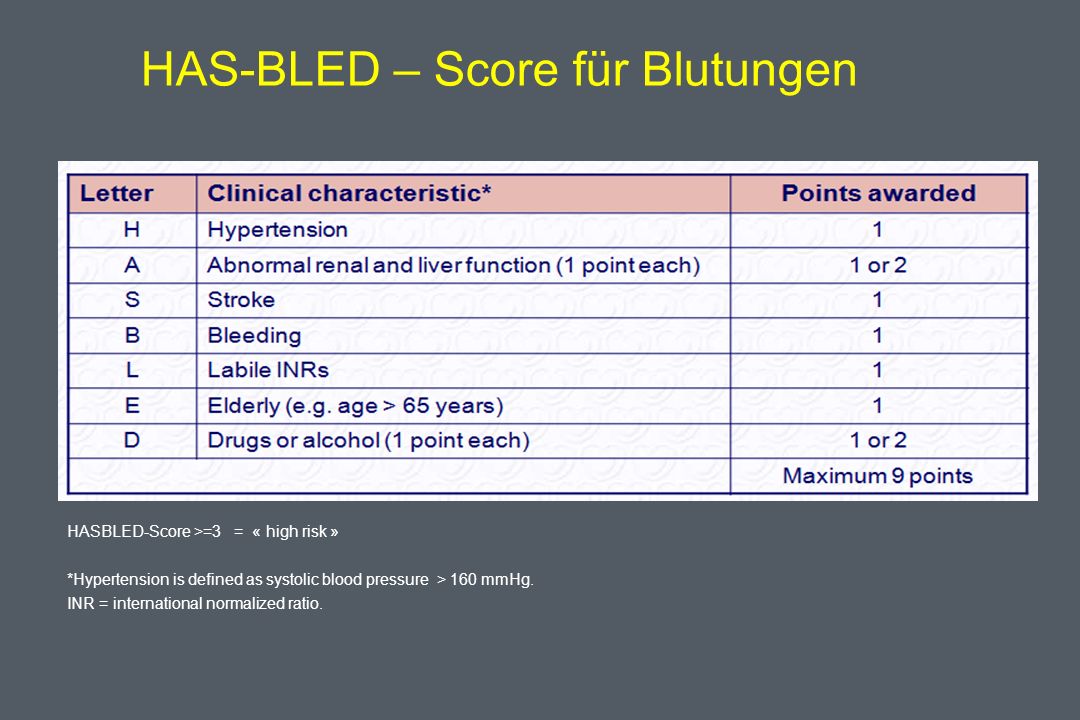 BMC Cardiovasc Disord. 2018;18(1):153. doi: 10.1186/s12872-018-0889-y.
BMC Cardiovasc Disord. 2018;18(1):153. doi: 10.1186/s12872-018-0889-y.
42. Wang Y., Di Biase L., Horton R.P., Nguyen T., Morhanty P., Morhanty P., Natale A. Left Atrial Appendage Studied by Computed Tomography to Help Planning for Appendage Closure Device Placement Journal of Cardiovascular Electrophysiology. 2010;21(9):973-982. doi: 10.1111/j.1540-8167.2010.01814.x.
43. Breitenstein A., Glanzmann M., Falk V., Maisano F., StampfH S.F., Holy E.W. et al. Increased prothrombotic profile in theleft atrial appendage of atrial fibrillation patients. Int J Cardiol. 2015;185:250-255. doi: 10.1016/j.ijcard.2015.03.092.
44. Herrmann M., Whiting M.J., Veillard A.S., Ehnholm C., Sullivan D.R., Keech A.C. Plasma homocysteine and the risk of venous thromboembolism: insights from the FIELD study. Clin Chem Lab Med. 2012;50(12):2213-2219. doi: 10.1515/cclm-2012-0078.
45. Yan Yao, Mei-Sheng Shang, Li-Jian Gao, Jing-Hua Zhao, Xiao-Hui Yang, Tong Liu et al. Elevated homocysteine increases the risk ofleft atrial/left atrial appendage thrombus in non-vaivuiar atrial fibrillation withlow CHA2DS2-VASc score. Europace. 2018;20(7):1093-1098. doi: 10.1093/europace/eux189.
Europace. 2018;20(7):1093-1098. doi: 10.1093/europace/eux189.
46. Cengel A., Sahinarslan A., Biberoglu G., Hasanoglu A., Tavil Y., Tulmag M., Ozdemir M. Asymmetrical dimethy-largininelevel in atrial fibrillation. Acta Cardiol. 2008;63(1):33-37. doi: 10.2143/ac.63.1.2025329.
47. Chao T.F., Lu T.M., Lin Y.J., Tsao H.-M., Chang S.-L., Lo L.-W. et al. Plasma asymmetric dimethylarginine and adverse events in patients with atrial fibrillation referred for coronary angiogram. PLoS One. 2013;8(8):e71675. doi: 10.1371/journal.pone.0071675.
48. Wei Xia, Yan Wang, Tongqing Duan, Yuanyuan Rong, Yifan Chi, Yibing Shao. Asymmetric dimethylarginine predictsleft atrial appendage thrombus in patients with non-valvular atrial fibrillation. Thromb Res. 2015;136(6):1156-1159. doi: 10.1016/j.thromres.2015.10.021.
49. Ri-Bo Tang, Jian-Zeng Dong, Xian-Liang Yan, Xin Du, Jun-Ping Kang, Jia-Hui Wu et al. Serum uric acid and risk ofleft atrial thrombus in patients with nonvalvular atrial fibrillation. Can J Cardiol. 2014;30(11):1415-1421. doi: 10.1016/j.cjca.2014.06.009.
Can J Cardiol. 2014;30(11):1415-1421. doi: 10.1016/j.cjca.2014.06.009.
50. Liu F.Z., Liao H.T., Lin W.D., Xue Y.-M., ZhanX.-Z., Fang X.-H. et al. Predictive effect of hyperuricemia onleft atrial stasis in non-valvular atrial fibrillation patients. Int J Cardiol. 2018;258:103-108. doi: 10.1016/j.ijcard.2018.01.080.
51. Ning W., Li Y., Ma C., Qiu L., Yu B. The Refinement of Risk Stratification for Atrial Thrombus or Spontaneous Echo Contrast in Nonvalvular Atrial Fibrillation. Int Heart J. 2017;58(6):885-893. doi: 10.1536/ihj.16-444.
52. Somloi M., Tomcsanyi J., Nagy E., Bodo I., Bexxegh A. D-dimer determination as a screening tool to exclude atrial thrombi in atrial fibrillation. The American Journal of Cardiology. 2003;92(1):85-87. doi: 10.1016/s0002-9149(03)00476-4.
53. Sugiura S., Fujii E., Senga M., Sugiura E., Nakamura M., Ito M. Clinical features of patients withleft atrial thrombus undergoing anticoagulant therapy. J Interv Card Electrophysiol. 2012;34(1):59- 63. doi: 10.1007/s10840-011-9633-6.
doi: 10.1007/s10840-011-9633-6.
54. Pfluecke C., Tarnowski D., Plichta L., Berndt K., Schumacher P., Ulbrich S. et al. Monocyte-platelet aggregates and CD11b expression as markers for thrombogenicity in atrial fibrillation. Clin Res Cardiol. 2016. 105(4):314-322. doi: 10.1007/s00392-015-0922-4.
55. YuYang Chen, Qi Liu, Li Liu, Shu Xiao-Rong, Su Zi-Zhuo, Zhang Hai-Feng et al. Effect of metabolic syndrome on risk stratification forleft atrial orleft atrial appendage thrombus formation in patients with nonvalvular atrial fibrillation. Chin Med J (Engl). 2016;129(20):2395-2402. doi: 10.4103/0366-6999.191744.
56. Sikorska A., Baran J., Pilichowska-Paszkiet E., Sikora-Frgc M., Krynski T., Piotrowskiet R. et al. Risk ofleft atrial appendage thrombus in patients scheduled for ablation for atrial fibrillation: beyond the CHA2DS2VASc score. Pol Arch Inter Med. 2015;125(12):921-928. doi: 10.20452/pamw.3213.
57. Kapton-Cieslicka A., Budnik M., Gawatko M., Peller M., Gorczyca I. , Michalska A. et al. Atrial fibrillation type and renal dysfunction as important predictors of left atrial thrombus. Heart. 2019;105(17):1310-1315. doi: 10.1136/heartjnl-2018-314492.
, Michalska A. et al. Atrial fibrillation type and renal dysfunction as important predictors of left atrial thrombus. Heart. 2019;105(17):1310-1315. doi: 10.1136/heartjnl-2018-314492.
58. Nishikii-Tachibana M., Murakoshi N., Seo Y., Xu D., Yamamoto M., Ishizu T. et al. Prevalence and Clinical Determinants of Left Atrial Appendage Thrombus in Patients with Atrial Fibrillation Prior to Pulmonary Vein Isolation. Am J Cardiol. 2015;116(9):1368-1373. doi: 10.1016/j.amjcard.2015.07.055.
59. Saeed M., Rahman A., Afzal A., Agoston I., Jammula P., Birnbaum Y. et al. Role of transesophageal echocardiography guided cardioversion in patients with atrial fibrillatio, previousleft atrial thrombus and effective anticoagulation. Int J Cardiol. 2006;113(3):401-405. doi: 10.1016/j.ijcard.2006.03.036.
60. Strach K., Meyer C., Hackenbroch M., Tiemann K., Haase J., Pizulli L. et al. Long-term fate ofleft atrial thrombi and incidence of cerebral embolism under continuous anticoagulation therapy.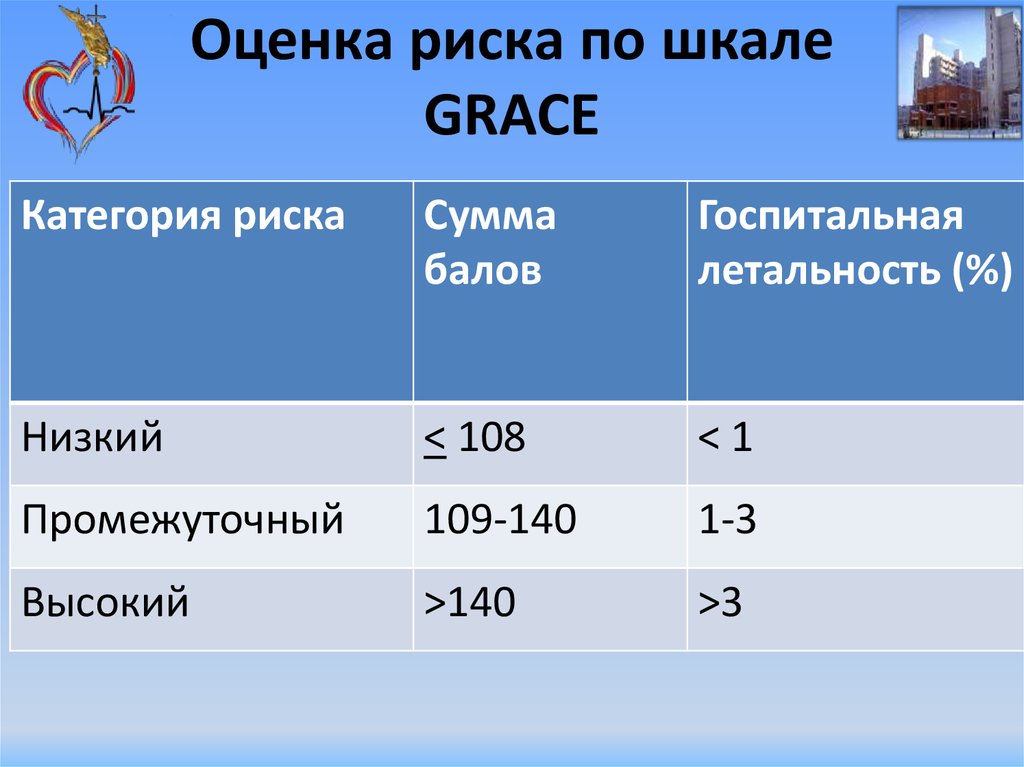 Rofo. 2005;177(12):1706-1712. (In Germ.) doi: 10.1055/s-2005-858787.
Rofo. 2005;177(12):1706-1712. (In Germ.) doi: 10.1055/s-2005-858787.
61. Bernhardt P., Schmidt H., Hammerstingl C., Hackenbroch M., Sommer T., Luderitz B., Omran H. Fate ofleft atrial thrombi in patients with atrial fibrillation determined by transesophageal echocardiography and cerebral magnetic resonance Imaging. Am J Cardiol. 2004;94(6):801-804. doi: 10.1016/j.amjcard.2004.06.010.
62. Bernhardt P., Schmidt H., Hammerstingl C., Luderitz B., Omran H. Atrial Thrombi — A Prospective Follow-up Study over 3 Years with Transesophageal Echocardiography and Cranial Magnetic Resonance Imaging. Echocardiography. 2006;23(5):388-394. doi: 10.1111/j.1540-8175.2006.00225.x.
63. Lip G.Y.H., Hammerstingl C., Marin F., Cappato R., Ling Meng I., Kirsch B. et al. Left atrial thrombus resolution in atrial fibrillation or flutter: results of a prospective study with rivaroxaban (X-TRA) and a retrospective observational registry providing baseline data (CLOT-AF). Am Heart J. 2016;178:126-134. doi: 10.1016/j.ahj.2016.05.007.
doi: 10.1016/j.ahj.2016.05.007.
64. Ferner M., Wachtlin D., Konrad T., Deuster O., Meinertz T., von Bardeleben S. et al. Rationale and design of the RE-LATED AF — AFNET 7 trial: REsolution of Left atrial-Appendage Thrombus — Effects of Dabigatran in patients with Atrial Fibrillation. Clin Res Cardiol. 2016;105(1):29-36. doi: 10.1007/s00392-015-0883-7.
65. Hussain A., Katz W.E., Genuardi M.V., Bhonsale A., Jain S.K., Kancharla K. et al. Non-vitamin K oral anticoagulants versus warfarin forleft atrial appendage thrombus resolution in nonvalvular atrial fibrillation or flutter. Pacing Clin Electrophysiol. 2019;42(9):1183-1190. doi: 10.1111/pace.13765.
66. Niku A.D., Shiota T., Siegel R.J., Rader F. Prevalence and Resolution of Left Atrial Thrombus in Patients With Nonvalvular Atrial Fibrillation and Flutter With Oral Anticoagulation. Am J Cardiol. 2019;123(1):63-68. doi: 10.1016/j.amjcard.2018.09.027.
67. Farkowski M.M., Jubele K., Marin F., Gandjbakhch E., Ptaszynski P.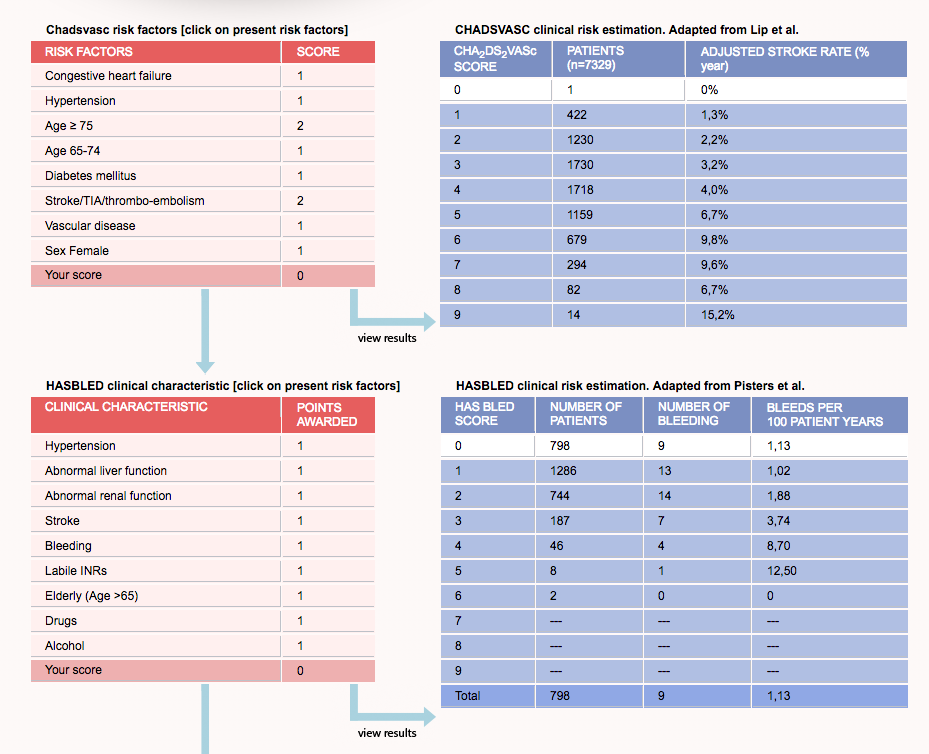 , Merino J.L. et al. Diagnosis and management ofleft atrial appendage thrombus in patients with atrialfibrillation undergoing cardioversion or percutaneousleft atrial procedures: results of the European Heart Rhythm Association survey. EP Europace. 2020;22(1):162-169. doi: 10.1093/euro-pace/euz257.
, Merino J.L. et al. Diagnosis and management ofleft atrial appendage thrombus in patients with atrialfibrillation undergoing cardioversion or percutaneousleft atrial procedures: results of the European Heart Rhythm Association survey. EP Europace. 2020;22(1):162-169. doi: 10.1093/euro-pace/euz257.
Профилактика тромбоэмболических осложнений у пациентов с фибрилляцией предсердий: международные и российские рекомендации и их реализация в реальной к | #05/13
Проведенные ранее исследования показали, что фибрилляцией предсердий (ФП) страдает 2 млн человек в Америке и около 4 млн в Европе [1, 2]. ФП чаще встречается у пожилых пациентов [1], ожидается, что ФП будет еще большей проблемой, учитывая все больше стареющее население.
Пациенты с ФП имеют в 5 раз больший риск возникновения инсульта в сравнении с другими идентифицированными факторами риска инсульта (артериальная гипертензия (АГ), сердечная недостаточность (СН), ишемическая болезнь сердца) [3]. Частота инсульта у пациентов с ФП широко варьирует от 1% до 20% ежегодно (в среднем 4,5% в год) в зависимости от сопутствующей патологии и предшествующих цереброваскулярных событий [4]. Антитромботическая терапия стала установленным методом профилактики инсульта у пациентов с ФП. Назначение антагонистов витамина К (АВК) — это всегда баланс между увеличивающимся риском кровотечения от 1% до 12% в год и снижением риска ишемических событий, в связи с чем препарат рекомендовался для лиц с высоким риском тромбоэмболических событий [4]. В новых рекомендациях [5] снижен порог тромбоэмболического риска для начала антикоагулянтной терапии у пациентов с ФП. В статье рассматриваются различные схемы стратификации риска тромбоэмболических осложнений (ТЭО) и геморрагических осложнений у пациентов с ФП, а также их выполнение и качество антитромботической терапии на амбулаторном этапе.
Антитромботическая терапия стала установленным методом профилактики инсульта у пациентов с ФП. Назначение антагонистов витамина К (АВК) — это всегда баланс между увеличивающимся риском кровотечения от 1% до 12% в год и снижением риска ишемических событий, в связи с чем препарат рекомендовался для лиц с высоким риском тромбоэмболических событий [4]. В новых рекомендациях [5] снижен порог тромбоэмболического риска для начала антикоагулянтной терапии у пациентов с ФП. В статье рассматриваются различные схемы стратификации риска тромбоэмболических осложнений (ТЭО) и геморрагических осложнений у пациентов с ФП, а также их выполнение и качество антитромботической терапии на амбулаторном этапе.
Целью настоящего исследования явилась оценка реализации международных и российских рекомендаций, а также оценка качества антикоагулянтной терапии у пациентов с ФП на амбулаторном этапе.
Материалы и методы исследования
Проведен ретроспективный анализ амбулаторных карт и историй болезни 304 пациентов с ФП, проходивших лечение в ФГБУЗ СМКЦ им.
Результаты и их обсуждение
В исследование было включено 304 пациента: 205 мужчин (67,4%) и 99 женщин (32,6%). Средний возраст женщин был 72 ± 9 лет, мужчин — 66 ± 10 лет (р < 0,001). Среди обследованных пациентов пароксизмальную форму ФП имели 39 (12,8%) пациентов, персистирующую — 121 (39,8%), постоянную — 144 (47,4%).
Средний возраст женщин был 72 ± 9 лет, мужчин — 66 ± 10 лет (р < 0,001). Среди обследованных пациентов пароксизмальную форму ФП имели 39 (12,8%) пациентов, персистирующую — 121 (39,8%), постоянную — 144 (47,4%).
Наиболее распространенными факторами риска тромбоэмболических осложнений (ТЭО) были гипертоническая болезнь — 90,1% и ишемическая болезнь сердца — 75,7%. Инфаркт миокарда в анамнезе имели 23% пациентов, перенесенный инсульт, транзиторную ишемическую атаку (ТИА) или системную тромбоэмболию — 19,1%, сахарный диабет — 13,5%, сердечную недостаточность (фракция выброса 40% и менее) — 4,3%. У 54 (17,8%) пациентов была проведена чреспищеводная эхокардиография (ЧП ЭХОКГ). В 42,6% случаев выявлены тромбы в ушке левого предсердия, эффект спонтанного контрастирования также в 42,6% случаях.
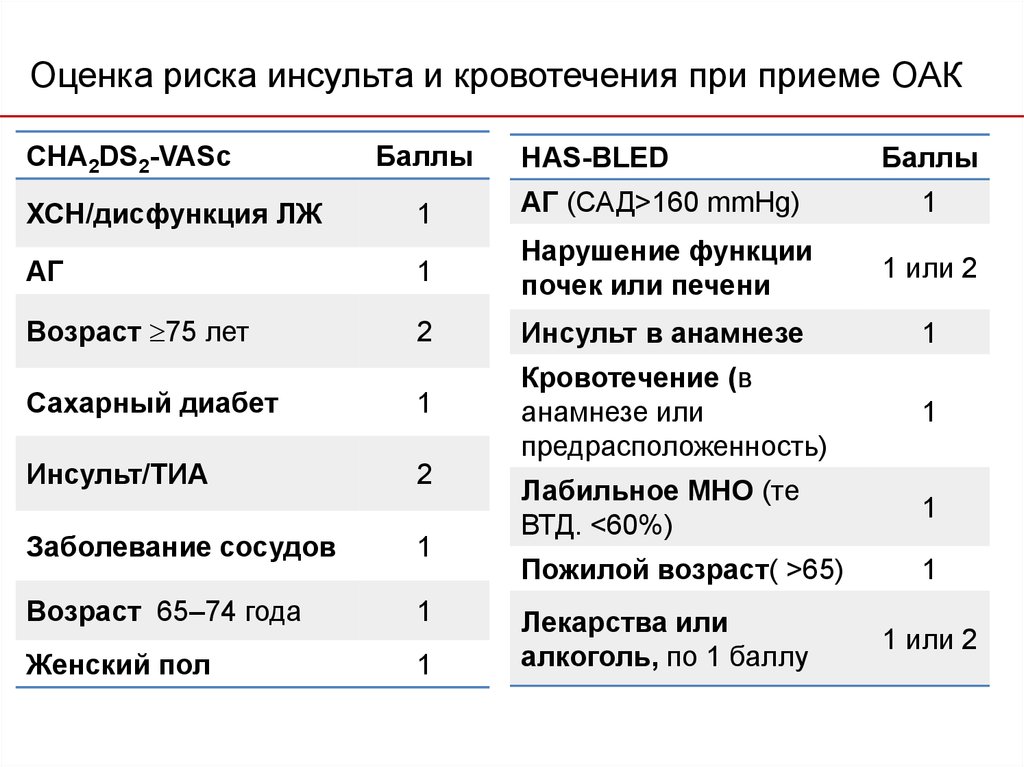
Множество схем стратификации риска было разработано с целью определения риска инсульта у пациентов с ФП (низкий, умеренный или высокий) и управления им [2, 7]. Среди наиболее известных шкала CHADS2, где баллы соответствуют присутствию известных факторов риска: СН, АГ, возраст ≥ 75 лет, сахарный диабет (один балл), предшествующий инсульт или ТИА (два балла), отражая их большую ассоциацию риска [6].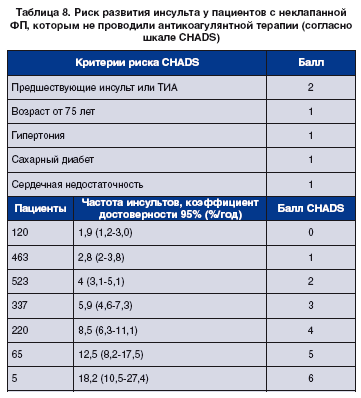 Анализ 12 опубликованных схем стратификации риска на репрезентативной выборке 1000 пациентов с ФП показал, что пропорция пациентов, классифицируемых в группу низкого риска, варьирует от 7% до 42%, в зависимости от использованной схемы стратификации риска [6]. В аналогичном анализе, выполненном G. Y. Lip и соавт. [8] (n = 1084), было показано, что процент пациентов, отнесенных в группу низкого риска, колеблется от 9% до 48% при использовании различных схем. Важно отметить, что, применяя схему Birmingham 2009, которая является адаптацией CHADS
Анализ 12 опубликованных схем стратификации риска на репрезентативной выборке 1000 пациентов с ФП показал, что пропорция пациентов, классифицируемых в группу низкого риска, варьирует от 7% до 42%, в зависимости от использованной схемы стратификации риска [6]. В аналогичном анализе, выполненном G. Y. Lip и соавт. [8] (n = 1084), было показано, что процент пациентов, отнесенных в группу низкого риска, колеблется от 9% до 48% при использовании различных схем. Важно отметить, что, применяя схему Birmingham 2009, которая является адаптацией CHADS
В нашем исследовании в соответствии с критериями риска по шкале CHADS2 в группе высокого риска тромбоэмболических осложнений находились 54 (17,8%) человека, среднего — 229 (75,3%) человек, низкого — 21 (6,9%) человек, в то же время при стратификации риска с использованием шкалы CHA ). Таким образом, при использовании шкалы CHADS2 наибольшая пропорция пациентов была в группе среднего риска, а при использовании шкалы CHA2DS2-VASc в группе высокого риска. Подобные результаты были получены в исследовании при сравнении классической CHADS2 и Birmingham 2009 (CHA2DS2-VASc) шкал [8].
). Таким образом, при использовании шкалы CHADS2 наибольшая пропорция пациентов была в группе среднего риска, а при использовании шкалы CHA2DS2-VASc в группе высокого риска. Подобные результаты были получены в исследовании при сравнении классической CHADS2 и Birmingham 2009 (CHA2DS2-VASc) шкал [8].
До недавнего времени оральные антикоагулянты, такие как варфарин, были единственно одобренными оральными антикоагулянтами для профилактики инсульта у больных с ФП. В 2007 г. R. G. Hart и соавт. [12] опубликовали данные метаанализа 29 рандомизированных клинических исследований, оценивших эффективность и безопасность антитромботических препаратов (включая АВК) у пациентов с неклапанной ФП. Обзор 6 исследований [12], которые сравнивали АВК с плацебо или контрольной группой, показал, что урегулированные дозы варфарина снижают относительный риск (ОР) инсульта на 64% (95% ДИ 49–74) в сравнении с плацебо или контролем (53 события на 2396 человеко-лет в сравнении с 133 событиями на 2207 человеко-лет).
С учетом европейских и национальных рекомендаций [5, 13] показания к назначению АВК в нашем исследовании были у 292 (96%), в то же время назначены они были лишь в 112 (38,4%) случаях. Причины, по которым не была назначена терапия антикоагулянтами, были: отказ от приема варфарина пациентами — 16 (5,5%) человек; невозможность контроля МНО на амбулаторном этапе — 20 (6,8%) человек; когнитивные нарушения, мнестико-интеллектуальное снижение, энцефалопатия — 12 (4,1%) человек; высокий риск кровотечения — 12 (4,1%) человек; злоупотребление алкоголем — 2 (0,7%) человека. В остальных случаях причина не была указана. По данным разных авторов частота применения варфарина колеблется от 17% до 57% [14–19]. Наиболее частыми причинами, по которым антикоагулянтная терапия не назначается, являются пожилой возраст пациентов, высокий риск травматизма, деменция, желудочно-кишечное кровотечение в анамнезе [16, 17, 20].
В группе пациентов, которым был назначен варфарин, большинство были мужчины — 88 (78,6%), женщинам несколько реже назначались АВК — 24 (21,4%). Наши данные согласуются с данными S. Agarwal и соавт. [21], которые выявили аналогичную взаимосвязь.
Особенностью клинического эффекта варфарина является ограниченно узкий терапевтический диапазон МНО в сочетании с большой вариабельностью дозы, необходимой для адекватного антикоагулянтного эффекта [22]. АВК часто остаются недоиспользованными в клинической практике. Так, например, в ретроспективном когортном исследовании госпитализированных пациентов (n = 945) с ФП, проведенном в США, 86% пациентов были классифицированы в группу высокого риска ТЭО, из них только 55% были назначены АВК [23]. В нашем исследовании аналогичное количество больных были классифицированы в группу высокого риска осложнений, частота назначения АВК была еще более низкой.
Антикоагулянтная терапия считается адекватной, если время МНО в терапевтическом диапазоне составляет не менее 65% [5]. Доля времени нахождения МНО в целевом диапазоне в нашем исследовании составила 40,6%. Доля времени ниже и выше целевого диапазона была 48% и 11,4% соответственно. Средние значения времени нахождения МНО в терапевтическом диапазоне в европейских странах составляют 63% [24]. Другие исследования свидетельствуют о более низких показателях 51% и 56,7% [19, 25]. Недавнее исследование [25] показало, что более низкие показатели времени нахождения МНО в терапевтическом диапазоне имеют пациенты при наблюдении врачами общей практики в сравнении с теми, кто наблюдается кардиологами.
Доля времени нахождения МНО в целевом диапазоне в нашем исследовании составила 40,6%. Доля времени ниже и выше целевого диапазона была 48% и 11,4% соответственно. Средние значения времени нахождения МНО в терапевтическом диапазоне в европейских странах составляют 63% [24]. Другие исследования свидетельствуют о более низких показателях 51% и 56,7% [19, 25]. Недавнее исследование [25] показало, что более низкие показатели времени нахождения МНО в терапевтическом диапазоне имеют пациенты при наблюдении врачами общей практики в сравнении с теми, кто наблюдается кардиологами.
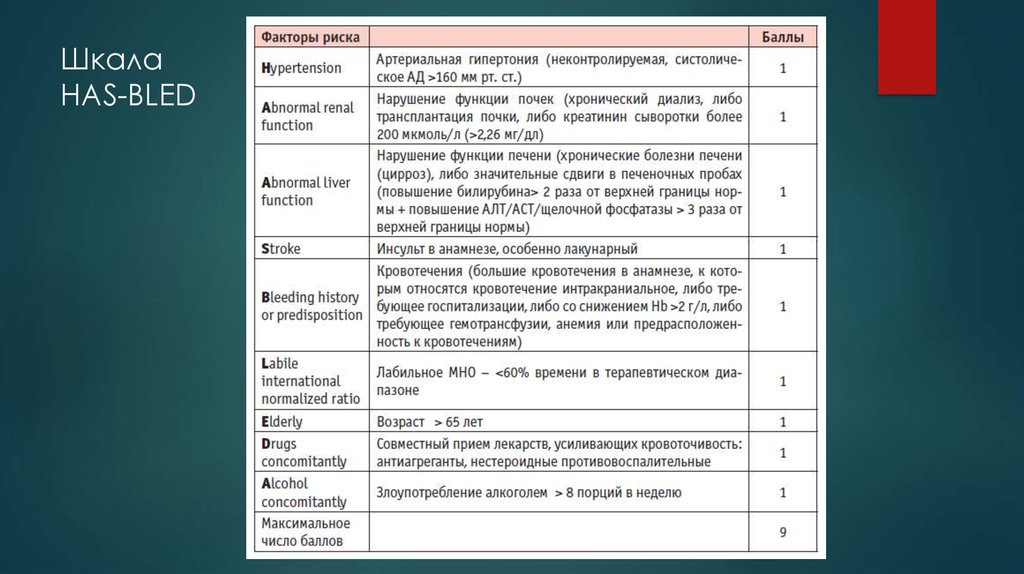
Профилактика тромбоэмболических осложнений ассоциирована со значительным увеличением риска кровотечений, современные руководства [5, 14] рекомендуют оценивать индивидуальный риск кровотечений перед началом антитромботической терапии независимо, назначаются ли АВК, или новые оральные антикоагулянты, ацетилсалициловая кислота (АСК)/клопидогрель, или только АСК (класс I; уровень доказанности А). Так как многие факторы риска инсульта являются и факторами риска кровотечений, риск больших кровотечений увеличивается у пациентов, имеющих больше баллов по шкале CHADS2 [7, 26, 27].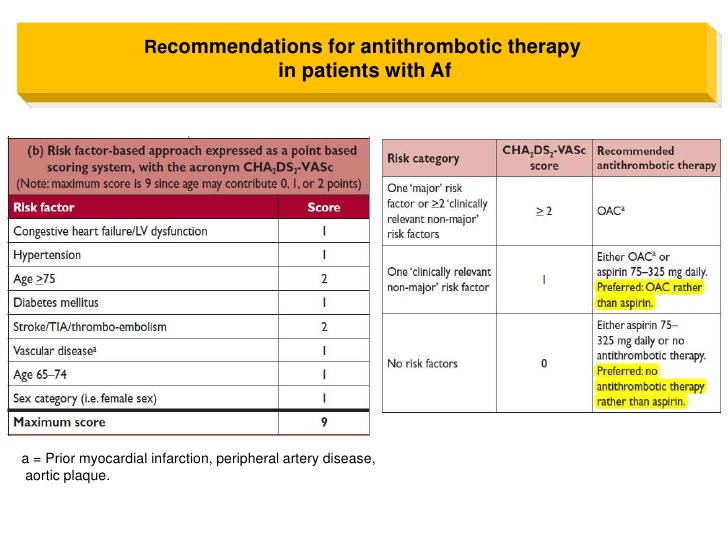 Сравнение различных схем оценки риска кровотечений, использованных в исследовании [28], у кагорты пациентов (n = 7329) с ФП показало, что схема HAS-BLED обладает лучшей предсказательной ценностью. Факторы риска, включенные в схему HAS-BLED (1 балл за каждый) — АГ, нарушение функции печени и почек, перенесенный инсульт, кровотечение в анамнезе, лабильное МНО, возраст ≥ 65 лет, сопутствующее применение лекарств или алкоголя. Предсказательная ценность HAS-BLED была оценена в сравнении с альтернативной схемой HEMORR2HAGES в датском регистре 118 584 пациентов с ФП [29]. HEMORR2HAGES, как и HAS-BLED балловая схема, в которой в 2 балла оценивается перенесенное кровотечение и один балл за другие факторы риска, включая: нарушение функции печени или почек, злоупотребление алкоголем, опухоль, возраст > 75 лет, уменьшенное количество тромбоцитов или нарушение их функции, неконтролируемая гипертония, анемия, генетические факторы, чрезмерный риск падения, инсульт [30]. Две использованные схемы имели одинаковую возможность предсказать частоту госпитализаций или частоту смерти от больших кровотечений в течение года.
Сравнение различных схем оценки риска кровотечений, использованных в исследовании [28], у кагорты пациентов (n = 7329) с ФП показало, что схема HAS-BLED обладает лучшей предсказательной ценностью. Факторы риска, включенные в схему HAS-BLED (1 балл за каждый) — АГ, нарушение функции печени и почек, перенесенный инсульт, кровотечение в анамнезе, лабильное МНО, возраст ≥ 65 лет, сопутствующее применение лекарств или алкоголя. Предсказательная ценность HAS-BLED была оценена в сравнении с альтернативной схемой HEMORR2HAGES в датском регистре 118 584 пациентов с ФП [29]. HEMORR2HAGES, как и HAS-BLED балловая схема, в которой в 2 балла оценивается перенесенное кровотечение и один балл за другие факторы риска, включая: нарушение функции печени или почек, злоупотребление алкоголем, опухоль, возраст > 75 лет, уменьшенное количество тромбоцитов или нарушение их функции, неконтролируемая гипертония, анемия, генетические факторы, чрезмерный риск падения, инсульт [30]. Две использованные схемы имели одинаковую возможность предсказать частоту госпитализаций или частоту смерти от больших кровотечений в течение года.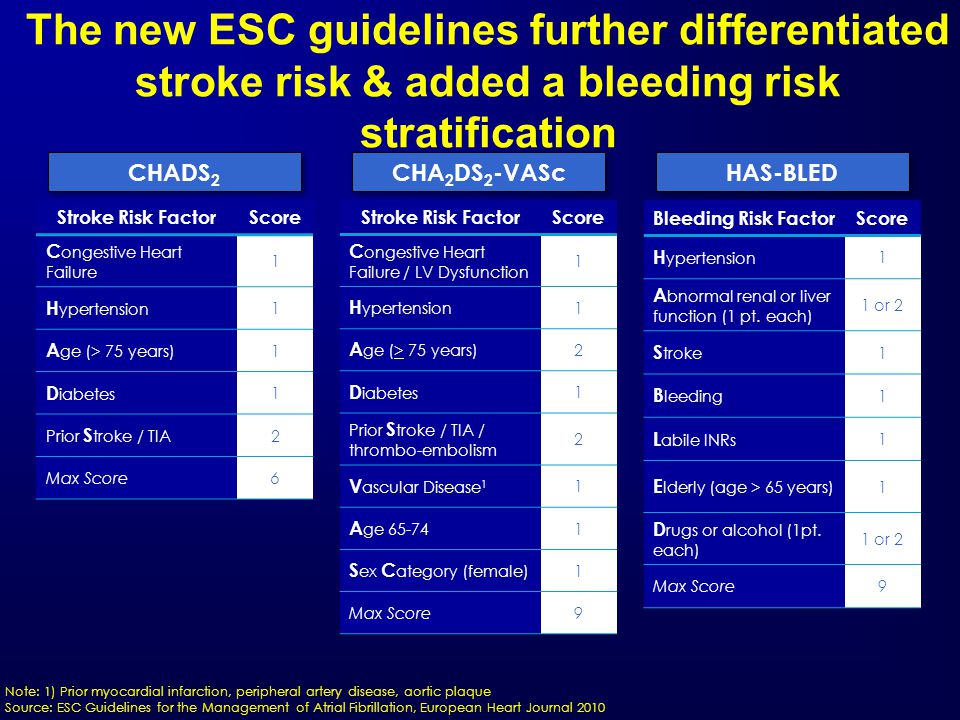 Обе схемы одинаково демонстрировали увеличение риска кровотечений по мере увеличения количества баллов [29]. Авторы заключили, что, однако, простота использования HAS-BLED дает преимущества, так как более легко может быть использована в клинической практике. Всероссийское научное общество кардиологов (ВНОК) и Всероссийское научное общество аритмологов (ВНОА) в своем руководстве 2011 года [14], Канадское сердечно-сосудистое общество (Canadian Cardiovascular Society, ССS) [26] и ESC 2012 г. [5] рекомендовали использование HAS-BLED перед началом антикоагулянтной терапии у больных с ФП. Значение индекса ≥ 3 баллов по этой шкале свидетельствует о высоком риске кровотечения и требует особой осторожности при назначении любого антитромботического препарата. Шкалу HAS-BLED следует использовать для идентификации модифицируемых факторов риска, которые можно корректировать, но не следует использовать для выделения пациентов, непригодных для антикоагулянтной терапии.
Обе схемы одинаково демонстрировали увеличение риска кровотечений по мере увеличения количества баллов [29]. Авторы заключили, что, однако, простота использования HAS-BLED дает преимущества, так как более легко может быть использована в клинической практике. Всероссийское научное общество кардиологов (ВНОК) и Всероссийское научное общество аритмологов (ВНОА) в своем руководстве 2011 года [14], Канадское сердечно-сосудистое общество (Canadian Cardiovascular Society, ССS) [26] и ESC 2012 г. [5] рекомендовали использование HAS-BLED перед началом антикоагулянтной терапии у больных с ФП. Значение индекса ≥ 3 баллов по этой шкале свидетельствует о высоком риске кровотечения и требует особой осторожности при назначении любого антитромботического препарата. Шкалу HAS-BLED следует использовать для идентификации модифицируемых факторов риска, которые можно корректировать, но не следует использовать для выделения пациентов, непригодных для антикоагулянтной терапии.
При анализе риска развития кровотечения с использованием шкалы HAS-BLED высокий риск кровотечения (3 и более баллов) имели 2 (1,8%) человека до назначения антикоагулянтной терапии.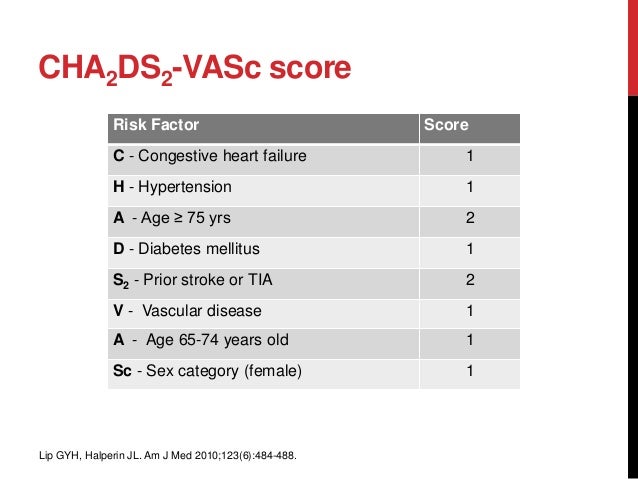 Во время терапии варфарином наблюдалось 3 (2,7%) случая крупных кровотечения (желудочно-кишечное кровотечение) и 22 (19,6%) случая малых кровотечений. Носовые кровотечения составили 6 (5,4%) случаев, десневые кровотечения — 6 (5,4%) случаев, гематурия — 6 (5,4%) случаев, маточное кровотечение — 1 (0,9%) случай, легочные кровотечения и кровохарканье — 3 (2,7%) случая. В 3 (2,7%) случаях наблюдались обширные гематомы.
Во время терапии варфарином наблюдалось 3 (2,7%) случая крупных кровотечения (желудочно-кишечное кровотечение) и 22 (19,6%) случая малых кровотечений. Носовые кровотечения составили 6 (5,4%) случаев, десневые кровотечения — 6 (5,4%) случаев, гематурия — 6 (5,4%) случаев, маточное кровотечение — 1 (0,9%) случай, легочные кровотечения и кровохарканье — 3 (2,7%) случая. В 3 (2,7%) случаях наблюдались обширные гематомы.
За время наблюдения у 14 (12,5%) человек, получавших варфарин, развился инсульт. В 7 (50%) случаях время нахождения в терапевтическом диапазоне составило менее 60%, в 2 (14,3%) случаях время нахождения в терапевтическом диапазоне было в пределах 61–70%, в 1 (7,1%) случае — более 70%. В 3 (21,4%) случаях инсульт развился у пациентов, которым был назначен варфарин, но впоследствии отказавшихся от дальнейшего приема препарата, в 1 (7,1%) случае варфарин был отменен в связи с развитием кровотечения.
Наше исследование показало, что в соответствии с современными рекомендациями большинство включенных в наше исследование пациентов были классифицированы в группу высокого риска ТЭО, лишь чуть больше трети больных, которым показано назначение антикоагулянтной терапии, ее получают в реальной клинической практике.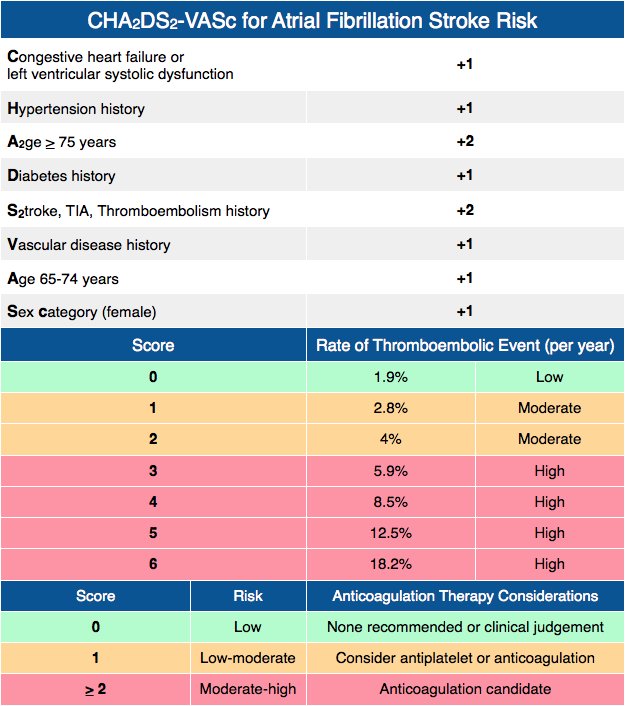 И даже среди пациентов, получающих терапию АВК, частота ТЭО остается высокой, по причине низкого нахождения показателей МНО в терапевтическом диапазоне, что не соответствует современным рекомендациям. Это требует необходимости разработки специальных программ обучения пациентов, увеличения количества подготовленных специалистов, кабинетов антикоагулянтной терапии на амбулаторном этапе с целью повышения качества антикоагулянтной терапии.
И даже среди пациентов, получающих терапию АВК, частота ТЭО остается высокой, по причине низкого нахождения показателей МНО в терапевтическом диапазоне, что не соответствует современным рекомендациям. Это требует необходимости разработки специальных программ обучения пациентов, увеличения количества подготовленных специалистов, кабинетов антикоагулянтной терапии на амбулаторном этапе с целью повышения качества антикоагулянтной терапии.
Выводы
- Частота назначения антикоагулянтной терапии пациентам среднего и высокого риска тромбоэмболических осложнений остается крайне низкой — 38,4% случаев.
- У пациентов, получающих антикоагулянтную терапию, доля времени нахождения МНО в целевом диапазоне не соответствует современным стандартам и составляет 40,6%.
- Большинство пациентов, перенесших тромбоэмболические осложнения, имели неудовлетворительные показатели времени нахождения МНО в терапевтическом диапазоне.
Литература
- Go A.
 S., Hylek E. M., Phillips K. A. et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study // JAMA. 2001; 285: 2370–2375.
S., Hylek E. M., Phillips K. A. et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study // JAMA. 2001; 285: 2370–2375. - Fuster V., Ryden L. E., Cannom D. S. et al. ACC/AHA/ECS 2006 guidelines for management of patients with atrial fibrillation — full text. A report of the American College of Cardiology / American Heart Assosiation Task Force on Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for Management of Patients With Atrial Fibrillation): developed in collaboration with the European Heart Rhythm Association and Heart Rhythm Society // Europace. 2006; 8: 651–745.
- Wolf P. A., Abbott R. D., Kannel W. B. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study // Stroke. 199; 22: 983–988.
- Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation: analysis of pooled data from five randomized controlled trials // Arch Intern Med.
 1994; 154: 1449–1457.
1994; 154: 1449–1457. - Camm J., Lip G. Y., Raffaele De Caterina et al. 2012 focused update of the ECS Guidelines for the management of atrial fibrillation. An update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of European Heart Rhythm Association // ECS Guidelines. 2012; 1–29.
- Stroke Risk in Atrial Fibrillation Working Group. Comparison of 12 risk stratification schemes to predict stroke in patients with nonvalvular atrial fibrillation // Stroke. 2008; 39: 1901–1910.
- Singer D. E., Albers G. W., Dalen J. E. et al. Antithrombotic therapy in atrial fibrillation: American College of Chest Physicians evidence based clinical practice guidelines (8 th Edition) // Chest. 2008; 133: 546 S—92 S.
- Lip G. Y., Nieualaat R., Pisters R. et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor based approach: The Euro Heart Survey on Atrial Fibrillation // Chest.
 2010; 137: 263–272.
2010; 137: 263–272. - Oleson J. B., Lip G. Y., Hansen M. L. et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study // BMJ. 2011; 342: d124.
- Van Staa T. P., Setakis E., Di Tanna G. L. et al. A comparison of risk stratification schemes for stroke in 79,884 atrial fibrillation patients in general practice // J Thromb Haemost. 2011; 9: 39–48.
- Tang R. B., Dong J. Z., Liu X. P. et al. Is CHA2DS2-VASc score a predictor of left atrial thrombus in patients with paroxysmal atrial fibrillation? // Thromb Haemost. 2011; 105: 1107–1109.
- Hart R. G., Perce L. A., Aguilar M. I. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation // Ann Intern Med. 2007; 146: 857–867.
- Сулимов В. А., Голицын С. П., Панченко Е. П., Попов С. В., Ревишвили А.
 Ш., Шубик Ю. В. Диагностика и лечение фибрилляции предсердий. Рекомендации ВНОК и ВНОА 2011.
Ш., Шубик Ю. В. Диагностика и лечение фибрилляции предсердий. Рекомендации ВНОК и ВНОА 2011. - Darkow T., Vanderplas A. M., Lew K. H. et al. Treatment patterns and real-world effectiveness of warfarin in nonvalvular atrial fibrillation within a managed care system // Curr Med Res Opion. 2005; 21: 1583–1494.
- Lackner T. E., Battis G. N. Use of warfarin for nonvalvular atrial fibrillation in nursing home patients // Arch Fam Med. 1995; 4: 1017–1026.
- Abdel-Latif A. K., Peng X., Messinger-Rapport B. J. Predictors of anticoagulation prescription in nursing home residents with atrial fibrillation // J Am Med Dir Assoc. 2005; 6: 128–131.
- Gurwitz J. H., Monette J., Rochon P. A. et al. Atrial fibrillation and stroke prevention with warfarin in the long-term care setting // Arch Intern Med. 1997; 157: 978–984.
- Lau E., Bungard T. J., Tsuyuki R. T. Stroke prophylaxis in institutionalized elderly patients with atrial fibrillation // J Am Geriatr Soc.
 2004; 52: 428–433.
2004; 52: 428–433. - McCormick D., Gurwitz J. H., Goldberg R. J. et al. Prevalence and quality of warfarin use for patients with atrial fibrillation in the long-term care setting // Ach Intern Med. 2001; 161: 2458–2463.
- Quilliam B. J., Lapane K. L. Clinical correlates and drug treatment of residents with stroke in long-term care // Stroke. 2001; 32: 1385–1393.
- Agarwal S., Bennett D., Smith D. J. Predictors of warfarin use in atrial fibrillation patients in the inpatient setting // Am J Cardiovasc Drugs. 2010; 10: 37–48.
- Ansell J., Hirsh J., Hylek E. et al. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians evidence-based clinical practice guidelines (8 th Edition) // Chest. 2008; 133: 160 S —98 S.
- Waldo A. L., Becker R. C., Tapson V. F., Colgan K. J. For the NABOR Steering Committee. Hospitalized patients with atrial fibrillation and a high risk of stroke are not being provided with adequate anticoagulation // J Am Coll Cardoil.
 2005; 46: 1729–1736.
2005; 46: 1729–1736. - Gallagher A. M., Setakis E., Plumb J. M. et al. Risk of stroke and mortality associated with suboptimal anticoagulation in atrial fibrillation patients // Tromb Haemost. 2011; 106: 968–977.
- Han S. Y., Palmery S. T., Broderick S. H. et al. Quality of anticoagulation with warfarin in patients with nonvalvular atrial fibrillation in the community setting // J Electrocardiol. 2012; Article in Press.
- Cairns J. A., Connolly S., McMurtry S. et al. Canadian Cardiovascular Society atrial fibrillation guidelines 2010: prevention of stroke and systemic thrombormbolism in atrial fibrillation and flutter // Can J Cardiol. 2011; 27: 74–90.
- Hylek E. M., Evans-Molia C., Shea C. et al. Major hemorrhage and tolerability of wafarin in the first year of therapy among elderly patients with atrial fibrillation // Circulation. 2007; 115: 2689–96.
- Lip G. Y., Frison L., Halperin J.
 L., Lane D. A. Comparative validation of novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLEND (Hypertention, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposion, Labile INR, Elderly, Drugs/Alcohol Concomitantly) score // J Am Coll Cardiol. 201; 57: 173–80.
L., Lane D. A. Comparative validation of novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLEND (Hypertention, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposion, Labile INR, Elderly, Drugs/Alcohol Concomitantly) score // J Am Coll Cardiol. 201; 57: 173–80. - Olesen J. B., Lip G. Y., Hansen P. R. et al. Bleeding risk in ‘real word’ patients with atrial fibrillation: comparison of two established bleeding prediction schemes in nationwide cohort // J Thromb Haemost. 2011; 9: 1460–1467.
- Gaga B. F., Yan Y., Milligan P. E. et al. Clinical classification schemes for predicting hemorrhage: results from the National Registry of Atril Fibrillation (NRAF) // Am Heart J. 2006; 151: 713–719.
Е. В. Сердечная*, доктор медицинских наук, профессор
Е. Л. Чумак*, **
* ГБОУ ВПО Северный ГМУ, Архангельск
** ФГБУЗ СМКЦ им. Н. А. Семашко ФМБА РФ, Москва
Н. А. Семашко ФМБА РФ, Москва
Контактная информация об авторах для переписки: [email protected]
Chads₂ Оценка для риска инсульта фибрилляции аритмии
Болезнь
SELECT …
Специальность
SELECT …
. В ожидании
Адрес электронной почты
Пароль
Показать
Забыли пароль?
ВойтиАдрес электронной почты
Введите адрес электронной почты, и мы вышлем вам ссылку для сброса пароля.
Получить новый пароль
Чтобы сохранить избранное, вы должны войти в систему.
Создание учетной записи является бесплатным, простым и занимает около 60 секунд.
ВойтиСоздать учетную запись
Войти, чтобы связать избранное и недавно использованные расчеты
Адрес электронной почты
Пароль
Показать
Забыли пароль?
Войти Главные исследователи исследования просят вас использовать здесь официальную версию модифицированной оценки.
Войдите, чтобы скопировать результаты вашего пациента!
Log in
When to Use
Pearls/Pitfalls
Why Use
CHF history
Hypertension history
Age ≥ 75 years
Diabetes mellitus history
Симптомы инсульта или ТИА ранее
Результат:
Пожалуйста, заполните обязательные поля.
Д-р Брайан Гейдж
Брайан Ф. Гейдж, доктор медицинских наук, магистр наук, профессор медицины Вашингтонского университета в Сент-Луисе, где он преподает проектирование результатов и клинических (DOC) исследований и практики в Barnes-Jewish Hospital, где он руководит программой клинического обучения и исследований (C-STAR) для медицинских ординаторов. Он руководит стипендией Вашингтонского университета в области общих медицинских наук (GMS). Доктор Гейдж изучает антитромботическую терапию и тромбозы, включая кардиоэмболический инсульт.
Он руководит стипендией Вашингтонского университета в области общих медицинских наук (GMS). Доктор Гейдж изучает антитромботическую терапию и тромбозы, включая кардиоэмболический инсульт.
To view Dr. Brian Gage’s publications, visit PubMed
- About the Creator
Dr. Brian Gage
Вы доктор Брайан Гейдж?
- Связанные расчеты
- Авторы контента

Выберите…
Заявка на патент
Адрес электронной почты
Пароль
Показать
Забыли пароль?
ВойтиАдрес электронной почты
Введите адрес электронной почты, и мы вышлем вам ссылку для сброса пароля.
Получить новый пароль
Чтобы сохранить избранное, вы должны войти в систему.
Создание учетной записи является бесплатным, простым и занимает около 60 секунд.
ВойтиСоздать учетную запись
Войти, чтобы связать избранное и недавно использованные расчеты
Адрес электронной почты
Пароль
Показать
Забыли пароль?
Войти Главные исследователи исследования просят вас использовать здесь официальную версию модифицированной оценки.
Войдите, чтобы скопировать результаты вашего пациента!
Журнал в
Когда использовать
жемчужины/подводные камни
Почему использование
Возраст
65-74
+1
9006
+1
9006
+1
96996699111111111111111116191161911619116191161911619116196191161
911966966996699161911619116191161911619.
. Анамнез
Артериальная гипертензия в анамнезе
Инсульт/ТИА/тромбоэмболия в анамнезе
Сосудистые заболевания в анамнезе (перенесенный ИМ, заболевание периферических артерий или аортальная бляшка)
История диабета
Результат:
Пожалуйста, заполните обязательные поля.
Доктор Грегори Лип
От Создателя
Почему вы разработали шкалу CHA₂DS₂-VASc? Был ли клинический опыт, который вдохновил вас на создание этого инструмента для клиницистов?
Доступность пероральных антикоагулянтов, не являющихся антагонистами витамина К (НОАК, ранее называемых новыми или новыми пероральными антикоагулянтами), привела к серьезным изменениям в области профилактики инсульта при мерцательной аритмии (ФП). Клиницисты также становятся лучше. в понимании того, как управлять варфарином, признавая важность среднего времени в терапевтическом диапазоне (TTR).Вновь появляются новые данные о недостаточных доказательствах эффективности и безопасности аспирина для профилактики инсульта при ФП.Более ранние CHADS 2 Шкала была разработана для выявления пациентов с «высоким риском» для варфарина, но многие распространенные (и важные) факторы риска инсульта при ФП не включены в CHADS 2 .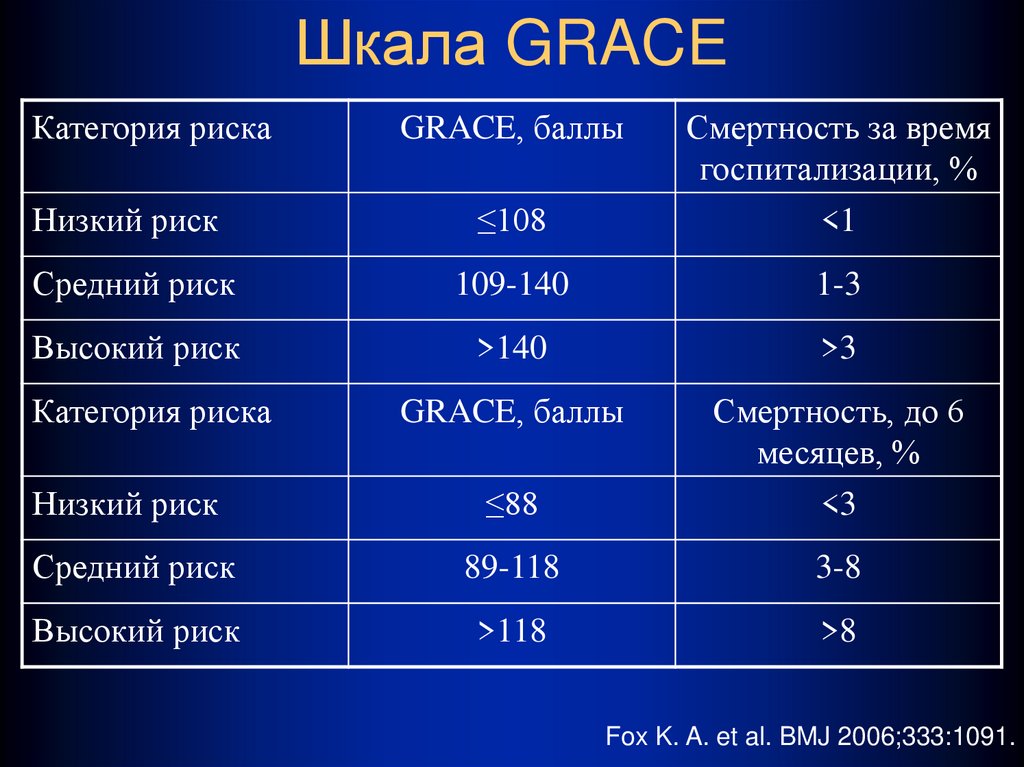 CHA₂DS₂-VASc был разработан, чтобы лучше учитывать распространенные факторы/модификаторы риска инсульта. Многочисленные проверочные исследования показали, что CHA 2 DS 2 -VASc так же хорош, а возможно, и лучше, чем CHADS 2 в прогнозировании пациентов с высоким риском, но CHA 2 DS 2 -VASc, безусловно, лучше при прогнозировании пациентов «низкого риска».
CHA₂DS₂-VASc был разработан, чтобы лучше учитывать распространенные факторы/модификаторы риска инсульта. Многочисленные проверочные исследования показали, что CHA 2 DS 2 -VASc так же хорош, а возможно, и лучше, чем CHADS 2 в прогнозировании пациентов с высоким риском, но CHA 2 DS 2 -VASc, безусловно, лучше при прогнозировании пациентов «низкого риска».
Какие у вас есть жемчужины, подводные камни и/или советы для пользователей шкалы CHA 2 DS 2 -VASc? Были ли случаи, когда оно применялось, интерпретировалось или использовалось ненадлежащим образом?
В более старых рекомендациях основное внимание уделялось выявлению пациентов с ФП с «высоким риском» инсульта для назначения лечения варфарином; однако многие исследования показали недостаточное использование варфарина среди таких пациентов с «высоким риском». В 2014 году руководство AHA/ACC/HRS рекомендовало использовать CHA 9. 0264 2 DS 2 -Шкала VASc как предпочтительный инструмент оценки риска инсульта.
0264 2 DS 2 -Шкала VASc как предпочтительный инструмент оценки риска инсульта.
Как лучше всего подойти к профилактике инсульта при ФП с помощью шкалы CHA 2 DS 2 -VASc?
В 2012 году руководство Европейского общества кардиологов (ESC) рекомендовало изменить клиническую практику, чтобы первоначально сосредоточиться на выявлении пациентов с «действительно низким риском», которым не требуется антитромботическая терапия. Это пациенты с низким риском CHA 2 DS 2 — Оценка VASc 0 (мужчины) или 1 (женщины). Впоследствии, следующим шагом будет предложить эффективную профилактику инсульта (т.е. пероральные антикоагулянты) тем, у кого есть ≥1 дополнительный фактор риска инсульта.
Какие рекомендации вы дадите поставщикам медицинских услуг после получения результатов оценки CHA 2 DS 2 -VASc? Есть ли какие-либо корректировки или обновления, которые вы бы внесли в оценку, учитывая недавние изменения в медицине?
Используйте подход, рекомендованный в рекомендациях ESC или NICE от 2012 г.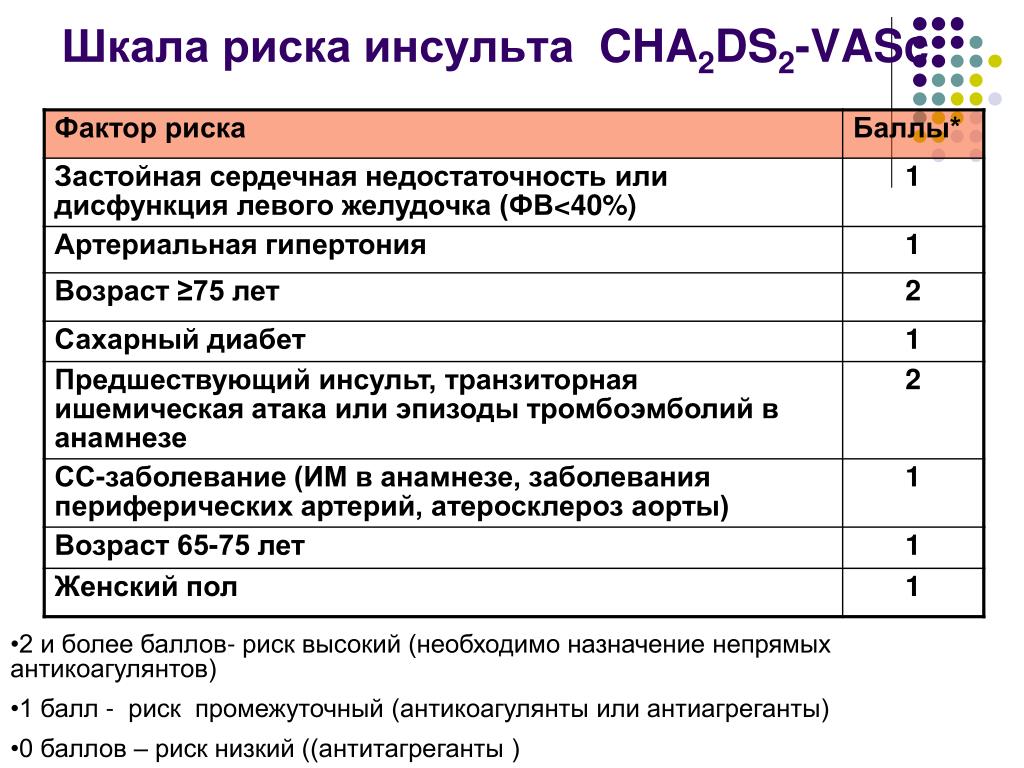 – первый шаг, определите пациентов с НИЗКИМ РИСКОМ, т. е. с показателем CHA₂DS₂-VASc 0 (мужчины) или 1 (женщины), которые не нуждаются в какой-либо антитромботической терапии, Следующий или Следующий шаг – предложить эффективную профилактику инсульта всем остальным с 1 или более дополнительными факторами риска инсульта. Согласно рекомендациям NICE, аспирин не следует использовать для профилактики инсульта при ФП — он минимально эффективен, небезопасен и нерентабелен.
– первый шаг, определите пациентов с НИЗКИМ РИСКОМ, т. е. с показателем CHA₂DS₂-VASc 0 (мужчины) или 1 (женщины), которые не нуждаются в какой-либо антитромботической терапии, Следующий или Следующий шаг – предложить эффективную профилактику инсульта всем остальным с 1 или более дополнительными факторами риска инсульта. Согласно рекомендациям NICE, аспирин не следует использовать для профилактики инсульта при ФП — он минимально эффективен, небезопасен и нерентабелен.
Встречались ли вы с коллегами, которые определяли, кто и какой тип антикоагулянта получает, на основе оценки CHA 2 DS 2 -VASc, а не только на основе CHADS 2 ?
Определенно. CHADS 2 из 0 НЕ является низким риском, и частота инсультов может достигать 3,2% в год при отсутствии лечения (Olesen et al, Thromb Haemostat 2012). Использование CHA₂DS₂-VASc может дополнительно уточнить стратификацию риска инсульта у пациентов с CHADS 2 Оценка 0 для выявления тех, у кого пероральные антикоагулянты по-прежнему будут иметь существенный положительный эффект.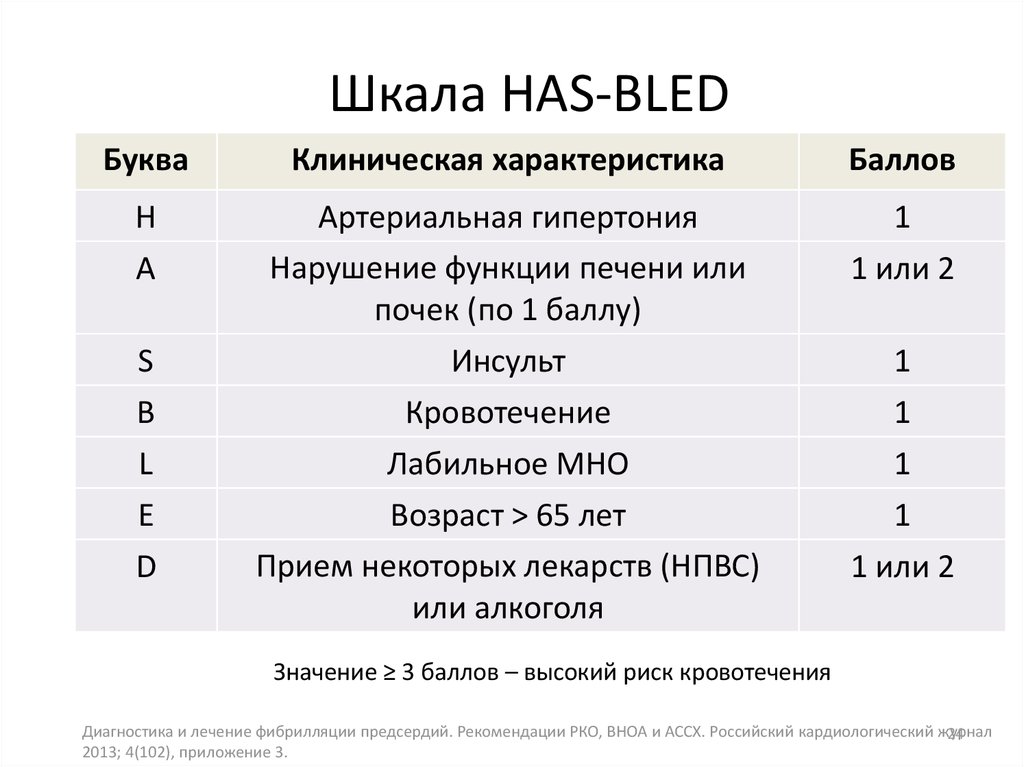
О создателе
Грегори Лип, доктор медицинских наук, заведующий кафедрой сердечно-сосудистой медицины Дэвида А. Прайса-Эванса в Ливерпульском университете и почетный консультант-кардиолог Ливерпульской больницы сердца и грудной клетки. Он также является исследователем в Ольборгском исследовательском центре тромбоза Ольборгского университета в Дании. Доктор Лип является одним из ведущих мировых экспертов в области стратификации риска мерцательной аритмии, и его исследования напрямую используются в широко используемых шкалах CHA₂DS₂-Vasc и HAS-BLED.
To view Dr. Gregory Lip’s publications, visit PubMed
- About the Creator
Dr.


 S., Hylek E. M., Phillips K. A. et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study // JAMA. 2001; 285: 2370–2375.
S., Hylek E. M., Phillips K. A. et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study // JAMA. 2001; 285: 2370–2375.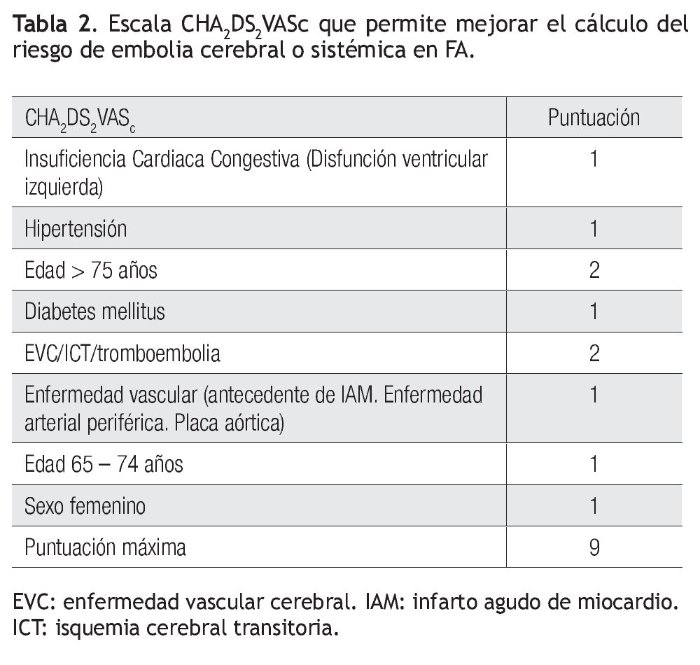 1994; 154: 1449–1457.
1994; 154: 1449–1457. 2010; 137: 263–272.
2010; 137: 263–272. Ш., Шубик Ю. В. Диагностика и лечение фибрилляции предсердий. Рекомендации ВНОК и ВНОА 2011.
Ш., Шубик Ю. В. Диагностика и лечение фибрилляции предсердий. Рекомендации ВНОК и ВНОА 2011. 2004; 52: 428–433.
2004; 52: 428–433. 2005; 46: 1729–1736.
2005; 46: 1729–1736.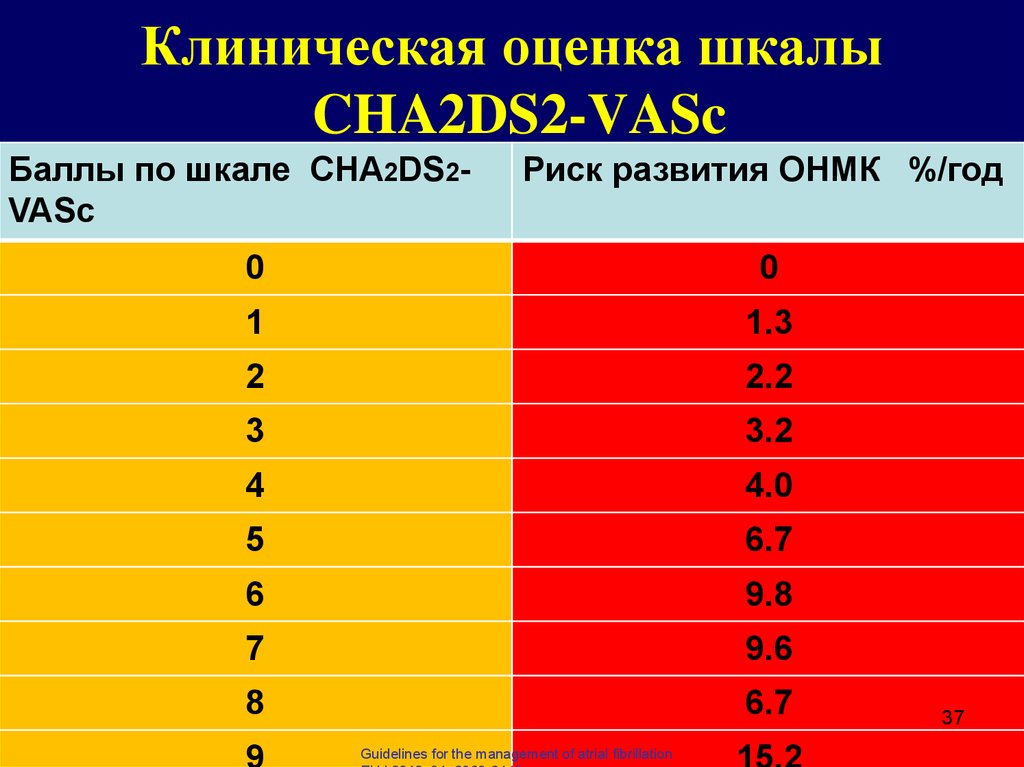 L., Lane D. A. Comparative validation of novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLEND (Hypertention, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposion, Labile INR, Elderly, Drugs/Alcohol Concomitantly) score // J Am Coll Cardiol. 201; 57: 173–80.
L., Lane D. A. Comparative validation of novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLEND (Hypertention, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposion, Labile INR, Elderly, Drugs/Alcohol Concomitantly) score // J Am Coll Cardiol. 201; 57: 173–80.